2020-2023年辽宁省小肠结肠炎耶尔森菌表型分布和分子特征研究
2024-03-15孙婷婷魏彤竹王晓丹刁文丽
李 雪,孙婷婷,魏彤竹,王晓丹, 刁文丽
小肠结肠炎耶尔森菌(Yersiniaenterocolitica,YE)是一种人兽共患致病菌,在自然界中广泛存在,主要传播途径是粪口传播。YE宿主除人以外,还有猪、牛、鸡、狗、羊、鼠等。人感染YE后,除可引起胃肠道症状外,还可引起肠外疾病如突眼性甲状腺肿、反应性关节炎、心内膜炎、结节性红斑等。由于YE具有嗜冷性,可在4 ℃冷藏条件下继续生长和繁殖,对冷链条件下储运食品的安全性提出了严峻挑战[1]。
YE具有较多的生物型、血清型和基因型,各种型别与其致病力密切相关,且分布特征呈现地区性[2]。如生物型1A菌株通常被认为无致病性,但近年来却发现少数1A型菌株也携带有毒力基因ail,从而具有致病性,因此开展YE表型和分子特征研究,对我国食源性YE的进化机制、传播途径和致病性认识有重要作用[3]。
脉冲场凝胶电泳方法(Pulsed Field Gel Electrophoresis,PFGE)已经是非常成熟的标准化技术方法,已实现数据分析的网络化,曾是大部分致病菌暴发流行时分型溯源的金标准,可很好的用于YE的溯源研究。而多位点序列分型方法(MultiLocus Sequence Typing,MLST)同样具有较高的分离力,可以通过全球比对数据库得到更多的关于进化和亲缘关系的分析资料,适合长期大范围的流行病学调查,所得实验结果因可提供更细致的序列信息,从而展示菌株的进化过程,且容易在不同实验室间做对比分析,甚至在某些情况下比PFGE更具鉴别力,因此MLST方法在亲缘关系、流行病学和致病研究等方面占有较高优势[2]。
1 材料与方法
1.1 样品来源 按照《辽宁省食品中小肠结肠炎耶尔森菌研究工作方案》[4](以下简称方案)要求,2020-2023年6-9月份,在辽宁省农贸市场共采集样品2 748份(996份生猪肉、876份生牛肉和876份生鸡肉)。2020-2022年480样品来源全部为辽宁省沈阳市农贸市场,而2023年2 268样品来源为辽宁省内14个市农贸市场。
1.2 菌种来源 从1.1样品中分离鉴定的YE分离株60株,其中2020-2022年分离株20株,2023年分离株40株。标准菌株:CMCC(B)52204来自于辽宁省疾控中心。PFGE实验分子量标准菌株SalmonellaBraenderupH9812来自于国家食品安全风险评估中心。
1.3 主要仪器与试剂 脉冲场凝胶电泳系统(美国伯乐CHEFMAPPER-XA)、凝胶成像系统(伯乐GelDocXR+)、培养箱(海河HHB11-22)、PCR仪(伯乐S1000)、全自动微生物生化鉴定仪和比浊仪(法国梅里埃VITEK2)。仪器均通过计量检定或校准。
改良磷酸盐缓冲液(北京陆桥批号211009)、CIN-1平板(北京陆桥批号210827)、YE血清(日本生研批号200280)、GelRed荧光核酸凝胶染色试剂(Bio-Rad批号18G1231)、TBE缓冲液(Promega批号20190425)、DNA提取试剂盒(ABT批号T202211100)、YE生物分型生化试剂(北京陆桥20190731)、API20E生化试剂条(法国梅里埃批号1009659610)。毒力基因PCR扩增引物和MLST管家基因PCR扩增引物按照《方案》合成。
1.4 方法
1.4.1 增菌、分离和鉴定 按照《方案》要求对2 748份样品进行冷增菌。取25 g生肉样品,置入225 mL改良磷酸盐缓冲液中增菌培养,所有样品增菌液于4 ℃中冷增菌20 d。使用普通PCR方法对冷增菌后的样品进行YE初筛。首先使用DNA提取试剂盒提取样品中菌株基因组DNA,对样品中基因组DNA进行YE种foxA特征基因扩增,根据扩增结果对样品中YE的污染情况进行初步判断。根据增菌液PCR初筛结果,将YE检测阳性的增菌液充分混匀后,三区划线接种于CIN-1平板,26 ℃培养48 h,选取典型YE菌落进行纯培养。采用全自动微生物生化鉴定系统VITEK2和API20E试剂进行生化鉴定。
1.4.2 血清和生物分型 按照《GB4789.8-2016食品安全国家标准食品微生物学检验小肠结肠炎耶尔森氏菌检验》[5]中玻片凝集法对YE分离株进行血清和生物分型。根据生化反应不同,可将其分为生物1A、1B、2、3、4、5共6个生物型。
1.4.3 毒力基因检测 按照《方案》对YE分离株进行ail、ystA、ystB、yadA、virF、foxA、rfbC基因检测。PCR扩增参数:94 ℃预变性5 min;94 ℃变性30 s;57 ℃退火30 s;72 ℃延伸30 s;30个循环;最后72 ℃延伸5 min。扩增产物于1.5%琼脂糖凝胶中电泳。根据foxA基因PCR初筛结果,可对样品中小肠结肠炎耶尔森菌或假结核耶尔森菌的污染情况进行初步判断。
1.4.4 PFGE分子分型和聚类分析 按照小肠结肠炎耶尔森氏菌检验PFGE操作标准进行分型研究。应用BioNumerics 7.6软件对PFGE图谱进行聚类分析。
1.4.5 MLST分子分型和聚类分析 根据https://pubmlst.org/公布的MLST分型方法,目的基因选择7个管家基因(adk、argA、aroA、glnA、thrA、tmk、trpE)进行分析比对。对YE分离株进行管家基因PCR扩增,DNA纯化产物由沈阳鑫脉生物公司进行测序。将测序结果提交网站https://pubmlst.org/数据库,比对测序基因的等位基因号得到测序株的ST型,按顺序连接测序株的等位基因序列,应用SPSS13.0软件,UPGMA聚类法对分离株进行聚类分析[11]。并将ST型字符型数据导入BN软件,应用goeBURST distance聚类分析生成最小生成树图。
1.4.6 分型方法 分辨力的计算最终使用Hunter和Gaston的方法计算出各种分型方法的区分能力即分辨力(DI)[6]。
上述公式中,DI是分辨力,s是型别数,nj是j型菌株数,N是菌株总数。
2 结 果
2.1 样品初筛结果 2 748份样品增菌液通过对YE的foxA特征基因扩增,初筛得到60份阳性样品,总检出率为2.2%。每份阳性样本中分离到1株YE,共得到60株YE。具体情况见表1。2023年辽宁省11个市均有检出,阳性样本检出率较高的地区为:沈阳市检出率3.44%(26/756),铁岭市检出率1.85%(2/108),丹东市检出率1.85%(2/108),大连市检出率为1.38%(2/108)。

表1 YE分离株不同来源阳性样品分离情况
2.2 血清型、生物型及毒力基因型结果 60株YE鉴定为4个血清型、2个生物型、8个毒力基因型。14株血清型为O∶3的YE分离株全部携带rfbC基因。根据分离株毒力基因携带和生物型鉴定情况,38株血清型O∶8分离株(生物1A型)是非致病菌,非致病株占比63.3%,其余22株为致病株,致病株占比36.7%。具体血清型、生物型和毒力基因型情况见表2。
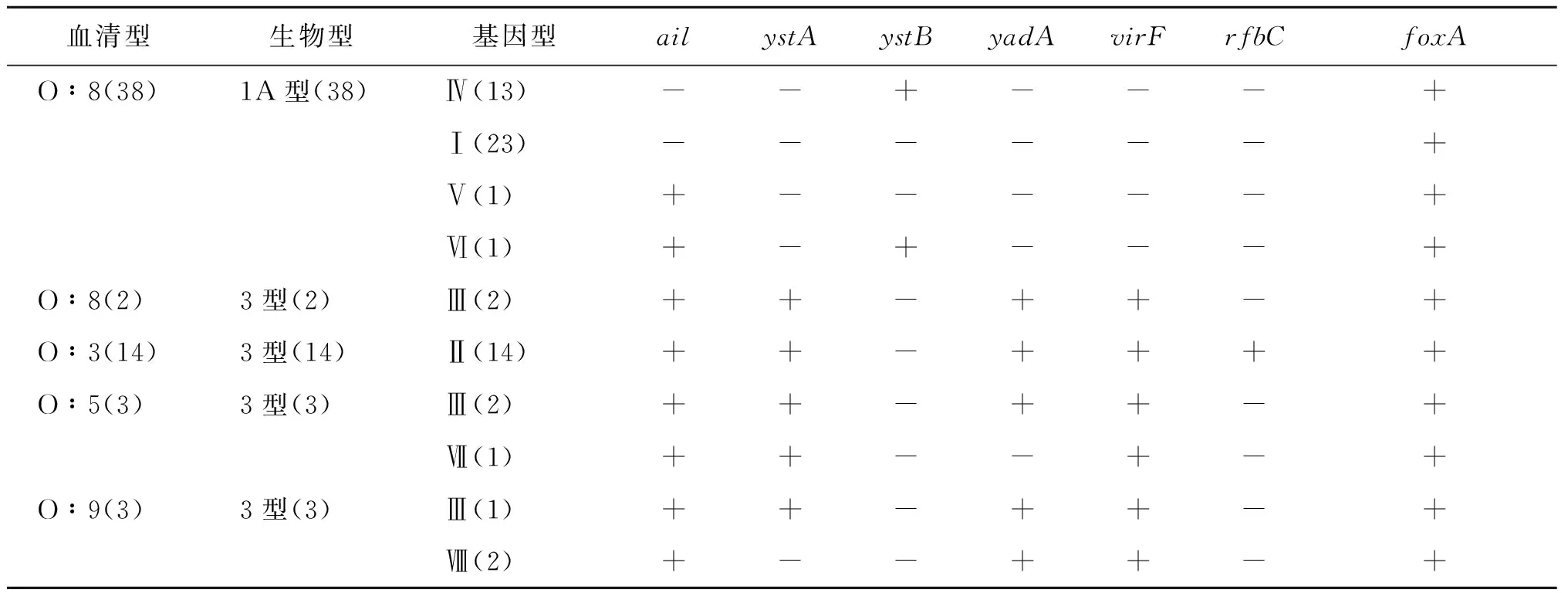
表2 60株YE分离株分型结果
2.3 PFGE分型结果 本研究对2023年40株YE分离株进行了PFGE分型实验,PFGE的分辨力(DI)为0.954。根据Tenove FC等提出的有关菌株同源性的判别标准,折换成按相似度>85%为相近菌株,进行分型[7]。40株YE分离株可分成23个型,其中有8组优势带型,主要分子型为A-G组。相同血清型和ST型菌株间相似度高。毒力基因型接近的菌株相似度高,PFGE聚类结果见图1。

图1 2023年40株YE分离株PFGE分型聚类图Fig.1 PFGE cluster analysis results of PFGE for 40 YE strains in 2023
2.4 MLST分型结果分析 MLST分辨力(DI)为0.948。按UPGMA聚类法中∑2 <5,ST型可聚类分为10组,相同ST型相似度高。ST252与ST340、ST178与ST157和ST165、ST166与ST290、ST429与ST470相似度高,亲缘关系近。60株YE分离株共分为29个ST型,普通ST型16种(37株),与江苏省人源相同ST型5种(13株),新发现型8种(10株),共29种ST型。2016-2019年江苏省人源YE分离株6种ST型33株,ST17(6株),ST178(6株),ST157(5株),ST404(4株),ST340(3株),ST3(3株),ST166(2株),ST335(2株),ST703(2株)[7-9]。本研究将辽宁省YE分离株60株ST型与江苏省人源YE分离株33株ST型共同进行MLST分型研究。ST3、ST252位于图2核心位置向四周发散。
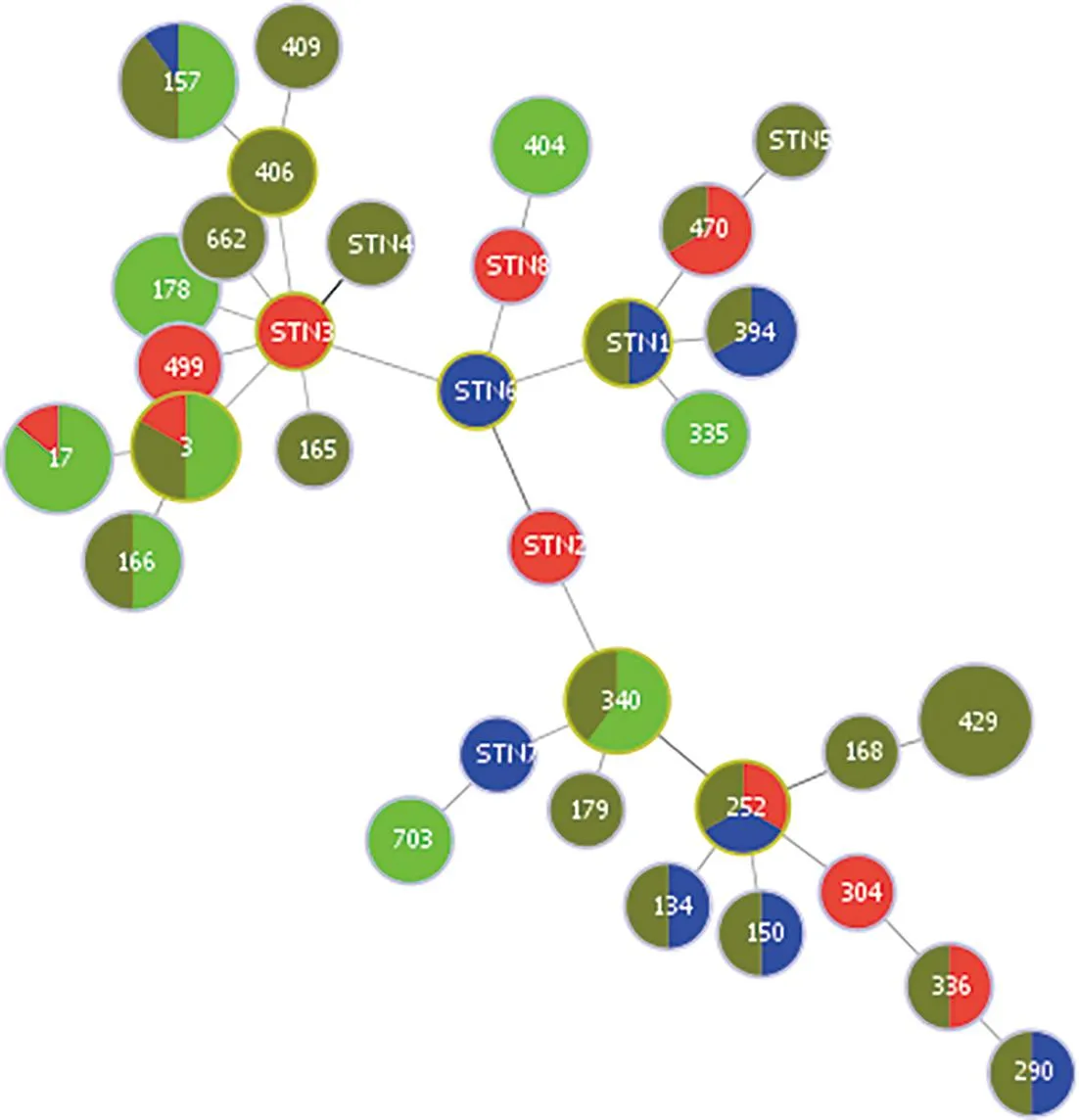
图2 93株YE分离株MLST分型最小生成树图Fig.2 Minimum spanning tree of MLST typing for 93 YE isolates
MLST最小生成树图及聚类结果见图2。主要MLST分子型占比分析情况见表3。

表3 毒力基因型和ST型
3 讨 论
3.1 检出率分析 小肠结肠炎耶尔森菌是一种可通过食物进行传播的人兽共患病病原菌,2020-2023年辽宁省YE分离率分别为3.1%、5.6%、3.8%、1.8%,提示由于辽宁省人民生活水平的提高和疾病防控意识的增加,辽宁省YE流行强度可能会出现下降趋势。本研究显示,猪体内的YE检出率较高,猪是辽宁省地区近年来YE的重要传染源和宿主。安徽省六安市2015-2018年监测结果显示当地YE分离率高达12.22%[8],江苏省2016-2019年监测标本YE分离率为2.91%[10],河南省2011-2017年YE分离率则为3.06%[11],江苏省和河南省与辽宁省检出情况相似,提示国内其他地区YE分离率差异较大。
由于国内YE检出率一直较低[3],本研究为了提高YE检出率,在采样时做出以下调整:1)根据本项目前期工作基础,沈阳地区YE检出率高,本研究对沈阳市样品采集量大,各市样品采集量有所不同;2)根据国家风险评估中心的前期工作基础,猪、牛、鸡中YE检出率高,且猪是国内近年来YE的重要传染源和宿主[4],本研究中猪的样品采集量大,其次为牛和鸡;3)采样时间确定在了检出率较高污染较重的夏季,且采样地点选择了污染较严重的集市和农贸市场。
3.2 血清型分析 YE血清型非常多,曾经报道的血清型至少有60个,我国流行血清型是O∶1、O∶2、O∶3、O∶5、O∶8、O∶9[12],而血清型O∶8菌株绝大部分是非致病株。近几年,占比最高的致病性YE流行血清型为O∶3,O∶3成为国内外最主要致病性YE流行血清型[13-14],本研究显示,2020-2023年辽宁省食源性YE分离株流行致病血清型是O∶3,O∶5和O∶9少量分布的特点,这与江苏省2016-2019年人源株血清型分布相似[10],这与我国仅存在O∶3和O∶9两种血清型致病株的报道存在差异[13]。
表2中血清型显示,22株致病株全部分离自沈阳市样品,这些致病菌株具有引起食源性疾病的风险,而且沈阳市样品YE检出率最高,提示沈阳地区YE污染较严重,致病菌株在沈阳市呈流行趋势,沈阳市地区发生食源性疾病风险大,应引起重视。另外,辽宁省除沈阳市外,其他13个市样品中,均有YE检出,检出率低,YE地域流行特征不明显。
3.3 生物型分析 根据生化结果YE还可分为6个生物型,据文献报道,美国、欧洲地区和江苏省在人类临床样本中经常检出1A型分离株[9-10],但它们的致病性仍有争议,研究显示1A型菌株对人体血清补体杀伤普遍表现出抗性,这表明生物1A型菌株可能具有致病的潜力,但它们的致病机制仍不清楚。本研究显示,辽宁省动物源YE存在2个生物型,其中1A型为优势生物型,其次为3型。
本研究发现,辽宁省动物源分离株与江苏省人源YE分离株相同ST型共13株,其中10株为生物3型,3株(ST157)是生物1A型,而在江苏省研究中显示这些人源相同ST型全部是生物1A型[9-10],江苏省绝大部分人源YE分离株是生物1A型。辽宁省沈阳市有两株生物1A型YE(sy15和sy26)是携带毒力基因ail的且MLST型为ST340,而ST340未有文献报道有从人源菌中得到,提示生物型、ST型和致病性并不一致,应重点加强对于生物1A型菌株的研究工作。
血清型O∶3分离株全部携带rfbC基因,说明rfbC基因是用于检测血清型O∶3的YE分离株的特异性基因,这与文献结果相同[15]。2株血清型O∶8分离株携带毒力基因(Ⅱ型),为致病菌株,而大多数血清型O∶8菌株缺乏毒力质粒不携带毒力基因,为非致病菌,个别血清型O∶8菌株单独携带ail基因,致病性有待进一步验证。
3.5 分子分型分析 沈阳市分离株sy35和sy28(血清型O∶8、生物3型)与沈阳市其他7株致病菌分离株(血清型O∶3、生物3型)PFGE分子型相似度高,PFGE分子型都是A组,提示虽然一般情况下血清型O∶8是非致病菌株,但这两株分离株为致病菌,除了rfbC基因,其他毒力基因全部携带,致病力不容小觑,PFGE分子型A组为毒力基因Ⅱ和Ⅲ型、血清型O∶3、生物型3的优势带型。fs29、tl13、dl24(血清型O∶8、生物1A型)与致病菌PFGE分子型相似度高,虽然为非致病性菌株,下一步应该对其深入研究,这些菌株应引起注意。40株分离株中,相同血清型菌株PFGE分子型相似度高,携带毒力基因情况越相似的菌株PFGE分子型相似度越高。相同的ST型菌株PFGE分子型相似度高,相同的ST型菌株基本都被分成相同的组,提示ST型与PFGE分子型具有一致性。PFGE分子型A组为2023年辽宁省沈阳市地区流行分子型。
辽宁省地区ST型呈现多样化状态,YE基因组在进化过程中容易大段的插入或丢失,所以7个管家基因变异度较高,ST型呈分散分布。图2显示,所有ST型以ST3、ST252为核心,呈分散分布。ST3位于聚类图上核心位置向四周发散,并有4个与江苏省人源相同的ST型(ST157、ST166、ST17、ST178)相关的主要进化方向。ST252也位于聚类图上核心位置有一个与江苏省人源相同的ST型(ST340)相关的主要进化方向。辽宁省60株分离株中数量最多的ST型为ST429(8株)只在动物源样品中分离到,ST157(5株)、ST3(3株)、ST340(2株)、ST166(2株)、ST17(1株)这5个ST型在江苏省地区人源样品中也分离到,欧洲地区均有报道,且ST17和ST157在人源分离株中数量最多,ST157型在欧洲地区和美国YE爆发流行时有检出的相关报道[14],提示这些分离株具有引起食源性疾病的高风险,应该引起高度重视。
既往研究显示,YE分离情况大致呈现以猪为“圆心”向四周以同心圆形式发散的分布理论[11]。本研究采集3种肉类标本中均有菌株检出,猪中分离率最高,牛和鸡中分离率也不低,提示辽宁省地区YE动物宿主分布并不单一,从猪分离到与人源菌(江苏省)相同ST型的菌株最多,提示猪是辽宁省地区重要的宿主和传染源。下一步,将重点加入辽宁省人源YE分离株和食品YE分离株的相关性研究。辽宁省内,猪、牛和鸡饲养比较普遍,在动物饲养、屠宰、运输和肉制品加工过程中,相关从业人员需做好个人防护,同时加强对周边环境消毒消杀等保护工作[13]。
3.6 分子分型比对研究评价 分型方法因素[6]:1) 分辨力(DI),定量区分两个不相关菌株为不同型的可能性;2) 分型力。即种属内细菌通过该方法得到分型的能力;3) 可重复性。指对菌株用该方法重复测试时能产生相同结果的能力;4) 电泳带型是否易于解释,成为评定一种分型方法实用性的一个因素;5)同时还应考虑该方法是否经济、快速、简便等。
PFGE和MLST方法对辽宁省YE分离株分型均是可行的,方法扩增均基本稳定,每次试验均能重复产生不同程度多态性DNA主条带。这2种分子分型方法均满足上述5种评价标准,分辨力:PFGE>MLST。PFGE较MLST方法分辨力稍高,相同ST型菌株在PFGE分型中可以进一步分型。分子分型研究结果与本项目组前期研究结果一致,与国内其他省研究结果相似[11]。
MLST方法需要对基因序列进行测序后分型,个别核苷酸序列的差异可能就会导致型别不同,ST型出现较多,新型间的比对需要时间互通。MLST是一种基于测定菌株的核苷酸序列来对菌株进行分子分型的新型技术,其主要是利用不同菌株都存在管家基因和其管家基因上存在足够的位点产生变异的等位基因的特点来对菌株进行研究,因此该方法不适用于变异程度低的菌株,缺少基因组中毒力岛的更加详细的信息。MLST实验中新技术要求严格,且现阶段测序及分析成本高。因此PFGE在现阶段的病原菌分型上,仍能够发挥优越的效能,PFGE具有公认的图谱判定标准、配套的储存分析软件,对于追踪与验证食源性疾病感染、食物中毒爆发流行的致病菌方面,仍是一种非常实用高效的分型工具[11]。
利益冲突:无
引用本文格式:李雪,孙婷婷,魏彤竹,等.2020-2023年辽宁省小肠结肠炎耶尔森菌表型分布和分子特征研究[J].中国人兽共患病学报,2024,40(2):97-103. DOI:10.3969/j.issn.1002-2694.2024.00.015
