基于Wnt/β-Catenin信号通路探讨吴门骨密葆方含药血清促进间充质干细胞成骨分化的效应机制
2024-03-15梁国强李宇卫沈晓峰尤君怡张国栋华永庆
梁国强,李宇卫,沈晓峰,尤君怡,张国栋,华永庆
(1.南京中医药大学附属苏州市中医医院中心实验室,江苏 苏州 215009;2.南京中医药大学附属苏州市中医医院骨伤科,江苏 苏州 215009;3.南京中医药大学附属苏州市中医医院康复科,江苏 苏州 215009;4.南京中医药大学药学院,南京 210023)
现代中医学把骨质疏松归为“骨痿”证的讨论范畴。依据其病位在骨而主要病机为“髓枯骨痿”,基于中医“肾主骨”的理论,骨病专家形成共识的“补肾壮骨”的治则[1]。中医学强调的“髓充则骨养”与骨髓间充质干细胞具有多向分化潜能有机相映[2]。目前,骨病研究者[3]认为,在调控骨髓间充质干细胞分化以及骨形成中起着积极的作用的Wnt/β-Catenin信号通路是骨质疏松治疗的重要潜在靶点之一。在团队前期研究表明,临床有效抗骨质疏松症的吴门骨密葆方抑制Wnt/β-连环蛋白(β-Catenin)信号通路[4],同时激活成骨细胞Runt相关转录因子2(Recombinant Runt Related Transcription Factor 2,RUNX2)mRNA,促进骨形成[5]。分泌型蛋白Dickkopf-1(DKK-1)被确认为Wnt/β-catenin信号通路的抑制剂,其与Wnt蛋白竞争性地直接与Wnt共受体LRP5/6结合,或者间接与其另外两类受体Kremen和LRP结合而形成三聚体,从而抑制Wnt蛋白活性[6]。本研究旨在探讨吴门骨密葆方治疗骨质疏松的分子生物学机制与Wnt/β-catenin信号通路的相关性。
1 材料和方法
1.1 实验动物和细胞
选用6周龄SPF级SD雄性大鼠25只,体质量280~300 g。制备正常血清及吴门骨密葆方含药血清,购于昭衍(苏州)新药研究中心有限公司,饲养于苏州大学医学实验动物中心SPF级实验室,许可证号分别为SCXK(苏)2018-0006和SYXK(苏)2021-0065。SD大鼠骨髓间充质干细胞由深圳市豪地华拓生物科技有限公司代购(进口货号:HTX2393),将此细胞置于37℃、体积分数5%的CO2培养箱内常规培养。每24 h更换液1次,待细胞长至近铺满细胞培养瓶底时,应用0.25%的胰酶消化,按1:3(接种浓度3×104·mL-1)传至第3代应用于实验。实验由苏州市中医医院动物伦理委员会批准(动物伦理批号:2022052),于2023年1月—2023年6月在南京中医药大学附属苏州市中医院中心实验室和苏州大学实验动物中心完成。
1.2 实验药物
吴门骨密葆方包括生黄芪20 g,补骨脂10 g,蛇床子10 g,何首乌15 g,肉苁蓉10 g,怀牛膝10 g,莪术10 g,海螵蛸30 g。药材购买于苏州市天灵中药饮片有限公司,由苏州市中医医院药学部供应。
1.3 实验试剂
α-MEM液体培养基、胎牛血清(GIBCO公司);胰蛋白酶-EDTA消化液(0.25%)、青链霉素混合液(100´)(Solarbio公司);间充质干细胞成骨诱导分化培养基(OBM:含10 mM β-甘油磷酸钠水合物和50 μg·mL-1抗坏血酸)、二甲基亚砜(DMSO)(Sigma公司);CCK-8细胞增殖及毒性检测试剂盒(SAB公司);碱性磷酸酶试剂盒(微板法,南京建成生物工程研究所);RIPA组织细胞快速裂解液(北京索莱宝公司);蛋白预染Marker(Fermentas公司);BCA蛋白定量试剂盒(Thermo公司);NC膜和化学发光检测试剂盒(Millipore公司);Wnt信号蛋白家族3alpha(Wnt3a)(货号:ab219412)、β-actin(货号:ab8226)抗体(Abcam公司);β-Catenin(货号:#8480)抗体(美国CST公司);糖原合成酶激酶3β(Glycogen synthase kinase 3β,GSK-3β)(货号:bs-0023R)、破骨细胞抑制因子[(osteoclastogenesis inhibitory factor,OCIF; 又称护骨素(osteoprotegerin,OPG)](货号:bs-20625R)和核因子κB受体活化因子配体(receptor activator of NF-κB ligand,RANKL)(货号:bs-20647R)抗体(Bioss公司);羊抗兔HRP(货号:A0208)二抗(碧云天公司)。其他试剂均为市售分析纯。
1.4 实验仪器
TDZ4-WS离心机(上海卢湘仪离心机仪器有限公司);DNM-9602酶标仪(北京普朗新技术有限公司);Forma 3111 CO2恒温培养箱(Thermo公司);CX41正置显微镜(OLYMPUS公司);Mini protean 3 cell电泳仪(BIO-RAD公司);DHG-9023A恒温烘箱(上海恒一科学仪器有限公司);TE77XP电转仪(HOEFER公司)。
1.5 吴门骨密葆方含药血清制备
选取25只大鼠随机分为正常组(n= 5)和吴门骨密葆方低、高剂量组(n= 10),空白组以灌胃生理盐水(10 mL·kg-1);参考文献将吴门骨密葆方低、高剂量组分别给予低剂量(根据人与动物体表面积换算为:10 g生药/kg)、高剂量(换算为人正常服用剂量2倍:20 g生药/kg)吴门骨密葆方汤剂灌胃7 d[7]。最后灌胃给药后1 h进行麻醉,采用腹主动脉抽血抽取各组大鼠血液,离心(3 000 r·min-1、30 min)后取上层血清,进行灭活(56℃、30 min)后,采用0.22 μm滤膜对同组混匀血清过滤灭菌,于-20℃冰箱保存以备实验应用。
1.6 实验细胞分组
取3代培养的大鼠骨髓间充质干细胞,按参考文献[8]随机分为7组。1)A组:正常血清组(基础培养基+10%正常大鼠血清);2)B组:经典诱导组(OBM+10%正常大鼠血清);3)C组:吴门骨密葆方低计量组(基础培养基+10%对应血清);4)D组:吴门骨密葆方高剂量组(基础培养基+10%对应血清);5)E组:DKK-1抑制剂组(基础培养基+10%正常大鼠血清+0.1 ng·mL-1DKK-1);6)F组:吴门骨密葆方低剂量+抑制剂组(基础培养基+10%对应血清+0.1 ng·mL-1DKK-1);7)G组:吴门骨密葆方高剂量+抑制剂组(基础培养基+10%对应血清+0.1 ng·mL-1DKK-1)。干预7 d,每3 d更换对应液1次,其中DKK-1抑制剂于第3 d加入干预。
1.7 CCK-8法检测细胞增殖活性
取3代大鼠骨髓间充质干细胞,以每毫升5×103个的密度接种于含10%FBS、1.0%青霉素和链霉素的α-MEM培养基中。将细胞置于37℃、5% CO2培养箱中培养。当细胞达到80%融合时,按以上分组有机干预,换用100 μL含10%体积的各组血清的相应培养液(n= 5),培养7 d后,加入10 μL CCK-8溶液,在培养箱内孵育1 h,设定450 nm波长,采用酶标仪测定吸光度值。
1.8 ALP染色及ALP活性检测
将3代骨髓间充质干细胞以5×105个/孔接种于6孔板,按以上分组进行成骨诱导分化,每3 d换液体1次,诱导7 d后,细胞采用ALP染色试剂盒进行染色,倒置显微镜下观察拍照分析。各组细胞培养液离心(1 500 r·min-1,10 min)收集上清液,严格根据试剂盒说明书,每空分别加入基质液和缓冲液各50 μL和样品30 μL,充分混匀、孵育(37℃,15 min)后加入150 μL显色剂、振摇混匀,设定450 nm波长,采用酶标仪同步检测检测实验孔和空白(双蒸水)孔、标准孔的吸光度值,得到各组ALP活性原始实验数据后进行统计分析。
1.9 Western blot 检测各组细胞中相关蛋白表达
取3代骨髓间充质干细胞,以5×105个/孔接种于6孔板,按以上分组进行成骨诱导分化,每3 d换液体1次,诱导7 d,Wnt3α、β-Catenin、GSK3β、OPG、RANKL蛋白表达差异采用Western blot检测。收集在含PMSF的RIPA裂解液中目标总蛋白,以BCA法确定蛋白浓度。取30 mg蛋白进行SDSPAGE电泳、转膜、封闭;一抗[Wnt3α(1:1 000)、β-Catenin(1:1 000)、GSK3β(1:500)、OPG(1:1 000)、RANKL(1:500)、β-actin(1:1 500)]孵育过夜,加HRP二抗(1:2 000)孵育60 min,进行化学发光检测和凝胶成像系统扫描,应用Image软件对结果图像进行分析,蛋白相对表达量=目标蛋白灰度值/内参β-actin灰度值。
1.10 统计学方法
所得实验数据,应用 Graphpad prism 8 软件进行统计学分析。计量资料采用均数±标准差(±s)表示,符合正态分布的情况下的数据,采用单因素方差分析进行组间比较;对于不符合正态分布数据,进行非参数检验分析,以P<0.05为差异有统计学意义。
2 结果
2.1 吴门骨密葆方含药血清对间充质干细胞增殖的影响
见表1。
表1 吴门骨密葆方含药血清对间充质干细胞增殖的影响(±s,n= 5)
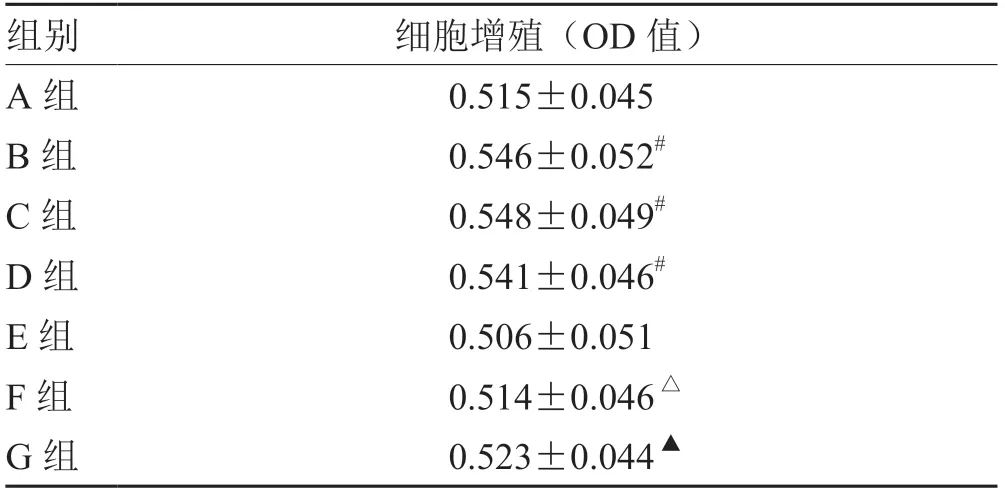
表1 吴门骨密葆方含药血清对间充质干细胞增殖的影响(±s,n= 5)
注:与A组比较,# P<0.05;与C组比较,△P<0.05;与D组比较,▲P<0.05
组别细胞增殖(OD值)A组0.515±0.045 B组0.546±0.052#C组0.548±0.049#D组0.541±0.046#E组0.506±0.051 F组0.514±0.046△G组0.523±0.044▲
2.2 吴门骨密葆方含药血清对骨髓间充质干细胞碱性磷酸酶染色及活性的影响
ALP染色结果显示:经典诱导组与各剂量吴门骨密葆方含药血清干预7 d后,与正常血清组相比,各组ALP染色程度增强,且酶活力以剂量依赖式增强。与抑制剂组比较,加入DKK-1的各含药血清组ALP染色程度均增强,与同剂量吴门骨密葆方含药血清组比较,加入DKK-1的各含药血清组ALP染色程度均减弱。见图1,见表2。
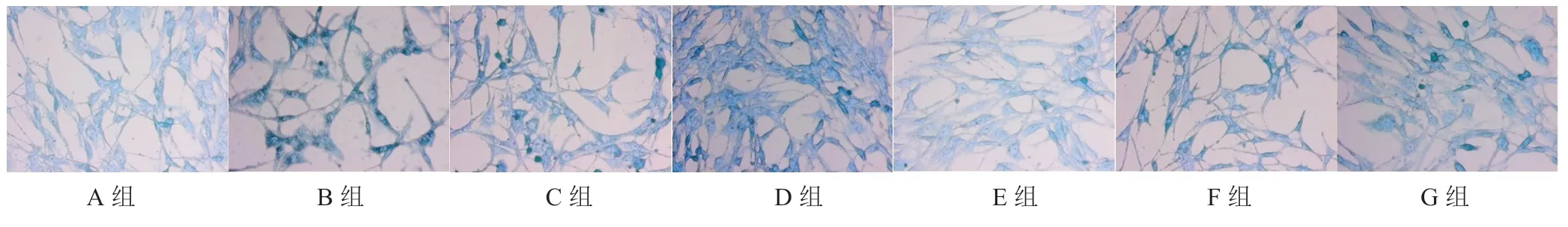
图1 吴门骨密葆方含药血清对骨髓间充质干细胞ALP染色的影响(×400)
表2 吴门骨密葆方含药血清对骨髓间充质干细胞ALP活性的影响(±s,n= 5)

表2 吴门骨密葆方含药血清对骨髓间充质干细胞ALP活性的影响(±s,n= 5)
注:与A组比较,# P<0.05;与B组比较,△P<0.05;与C组比较,▲P<0.05;与D组比较,□P<0.05;与E组比较,■P<0.05
组别ALP活性(金氏单位/gprot)A组1.421±0.136 B组2.704±0.175#C组1.971±0.112#△D组2.089±0.173△E组1.411±0.121 F组1.468±0.110▲G组1.515±0.176#□■
2.3 吴门骨密葆方含药血清对骨髓间充质干细胞Wnt/β-Catenin信号通路相关蛋白表达的影响
见图2、图3。
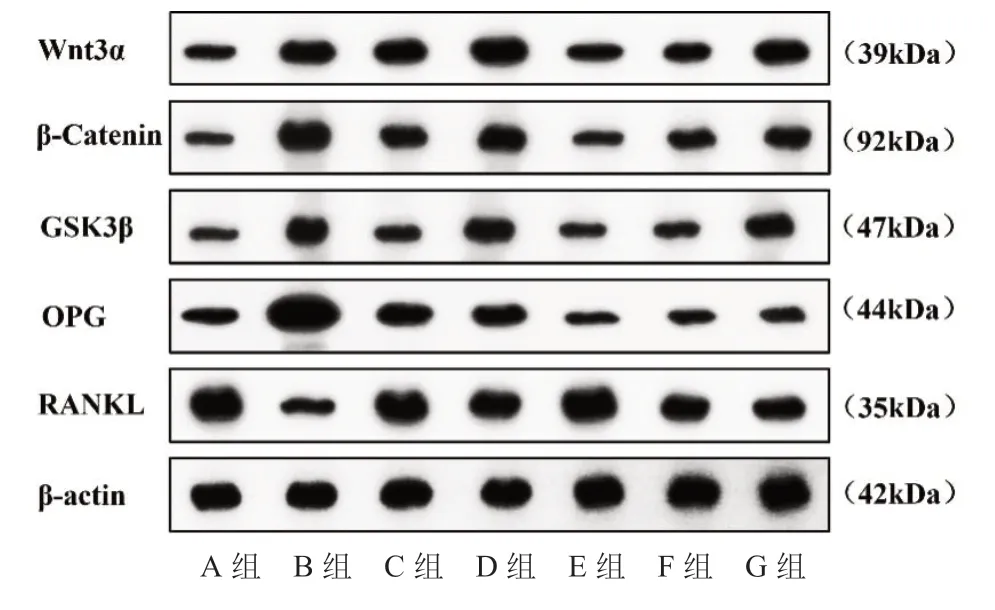
图2 各组Wnt3α、β-Catenin、GSK3β、OPG和RANKL蛋白条带图

图3 各组Wnt3α、β-Catenin、GSK3β、OPG和RANKL蛋白相对表达量(±s,n= 5)
3 讨论
补肾中药具有调节机体内激素水平和提高机体免疫功能,以及刺激骨髓间充质干细胞增殖、促进成骨分化和成熟的功效,已被充分的现代中药药理学研究[9]证明。本研究的CCK-8结果显示,吴门骨密葆方含药血清具有明显的促进骨髓间充质干细胞增殖的能力;同时ALP染色强度和活性检测结果提示,吴门骨密葆方含药血清能够有效促进骨髓间充质干细胞成骨分化。
在本研究Western blot 检测结果中发现,Wnt/β-catenin以及OPG/RANKL信号通路可能在吴门骨密葆方含药血清促进骨髓间充质干细胞成骨分化中发挥了重要调控作用。DKK-1作为Wnt/β-catenin信号通路的抑制剂,其可有效抑制骨髓间充质干细胞向成骨分化,并抑制成骨细胞分泌OPG,导致OPG水平降低,提高RANKL水平,使RANKL/OPG比例增加,促进破骨细胞分化[10]。本研究在吴门骨密葆方含药血清中加入DKK-1干预后,结果显示,吴门骨密葆方含药血清增殖及成骨分化能力被明显抑制。从而又进一步验证了吴门骨密葆方含药血清在促进骨髓间充质干细胞增殖及成骨分化中Wnt/β-catenin、OPG/RANKL信号通路发挥重要调控作用。
