二甲双胍调节AMPK/TGF-β1信号通路对百草枯中毒大鼠肺纤维化的保护作用
2024-03-15吴潦章杨瑾王净岑遗芳华维骆付丽潘万福
吴潦章 杨瑾 王净 岑遗芳 华维 骆付丽 潘万福
(遵义医科大学附属医院急诊科,贵州 遵义 563003)
百草枯(Paraquat,PQ)是一种在全球农业生产中应用比较广泛的非选择性触杀型除草剂[1],对人类和其他哺乳动物具有剧毒。由于PQ缺乏特效解毒药,中毒后病死率可达50%~70%[2]。肺纤维化是PQ中毒后期最主要的并发症及死亡原因。腺苷酸活化蛋白激酶(AMP-activated protein kinase,AMPK)是一种在真核生物中具有能量调节作用的丝氨酸/苏氨酸蛋白激酶[3]。除了能量调节,AMPK还有抗氧化应激[4]和减轻纤维化形成的作用[5]。有研究[6]报道,降糖药物二甲双胍(Metformin,MET)可以通过抑制电子传递链复合物Ⅰ减少细胞内能量来激活AMPK。本课题组在前期实验研究也发现二甲双胍可激活AMPK信号通路,明显减轻PQ中毒大鼠肺组织炎症反应及急性肺损伤[7]。但对于二甲双胍是否在PQ所致肺纤维化中也起同样的保护作用以及通过哪条信号通路发挥的作用,尚不清楚。本研究旨在探讨MET通过激活AMPK信号通路对急性PQ中毒致大鼠肺纤维化的保护作用。
1 材料与方法
1.1 实验动物成年SPF级雄性SD大鼠30只,体重(200±20)g,购自长沙市天勤生物技术有限公司,实验动物许可证号:SCZK(黔)2021-0002。饲养于遵义医科大学实验动物中心[20~25℃,(50±5)%相对湿度,12 h昼夜循环光照],给与标准食水喂养,开始实验前至少饲养1周。所有实验动物在饲养及实验过程中均符合遵义医科大学动物伦理要求。
1.2 主要材料20%百草枯溶液(南京红太阳生物化学有限责任公司);盐酸二甲双胍(美国Sigma-Aldrich公司);复合物C、AICAR(上海阿拉丁生化科技股份有限公司);SOD、MDA和GSH-px试剂盒(南京建成生物工程研究所);Masson染色试剂盒、Hyp检测试剂盒、BCA蛋白浓度测定试剂盒(北京索莱宝科技有限公司);兔抗鼠p-AMPK-α1抗体、兔抗鼠 TGF-β1抗体、兔抗鼠 E-cadherin抗体、兔抗鼠α-SMA 抗体、兔抗鼠β-actin抗体(北京博奥森生物技术有限公司);化学发光荧光成像系统(美国Bio-Rad公司);全自动多功能酶标仪(美国Thermo Fisher Scientific公司)。
1.3 动物分组按随机数字表法将30只大鼠随机分为五组:对照组(Control组,n=6)、PQ中毒组(PQ组,n=6),二甲双胍干预组(PQ+MET组,n=6),腺苷类似物组(PQ+AICAR组,n=6)和复合物C组(PQ+MET+CC组,n=6)。
1.4 模型建立将20%百草枯溶液加0.9%生理盐水稀释为2%的溶液(浓度20 mg/mL),避光保存。按30 mg/kg 抽取2%的百草枯溶液并用0.9%生理盐水稀释为1 mL一次性腹腔注射,制备PQ中毒的实验模型。MET干预组从染毒后2 h开始,给予400 mg/kg MET灌胃,1次/天,共21 d。腺苷类似物组每日灌入AICAR 200 mg/kg。AMPK抑制剂组予以MET 400 mg/kg灌胃并腹腔注射复合物CC 20 mg/kg。PQ组每日灌入等量0.9%生理盐水。Control组用等量0.9%生理盐水一次性腹腔内注射,并每日灌入等量0.9%生理盐水。各组大鼠均在21 d时处死,并收集肺组织标本。
1.5 大鼠肺组织匀浆中氧化指标和Hyp的检测大鼠予1%戊巴比妥钠(10 mL/kg)腹腔注射麻醉充分后,仰面固定于恒温手术台上,采用断颈法处死大鼠,收集肺组织标本。按照超氧化物歧化酶(Superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(Glutathione peroxidase,GSH-px)、丙二醛(Malondialdehyde,MDA)和羟脯氨酸(Hydroxyproline,Hyp)试剂盒说明书,分别采用黄嘌呤氧化酶法测定SOD 的活力、硫代巴比妥酸法检测MDA 的含量和化学法测定GSH-px和Hyp水平。
1.6 肺组织病理学检查取大鼠右下叶肺组织,用4%多聚甲醛固定72 h,石蜡包埋、切片,脱蜡后,切片用Masson染色,在光学显微镜下观察各组肺组织病理学变化。
1.7 肺组织透射电镜检查大鼠麻醉后,立即开胸,充分暴露双肺,快速剪取左肺下叶一小块肺组织,固定于2.5%戊二醛中,并修剪成1 mm3大小,4 ℃固定4 h以上,加入1%锇酸后固定1.5 h,用不同浓度乙醇和丙酮梯度脱水,浸透、包埋、修块、切片和染色,置于透射电镜下观察组织结构变化。
1.8 Western-blotting分析大鼠肺组织加人适量RIPA裂解后,12 000 r/min、4 ℃离心10 min,取上清液,用BCA法测定蛋白浓度,加人1/4(v/v)的loading Buffer,100℃ 5 min变性蛋白。每条泳道中加人20 μg总蛋白的蛋白样品,进行SDS-PAGE电泳。电泳完成后,在300 mA,70 min条件下转膜至PVDF微孔膜,用5%脱脂奶粉或3%BSA的TBST封闭液常温封闭2 h,然后加入相应的一抗封闭液稀释的抗体,4 ℃过夜孵育,用TBST洗涤膜15 min,共3次。二抗常温振荡孵育2 h,用TBST洗涤膜15 min,共3次。将发光液A、B混合液均匀滴到膜上,置于Bio-rad凝胶成像系统成像,Western-blotting结果经Image J软件进行灰度扫描分析。

2 结 果
2.1 PQ中毒大鼠行为学变化PQ组大鼠在给药72 h后出现毛发松散不光泽、呼吸急促,活动、进食减少;对照组大鼠一般状况良好,未出现上述症状;MET干预组毛发松散程度、呼吸、活动、进食较PQ组有所好转。
2.2 Hyp含量经Hyp试剂盒检测,与对照组比较,PQ组大鼠肺组织中Hyp明显增加(P<0.05);与PQ组比较,PQ+MET组与PQ+AICAR组肺组织中Hyp含量明显减少(均P<0.05),与PQ+MET组比较,PQ+MET+CC组大鼠肺组织中Hyp含量明显升高(P<0.05)。见表1。
表1 各组大鼠肺组织中羟脯氨酸含量变化
2.3 SOD、MDA和GSH-px水平变化与对照组相比,PQ组大鼠肺组织匀浆中MDA含量明显升高(P<0.05),而SOD和GSH-px明显降低(P<0.05);与PQ组比较,PQ+MET组与PQ+AICAR组大鼠肺组织匀浆中MDA含量明显降低(P<0.05),而SOD和GSH-px均明显高于PQ组(均P<0.05),但两干预组间差异无统计学意义(P>0.05);与PQ+MET组相比,PQ+MET+CC组大鼠肺组织匀浆中的MDA明显升高(P<0.05),而SOD和GSH-px明显降低(P<0.05)。见表2。
表2 各组大鼠肺组织匀浆中MDA、SOD和GSH-px的变化
2.4 肺组织病理学观察Masson染色的组织切片显示,对照组大鼠肺组织结构清晰,肺泡壁未见增厚,未见蓝染胶原纤维沉积;PQ组大鼠肺组织呈明显的纤维化改变,肺泡壁增厚,支气管周围及肺泡间隔的胶原纤维增多(蓝色部分),部分肺泡结构破坏,成纤维细胞增生、肥大;与PQ组相比,PQ+MET组与PQ+AICAR组,见大鼠肺泡结构完整、未见大量蓝染胶原纤维沉积,肺组织纤维化显著减轻;但是,PQ+MET+CC组大鼠肺组织仍出现了严重的结构破坏及明显的纤维化改变(见图1)。在透射电镜下,对照组大鼠肺组织结构清晰,未见胶原纤维形成;PQ组大鼠肺泡壁、肺泡腔挤压变形,支气管周围及肺泡间隔的胶原纤维增多,基质增厚,肺泡结构破坏;同时间PQ+MET组与PQ+AICAR组上述表现明显减轻;但PQ+MET+CC组仍出现了肺泡结构破坏及纤维化改变(见图2)。
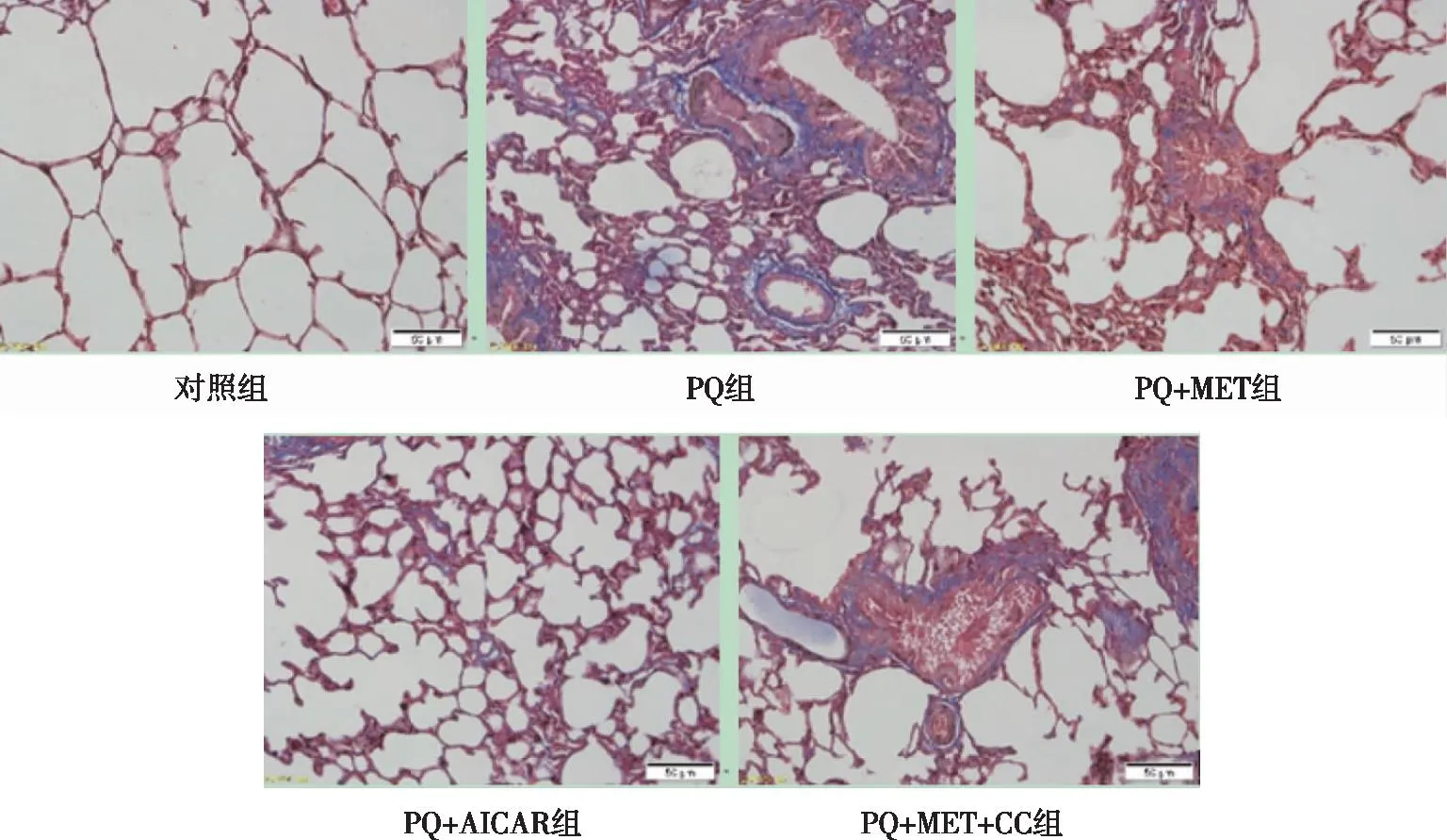
图1 各组大鼠肺组织病理变化(Masson×200)
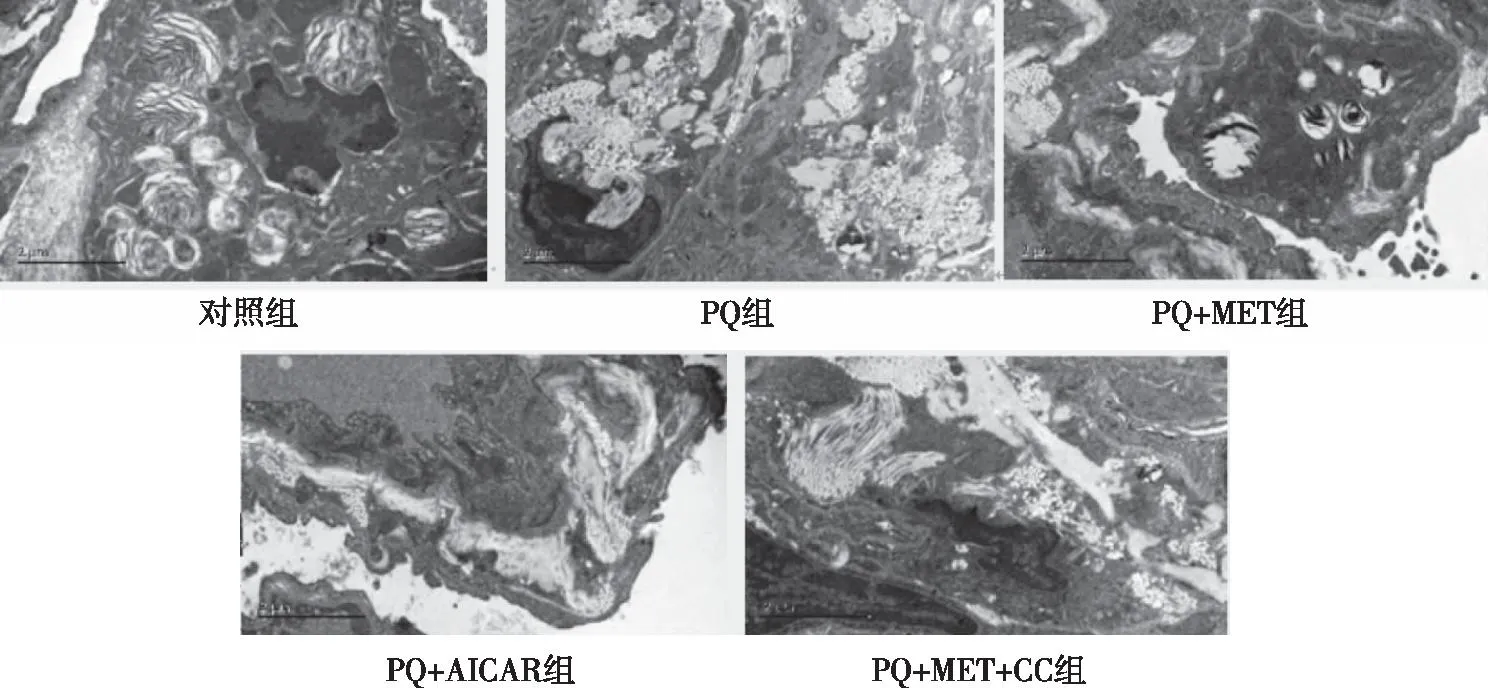
图2 各组大鼠肺组织病理变化(透射电镜×20000)
2.5 大鼠肺组织中蛋白表达情况与对照组相比,PQ组大鼠肺组织中的α-SMA蛋白含量更高,E-cadherin蛋白含量更低;与PQ组相比,PQ+MET组与PQ+AICAR组E-cadherin蛋白表达增加,α-SMA蛋白表达减少;与PQ+MET组相比,PQ+MET+CC组肺组织中的E-cadherin 蛋白表达量减少、α-SMA 蛋白表达量升高;以上差异均具有统计学意义(P<0.05);与对照组相比,PQ 组大鼠肺组织中的 TGF-β1蛋白表达增加;与PQ组相比,PQ+MET组与PQ+AICAR组大鼠肺组织中的Phospho-AMPK蛋白表达量明显增加,而TGF-β1蛋白表达量明显减少;与PQ+MET组相比,PQ+MET+CC组肺组织中的Phospho-AMPK蛋白水平表达减少,而TGF-β1蛋白表达量增加;各组差异具有统计学意义(P<0.05)。见图3。

注:与Control组比较,*P<0.05;与PQ组比较,#P<0.05;与PQ+MET组比较,&P<0.05。图3 各组大鼠肺组织中蛋白表达变化
3 讨 论
肺纤维化是百草枯中毒后最主要的死亡原因,目前虽然有许多关于百草枯中毒引起肺纤维化的研究报道,但其具体的发病机制尚未完全阐明,缺乏有效的治疗方法。近年来的研究表明肺纤维化的病理特征包括大量的肌成纤维细胞堆积和肺泡内的细胞外基质沉积[8]。成纤维细胞中的α-平滑肌肌动蛋白促进其在纤维化病灶中产生过量的胶原蛋白[9],过量的胶原蛋白将导致细胞外基质过度沉积,这是造成肺纤维化的主要原因。羟脯氨酸是胶原蛋白所特有的一种氨基酸,可反应肺组织纤维化的严重程度。本实验通过建立PQ中毒大鼠肺纤维化模型,证实了PQ染毒大鼠肺组织Masson染色可见肺泡壁增厚,支气管周围及肺泡间隔的胶原纤维增多,透射电镜下可见大鼠肺泡壁、肺泡腔挤压变形、基质增厚及胶原纤维增多,肺组织匀浆中Hyp的含量明显升高,这与前人研究相一致。而经过MET干预后,上述情况均有所改善。
MET作为治疗2型糖尿病的一线降糖药,除了发挥降糖作用,还能激活AMPK发挥抗纤维化[10]和减少氧化应激[11]。在博来霉素诱导的小鼠肺纤维化模型上,二甲双胍通过上调AMPK通路治疗性地加速肺纤维病灶的溶解。AMPK通路下调,可加速病理性纤维化的形成过程,而二甲双胍则通过上调AMPK通路逆转了肺纤维化过程[12]。我们为了探讨MET在PQ诱导肺纤维化中的作用,复制了国内外常见的PQ诱导的大鼠肺纤维化模型[13],并在前期研究基础上,选定MET400 mg/kg作为实验干预剂量[7],以观察MET在PQ诱导的肺纤维化中可能发挥的作用。实验证实MET能明显改善PQ引起的肺纤维化,减轻氧化应激。与PQ组大鼠比较,PQ+MET组肺组织匀浆中Hyp含量明显降低,Masson染色及透射电镜下肺组织病理改变减轻,肺组织匀浆中氧化产物MDA含量也相应降低。同时,经过MET处理后,可以提高大鼠肺组织匀浆中抗氧化物SOD和GSH-px的表达。我们都知道,PQ诱导的氧化应激中,主要表现为氧化产物MDA含量增加,和抗氧化物SOD、CAT和GSH-px水平降低,这已经在许多实验中被证实[14]。这些实验结果说明MET在PQ诱导的肺纤维化中可以减轻肺组织的过氧化损伤及纤维化程度。
上皮—间质转化是 PQ 导致的肺纤维的一个重要病理改变过程,其中转化生长因子-β1(Transforming growth factor-1, TGF-β1)在上皮—间质转化过程中起着核心作用[15]。TGF-β1是纤维化的主要内源性调节因子,其表达在肺纤维化病变中普遍升高[16]。抑制 TGF-β1 相关信号转导通路的活化可以改善上皮-间质转化过程及肺纤维化的程度。在百草枯诱导肺纤维化模型中,TGF-β1 mRNA的表达逐渐增加,在第7天达到峰值。TGF-β1的增加先于Ⅰ型胶原和α-SMA mRNA表达的增加,这是纤维化的一个指标[17]。促纤维化蛋白TGF-β1和α-SMA的显著升高促进了肺泡塌陷和肺组织胶原沉积[18]。在本次研究中,我们检测了肺组织中的TGF-β1、E-cadherin和α-SMA蛋白的表达作为纤维化进展和上皮-间充质转化的标志物。研究表明,PQ可导致大鼠肺组织中TGF-β1和α-SMA 蛋白水平增高,及E-cadherin蛋白水平的降低。而MET和AMPK激活剂 AICAR 均在一定程度上减轻了PQ诱导的这一改变。同时,在加入AMPK抑制剂复合物C以后,这一作用受到抑制。也就是说二甲双胍干预显著抑制了TGF-β1诱导的肌成纤维细胞分化和上皮-间充质的转化,这一过程是通过激活AMPK介导的。有报道[19]称,二甲双胍可通过介导AMPK抑制TGF-β1/Smads信号通路改善慢性结肠炎相关肠纤维化。同时,S.Thakur等[20]研究表明,二甲双胍激活AMPK可降低TGF-β1诱导的α-SMA和纤连蛋白表达。这与我们的实验结果相一致。
综上所述,二甲双胍可以减轻PQ中毒大鼠肺纤维化,其机制与激活AMPK信号通路,下调TGF-β1来改善上皮-间质转化有关,而这一效应可以被AMPK抑制剂CC所抑制。
利益冲突说明/Conflict of Intetests
所有作者声明不存在利益冲突。
伦理批准及知情同意/Ethics Approval and Patient Consent
本研究通过遵义医科大学附属医院伦理委员会批准,为动物实验故知情同意免除。
贡献度说明
吴潦章负责实验设计、撰写论文,杨瑾、王净、华维、骆付丽、潘万福进行实验实施,岑遗芳进行数据整理。
