氧载体NiFe2O4与褐煤的化学链燃烧反应特性实验研究
2024-03-13杨慰珺
刘 勇,杨慰珺
(江苏省盐城技师学院,江苏盐城 224000)
0 引言
由于其独特的CO2内分离特性,化学链燃烧技术是实现低成本捕集CO2的新型高效技术[1]。此外,与传统燃烧模型相比,它还可以通过降低燃烧温度降低氮氧化物排放[2],并提高能源利用效率[3]。
在化学链燃烧技术体系中,氧载体传递氧气和热量以保持优异的化学链燃烧反应性能发挥着关键作用。因此,开发高效、具备良好的机械强度、低成本和环保的氧载体对于实现化学链燃烧的工业应用至关重要。目前为止,一些过渡金属氧化物(Ni,Cu,Cd,Mn,Fe 和Co 的氧化物)已引起研究人员的高度关注。固体燃料用于化学链燃烧反应已成为富含固体燃料资源的研究热点[4],其可行性也已得到大量实验的证实。
迄今为止,由于Fe2O3具有低成本,高机械强度和热稳定性以及环保等优点而成为常用的氧载体[5]。但是与NiO,CuO 等相比,氧化铁具有较低的氧化还原反应活性。为了提高其反应活性,将氧化铁与其他组分(Co,Ni,Cu 等)复合是一种有效的方法,许多研究证实CuFe2O4,BaFe2O4,CoFe2O4等的性能得到增强[6]。NiO 是一种具有良好反应活性的氧化物,而高成本和毒性限制了其大规模应用[7]。因此,我们提出合成镍-铁复合载氧体,并通过热重分析实验研究其与褐煤的氧化还原性能和稳定性,其结构通过扫描电子显微镜(SEM),X 射线衍射(XRD),和Brunauer-Emmett-Teller(BET)表征。为了比较,还研究了Fe2O3和NiO 与褐煤的反应特性。本研究可对NiFe2O4的性能,以及其与褐煤的反应机理有初步的了解,为NiFe2O4在以褐煤为燃料的化学链燃烧反应中大规模应用作准备。
1 实验部分
1.1 原料和载氧体制备
本实验采用水热合成法制备载氧体NiFe2O4,具体步骤如下:
首先,称取一定量的Ni(NO3)2·6H2O 和Fe(NO3)3·9H2O(摩尔比为2:1)溶解于去离子水中,然后缓慢滴加NaOH 水溶液直至溶液的pH9,过滤得到沉淀,并用去离子水洗涤几次。随后,将所得产物放入高压反应釜中,加入适量去离子水和DTAB,然后200 ℃下保温4 h。冷却至室温后,过滤并干燥,得到粉末状NiFe2O4。最后,收集粒径为0.1mm ~0.2mm 的载氧体颗粒用于热重分析实验和表征。为了比较,使用同样的方法制得载氧体Fe2O3和NiO。对褐煤做了组分和元素分析实验,结果如表1。

表1 褐煤的组分和元素分析
1.2 热重分析及表征方法
首先,将合成的载氧体与褐煤按质量比为27:1 混合,然后称取20 mg 样品于实时热重分析仪(SAT6000,Perkin)的陶瓷盘内。调节载气(N2)流量至40 mL/min,从环境温度加热至120 ℃后以40 ℃/min 的升温速率加热10 min 以消除水分。然后进一步加热至850 ℃,保持20 min 以确保充分反应。在相同条件下分别进行煤和参照的载氧体Fe2O3和NiO 的化学链燃烧反应,以进行比较。载氧体的转化率(X)按下式计算:
其中m表示样品的实际质量,mOX表示样品完全氧化后的质量,mred表示样品完全还原后的质量。
利用SEM、XRD、BET 等方法对热重分析反应的新OCs 和固体产物的表面结构特性进行了表征。图1 是新制备的载氧体(NiFe2O4,NiO,Fe2O3)的XRD谱,结果表明,我们成功合成了只含镍铁尖晶石结构的镍铁复合载氧体。
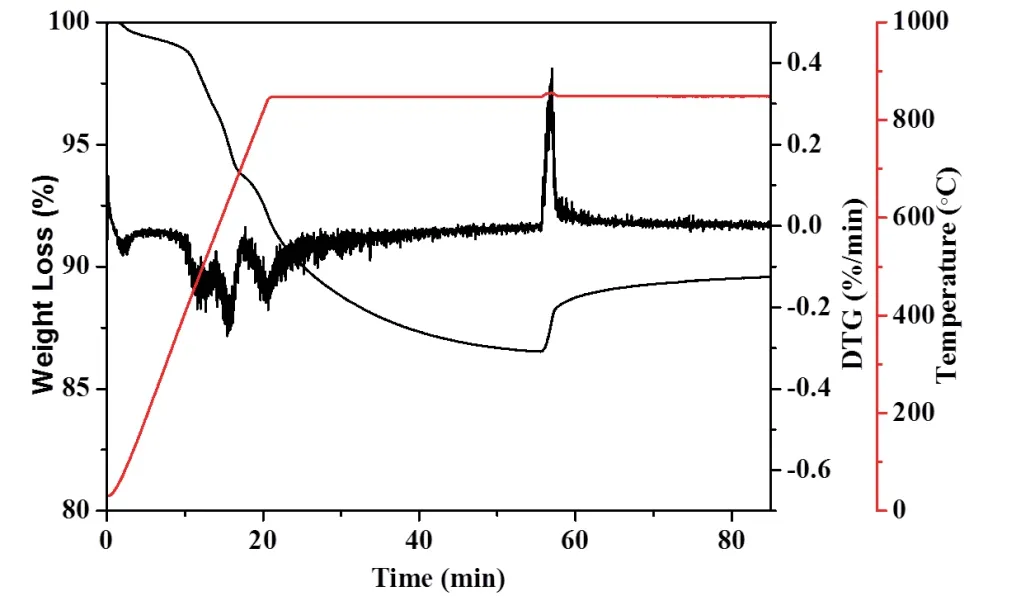
图1 新制备的载氧体NiFe2O4的XRD谱图
2 结果与讨论
2.1 载氧体的反应活性
通过热重分析实验研究了合成的载氧体(NiFe2O4,Fe2O3和NiO)在化学链燃烧反应中的性能,TG 和DTG 曲线的结果如图2所示。由图2可知,褐煤与NiO 反应的净质量损失为26.30%,比褐煤与Fe2O3反应时2.73%的净质量损失高得多,表明NiO在褐煤化学链燃烧过程中的反应活性优于Fe2O3。然而,褐煤与NiFe2O4反应的重量损失为14.37%,比Fe2O3高得多,比NiO 低得多,表明载氧体Fe2O3复合Ni 组分后反应活性得到了有效增强。值得注意的是,在载氧体NiO 的TGA 曲线中出现了轻微的增重,这可能是由于NiO 表面的严重碳沉积造成的[8]。

图2 NiFe2O4,Fe2O3和NiO与褐煤的CLC实验
在DTG 曲线中可知这三个样品的具体重量损失率,结果表明,在褐煤与NiO 的化学链燃烧过程中可以观察到两个不同的特征温度,分别为457 ℃和821 ℃,反应速率分别为3.6 Wt%/min 和6.5 Wt%/min。虽然在723 ℃下加入Fe2O3后,只有一个特征峰出现,其重量损失速率很小,为0.6 Wt%/min,远远低于NiO,对应于TG 曲线中和先前实验中轻微的重量损失[6]。尽管如此,在加入NiFe2O4后会出现三个反应阶段,反应速率分别为1 Wt %/min,1.8 Wt%/min 和0.8 Wt%/min,温度分别为477 °C,619 °C 和803 °C。此外,计算载氧体的转化率并示于图3中。结果表明反应从432 °C 开始,NiFe2O4,Fe2O3和NiO 的最终转化率分别为50.42%,8.99%和107.11%,表明与Fe2O3相比,更多晶格氧转移到了NiFe2O4的燃料中。

图3 载氧体NiFe2O4,Fe2O3和NiO的转化率
因此,将NiO 复合至Fe2O3可以提高其反应活性和氧传递能力。基于Matisson 提出的化学链燃烧系统设计定理[9],如果采用NiFe2O4代替Fe2O3作为载氧体,在燃料反应器和空气反应器之间可实现更少的载氧体使用量和更低的载氧体传输流量。
为了进一步研究NiFe2O4的氧化性能,在与褐煤反应后,还原的氧载体被热重分析仪中的空气再氧化,结果如图4所示。由图可知还原态的氧载体的氧化反应比还原反应快得多,而再生的氧载体的重量仅为初始质量的90%左右,表明还原的氧载体不能被完全再氧化。这可能是因为煤灰覆盖了氧载体表面,抑制了再生过程。显然,化学链反应长时间运行后,煤灰将积聚并进一步影响氧载体的流化和反应活性。在化学链反应中将固体燃料煤灰与氧载体分离是一个巨大的挑战,这需要全世界的研究人员继续探索。
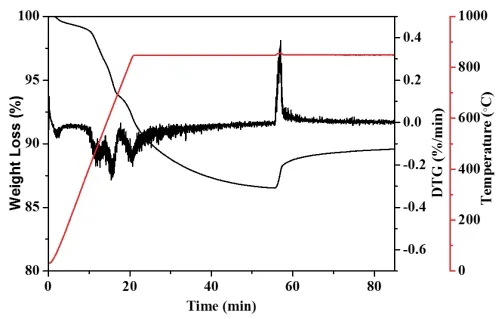
图4 载氧体NiFe2O4与褐煤的氧化还原循环实验
2.2 扫描电镜分析
为进一步检测氧载体的微观形貌变化,图5(a~f)是氧载体与褐煤的化学链燃烧反应中新鲜的和还原态的氧载体的扫描电镜照片。在图5b 中还原的NiO表面上发生了轻微的团聚现象,这与报道的结果相一致[10],而NiFe2O4和Fe2O3的新鲜的和还原的状态没有明显差异(图5c~f)。这些结果与表2中列出的BET 值完全一致,其中NiO 的比表面积和孔体积发生显著降低,而还原的NiFe2O4显示出与新鲜状态下相当的BET 值。至于Fe2O3,表面活化发生时其比表面积和孔体积略微增加,这可归因于其优异的热稳定性。此外,Fe2O3中的组分Ni 可以显著增加其比表面积和孔容积值,这将大大降低煤热解产物扩散到氧载体内部的阻力并促进化学链燃烧反应。

图5 新鲜的和还原的载氧体的SEM图,

表2 新鲜的和还原的载氧体的比表面积(S)和孔体积(V)
2.3 循环使用分析
虽然TGA 实验和表征结果证实了NiFe2O4的良好性能,但载氧体的反应活性的稳定性仍然是其实际应用的关键。为了消除煤灰对其反应活性的不利影响,我们选择氧载体作为探针分子进行了10次氧化还原循环实验,以进一步阐明NiFe2O4在TGA 中的反应活性稳定性。将反应温度保持在850 °C,然后依次进入CO(氮气体积分数为30%,平衡气体),N2和空气。图6是循环实验的结果,在前两个氧化还原循环过程中,发生NiFe2O4的活化现象,然后其反应活性开始稳定。再生后,氧载体的最终重量接近100%。比较第三次和最后一次循环,重量损失曲线可以重复,这表明合成的NiFe2O4具有很高的反应活性稳定性。

图6 载氧体NiFe2O4氧化还原循环10实验
3 总结
NiFe2O4是通过SEM,BET 和XRD 方法制备和表征的。通过TGA 实验研究了NiFe2O4与褐煤的氧化还原性能。结果表明,在Fe2O3上复合Ni 组分可以优化表面结构,增加比表面积和孔体积,提高褐煤化学链燃烧反应中氧载体的反应活性和氧传递能力。另外,循环实验进一步证实了NiFe2O4高反应活性的稳定性。我们的研究结果表明NiFe2O4在褐煤的化学链燃烧反应是有效的和适用的。
