基于铜、锰基的CaSO4复合载氧体反应活性改善的实验研究
2022-08-17李慧君王业库张鹏飞
李慧君, 王业库, 李 东, 张鹏飞
(1.华北电力大学 能源动力与机械工程学院,河北 保定 071003;2.烟台华能发电有限公司,山东 烟台 264000)
0 引 言
化学链燃烧(Chemical Looping Combustion)技术,两步反应代替直接燃烧反应,实现能量梯级利用[1];燃料不与空气直接接触,能够在耗能较小的情况下实现CO2的高效捕集[2];燃料反应器和空气反应器的操作温度低于热力型氮氧化合物生成温度[3],抑制NOx生成。
载氧体的选取是CLC系统运行的关键问题之一。而在CLC[4]系统中,载氧体需满足氧转移容量充足、反应性好、机械完整性高、耐烧结性好、成本低、环境友好等标准。金属载氧体具有相对较高的反应活性,但各自都存在一些问题,如:Ni[5,6]基有一定的毒性,不仅反应过程中易积碳,而且价格较高;Fe[7,8]、Cu[9,10]基反应活性不高,成本较高且易烧结;Mn[11,12]基在循环过程中颗粒磨损严重且反应速率较低;与这些金属基的载氧体相比,CaSO4理论上氧转移能力[13]是其两倍,并且在自然界广泛分布,因此被认为最有应用前景的载氧体[14,15]。但是存在反应活性较弱、机械强度不高、副反应还会释放出大量硫化物等问题。因此,通过添加活性过渡金属氧化物来修饰CaSO4载氧体,其中Fe2O3[16]最为常用,Fe2O3+CaSO4复合载氧体因协同作用大大提高了反应活性。相比于Fe2O3,CuO较高的反应活性,并且具有亲硫性[17],能够减少硫化物污染。Mn基载氧体和CaSO4的复合载氧体[18]不仅反应活性较高而且其加强了煤炭的气化过程。
为进一步改善天然硬石膏(CaSO4)载氧体在化学链燃烧中的化学反应活化性,本文采用CuO和MnO2分别与天然硬石膏(CaSO4)制成复合载氧体。通过TGA,改变添加方法、添加量,比较CuO+CaSO4、MnO2+CaSO4载氧体与CaSO4载氧体的反应活性强弱,并通过两种复合载氧体反应前后微貌的变化,分析其反应机理,为提高CaSO4载氧体反应活性提供一种思路。
1 实验部分
1.1 复合载氧体的制备
天然石膏矿中CaSO4的质量分数为89.197%,其他的成分是CaO、SiO2、MgO、Al2O3和Fe2O3,粉碎筛分获取200~300 μm的颗粒;Cu(NO3)2·3H2O溶液的质量分数大于99%;Mn(NO3)2·4H2O溶液的质量分数为50%;CuO试剂的质量分数为99.0%;MnO2试剂的质量分数为85%。
在天然硬石膏中添加CuO和MnO2采用两种方法:(1)机械混合法;(2)浸渍方法。机械混合法比较简单,分别将CuO和MnO2加入天然硬石膏中进行均匀搅拌,再经干燥焙烧即可。而浸渍方法较为复杂,以制作CuO+CaSO4载氧体为例,介绍浸渍方法的制作过程,如图1所示。
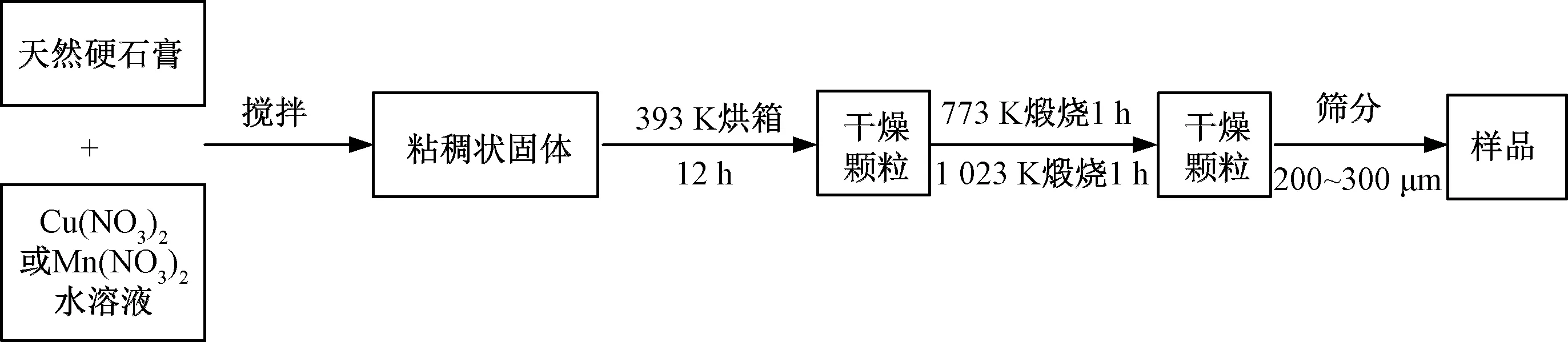
图1 Cu和Mn基复合载氧体浸渍法
分别制备Cu/Ca和Mn/Ca摩尔比为1%、3%、5%、10%和20%的5种样品。Cu(NO3)2·3H2O和Mn(NO3)2·4H2O溶液的添加量,如表1所示。Cu/Ca和Mn/Ca摩尔比为5%的复合载氧体的成分,如表2所示。

表2 复合载氧体的组分(质量分数wt%)
1.2 数据处理
引入反应转化率Xconver、反应转化速率rX和复合载氧体反应转化率达到80%时所需要的时间τX80三个参数[19]。
不同实验工况所制备的载氧体相关参数,如表3所示。

表3 CaSO4复合载氧体和CO反应的相关参数
反应中,某时刻复合载氧体及其完全氧化后分别与完全还原后的复合载氧体质量差的比值称为复合载氧体的转化率Xconver,其计算式为
(1)
式中:m为某时刻复合载氧体质量;下标red、ox分别为还原、氧化过程。
(2)
式中:τ为反应时间,min。
2 复合载氧体反应活性影响因素分析
利用复合载氧体转化比率和转化速率进行比较,分析添加方法、添加数量对两种复合载氧体反应活性的强弱影响。
2.1 添加方法对复合载氧体反应活性的影响
利用TGA,取Cu和Mn的摩尔浓度均为5 mol%样品与CO进行反应实验。同时为了进行比较,在相同条件下,取相同质量的CaSO4载氧体与CO进行反应实验。反应温度设定为1 198 K。
反应转化比率梯度随反应时间增加而减小,最终转化比率趋于1,如图2所示。通过比较τX80可知,浸渍法制备的CuO+CaSO4和MnO2+CaSO4载氧体分别约为27.7 min和35.8 min,机械混合法制备的分别约为53.1 min和44.5 min;CaSO4载氧体的τX80约为73 min。则浸渍法制备的复合载氧体Xconver快,反应活性强,如图2所示。

图2 载氧体转化比率Xconver随时间的变化曲线
实验结果表明,不论采用何种添加方法,相比于CaSO4载氧体,反应活性均有所增加。但浸渍法中CaSO4颗粒经历了Cu(NO3)2·3H2O和Mn(NO3)2·4H2O溶液的浸泡,相比于机械混合法其更均匀分布在CaSO4颗粒表面和缝隙中。因此浸渍法制备的复合载氧体,反应转换率梯度较大,转化速率快,反应活性高,这也验证了杨等[20]的结论。
浸渍法制备的CuO+CaSO4载氧体的反应活性比MnO2+CaSO4强。其主要原因为:在制备CuO+CaSO4的煅烧过程中,有气体从CaSO4颗粒中释放,使其颗粒内形成孔,CuO能深入到CaSO4颗粒内部。因此,增强了CuO+CaSO4载氧体的活化性。
2.2 添加量对复合载氧体反应活性的影响
通过上文分析可知,浸渍法优于机械混合法,故以浸渍法制备而得的载氧体为研究对象,改变添加量,分析其对反应活性的影响。
反应初期,复合载氧体颗粒表面含有CuO和MnO2,燃料CO先与CuO和MnO2发生反应,再与CaSO4发生反应。因此,复合载氧体的Xconver在反应初期快速增加,随着反应的进行,生成的CaO、CaS覆盖在复合载氧体颗粒表面,燃料CO需要穿过覆盖层才能接触到CaSO4。因此,复合载氧体转化比率缓慢增加,直到完全反应后,转化比率增至1,如图3所示。

图3 不同添加量复合载氧体转化比率Xconver随时间变化曲线
结果表明:随着CuO和MnO2添加量的不断增加,复合载氧体的转化速率变化为先增加再减少,存在一峰值。其中CuO摩尔浓度从1 mol%增加到5 mol%时,CuO+CaSO4复合载氧体的转化比率增加,而后开始减少;添加量为5 mol%CuO的CuO+CaSO4复合载氧体的转化比率最高;随着MnO2摩尔浓度增加,MnO2+CaSO4复合载氧体的转化比率增加,到达10 mol%后开始减少;添加量为10 mol%MnO2的MnO2+CaSO4复合载氧体的转化比率最高。
随着Xconver的增加,rX也发生变化,但反应结束时,均趋于0,如图4所示。

图4 复合载氧体转化速率 rX 与转化率 Xconve变化曲线
两种复合载氧体的转化速率的变化规律不同。CuO+CaSO4载氧体转化速率是先增加后减少至零,而MnO2+CaSO4载氧体的转化速率由最大一直减小至零。表明CuO+CaSO4载氧体反应活化性,先增强至最大再减弱;而MnO2+CaSO4复合载氧体反应活化性,反应一开始很强,随后快速减弱。
发生上述变化的主要原因为:当CuO和MnO2添加量较少的时候,除了能够很好地浸渍并分散到CaSO4颗粒表面上,还能进入到CaSO4颗粒表面的孔隙,从而能够提高CaSO4载氧体的反应活性;随着添加量的持续增加,CuO大量占据颗粒表面的孔隙,降低CaSO4的孔隙率,并且团聚形成小颗粒,在制备复合载氧体过程中容易脱落。因此,适宜添加量可以增加反应活性,过度添加CuO,复合载氧体反应活性不升反降。而CuO和MnO2的最佳添加量之所以不同,是与两种添加物各自的特性及在CaSO4颗粒表面的分布不同有关。当载氧体转化比率大于0.4时,MnO2+CaSO4载氧体的转化速率降低明显。但是在实际工业化反应过程中,为了避免严重的积碳反应,还原转化率一定要严格控制,一般要求载氧体的转化比率小于0.3[21]。因此,两种复合载氧体转化比率小于0.3时,转化速率依然很高。所以,适量添加的复合载氧体,其反应活性得到了较大的提高,并且过度添加,不仅导致反应活性降低,而且会增加复合载氧体的成本,降低了经济性。
3 两种复合载氧体反应活性的对比
选取两种添加量相同的复合载氧体进行反应活性对比分。即选取5%Cu+CaSO4和5%Mn+CaSO4载氧体为分析对象。通过反应前后的复合载氧体表面微貌、转化速率rX和失重比率的变化,分析复合载氧体反应活性的强弱。
3.1 复合载氧体反应前后表征分析
反应前后的两种复合载氧体分别进行了场发射扫描电镜(FESEM)和X射线能谱(EDX)分析,如图5、表4所示。
反应前,CuO+CaSO4载氧体表面上有许多晶须状和棒状结构的晶粒存在,颗粒表面疏松,孔隙较多,如图5(a)所示;而MnO2+CaSO4载氧体表面被大片薄板状物质覆盖,颗粒表面相对密实,孔隙较少,如图5(b)所示;CuO+CaSO4载氧体表面上Cu原子百分比为7.23%与理论原子百分比5%相接近,表明CuO在CaSO4载氧体表面分布比较均匀;MnO2+CaSO4载氧体表面上Mn原子百分比为24.91%与理论原子百分比5%相差较大,表明MnO2在CaSO4颗粒上分布的不均匀,如表4所示。
反应后,CuO+CaSO4载氧体表面相对光滑,因反应过程中有气体的生成,孔隙增大多,同时没有明显的烧结和团聚现象,如图5(c)所示;而MnO2+CaSO4载氧体表面变得相对光滑;孔隙略增,且没有明显的烧结和团聚现象,如图5(d)所示;CuO+CaSO4载氧体表面上Cu原子百分比为0.73%,MnO2+CaSO4载氧体表面上Mn原子百分比降低到2.64%,表明CuO和MnO2参与了还原反应,且反应后生成的颗粒从CaSO4颗粒表面脱离,如表4所示。

图5 两种复合载氧体反应前后的扫描电镜图

表4 两种复合载氧体表面主要元素的原子百分比
3.2 两种复合载氧体转化速率rX、失重比率的分析
通过对比复合载氧体转化率可知,转化率随反应的进行而增加,在转化率小于0.3之前,两者变化趋势基本相同。但转化速率rX在转化率为0.12前后有所不同,如图6示。

图6 最佳添加量复合载氧体转化速率与转化比率比较
两种复合载氧体的还原实验结果表明,CuO+CaSO4载氧体在整个反应过程中,反应活性都比较高;而MnO2+CaSO4载氧体,在反应刚开始时反应活性很高,随着反应的进行,其反应活性降低较快。反应前后通过FESEM-EDX分析结果可知,CuO在CaSO4上分布的较均匀,同时CuO+CaSO4载氧体的孔隙较多。当反应界面逐渐往里推进时,仍然有CuO存在。因此,CuO在较长的反应时间内都能对反应有促进作用。而MnO2+CaSO4载氧体,MnO2覆盖在CaSO4载氧体颗粒表面均匀较差,MnO2+CaSO4载氧体的孔隙较少。反应前期主要是CaSO4表面的MnO2与CaSO4发生反应,后期则主要是CaSO4参与反应,所以MnO2+CaSO4载氧体的反应活性降低较快。
在惰性气氛内,复合载氧体的失重比率随时间变化,如图7所示。140 min之后,CuO+CaSO4、MnO2+CaSO4载氧体的失重比率分别约为0.5%、0.2%,故CuO+CaSO4载氧体释放氧气量多于MnO2+CaSO4载氧体。因此,相同CuO和MnO2添加量时,因CuO在CaSO4颗粒表面分布的均匀度好于MnO2且能深入CaSO4颗粒的孔隙内,故CuO+CaSO4载氧体的反应活性强于MnO2+CaSO4载氧体。

图7 两种复合载氧体的失重比率随时间变化比较
4 结 论
(1) 通过实验验证浸渍法和机械混合法分别制备的载氧体反应活性均有提高,但前者优于后者;
(2) 实验证明:相同添加量时,CuO+CaSO4载氧体反应活性好于MnO2+CaSO4载氧体;最佳添加量CuO为5 mol%、MnO2为10 mol%;
(3) 惰性气氛下,两种相同添加量的复合载氧体失重比率表明:CuO+CaSO4载氧体释放氧气量多于MnO2+CaSO4载氧体。因此,CuO+CaSO4和载氧体反应活性好于MnO2+CaSO4载氧体;
(4) 在相同添加量情况下,由于CuO和MnO2在CaSO4颗粒上的分布的均匀度不同,CuO+CaSO4载氧体,在整个反应过程中反应活性比较高;MnO2+CaSO4载氧体,在反应刚开始时反应活性很高,随着反应进行,其反应活性下降较快。
因此,根据CuO和MnO2这两种添加剂各自的特性,适量添加可以提高CaSO4载氧体的反应活性,有效改善化学链燃烧的性能。
