改良球囊损伤联合高脂饮食建立兔腹主动脉粥样硬化模型
2024-03-13林清霞李春坚
华 芮,李 宸,雍 辉,林清霞,董 舟,吕 展,李春坚
南京医科大学第一附属医院心内科,江苏 南京 210029
动脉粥样硬化(atherosclerosis,AS)是一种以脂质代谢障碍为基础、血管内壁脂质沉积为特征的慢性、进行性动脉血管病变,严重危害人类生命健康[1-3]。AS斑块破裂,可继发血栓形成,从而造成组织严重缺血、缺氧、甚至坏死[4-5]。建立动物模型,进一步研究AS的发病机制,对预防心血管事件有重要意义。
兔是建立AS 模型常用的动物之一。目前研究多采用球囊损伤联合高脂饮食建立兔腹主动脉粥样硬化模型,这在一定程度上避免了单纯高脂饮食带来的耗时长、动物多脏器脂质沉积等缺陷,但仍存在建模时间长、动物死亡率高、模型不稳定等问题[6]。本研究采用一种改良的球囊损伤方式、联合4 周高脂饮食建立兔腹主动脉粥样硬化模型,探讨其与经典手术方式在模型成功率、稳定性和斑块发展速度等方面的差异。
分化簇(cluster of differentiation,CD)47,也称为整合素相关蛋白,是广泛表达于细胞膜表面的抑制性受体,在免疫系统的自我识别中起关键作用[7]。CD47与巨噬细胞上的信号调节蛋白α(signal regulatory protein alpha,SIRPα)跨膜蛋白结合,向巨噬细胞传递吞噬抑制信号[8]。研究报道CD47在小鼠和人类AS斑块的内皮和平滑肌中的表达显著上调[9-10]。然而,CD47是否在早期AS斑块中表达并损害吞噬清除作用尚缺乏研究。本研究将利用建立的兔腹主动脉早期粥样硬化模型,验证CD47 在AS 早期斑块中的表达,为AS的发病机制和治疗研究提供借鉴。
1 材料和方法
1.1 材料
MaverickTM2.0 mm×15.0 mm 球囊(Boston Scientific 公司,美国),QuantumTM3.5 mm×15.0 mm 球囊(Boston Scientific 公司,美国),PILOT 50 导丝(Abbott Vascular 公司,美国);压力泵(Merit 公司,美国),血管内超声(intravascular ultrasound,IVUS)仪(Volcano公司,美国);苏木素染色液(武汉赛维尔生物公司),伊红染色液(武汉塞维尔生物公司);CD47抗体(北京博奥森生物公司),CD68 抗体(Thermo Fisher Scientific 公司,美国);丙泊酚乳状注射液(北京费森尤斯卡比公司);利多卡因注射液(重庆天圣药业有限公司);青霉素(石家庄华北制药股份有限公司)。
1.2 方法
1.2.1 动物与饲养
3 月龄健康雄性新西兰白兔20 只,体重2.0~2.5 kg,由南京市莱芙养殖场提供[许可证编号:SCXK(苏)2019-0005,合格证号:202238952]。所有动物单笼饲养,自由饮水,保持12 h昼夜节律,恒定温度和湿度,本研究方案经过南京医科大学实验动物福利伦理委员会审查批准(编号:IACUC-2207041)。手术组15只,根据造模方式又分为经典手术组和改良手术组,麻醉、切皮、分离股动脉,经股动脉随机行经典球囊损伤或改良球囊损伤,术后缝合创口,予高脂饮食4 周。假手术组5 只,同样麻醉、切皮、分离股动脉加缝合,但不行球囊损伤,术后予普通饮食4周。20只兔术前对应饲料适应性喂养1周。高脂饲料配制:1%胆固醇、8%猪油、7.5%蛋黄粉和83.5%普通饲料。
1.2.2 球囊损伤术构建兔腹主动脉粥样硬化模型
经耳缘静脉注射丙泊酚(6 mg/kg)麻醉,麻醉成功表现为呼吸深慢、四肢瘫软、角膜反射迟缓。将兔仰卧位固定于手术台上,双侧股三角区局部备皮、消毒,利多卡因局部麻醉,在股动脉搏动明显处切口,沿动脉走行方向切开皮肤、逐层分离筋膜肌肉,暴露右股动脉。游离右股动脉4~5 cm,近心端用丝线套取游离备用,远心端用丝线结扎。近心端用动脉夹夹闭,用眼科剪在远心端剪一“V”形切口。
经典手术方式:将3.5 mm×15.0 mm球囊导管沿导丝送入腹主动脉内,送入过程中松开动脉夹,球囊进入深度约15 cm。将球囊加压至12~14 大气压(1 215.6~1 418.2 kPa),回拉球囊导管10 cm,然后球囊减压至0 kPa,再次送至原位置,如此反复3次,损伤腹主动脉内皮。撤出球囊导管,迅速以动脉夹夹闭股动脉,结扎股动脉近心端,松开动脉夹,缝合消毒。
改良手术方式:将2.0 mm×15.0 mm球囊导管沿导丝送入股动脉内约2 cm,以4个大气压(405.2 kPa)扩张球囊,阻断血流,固定球囊,松开动脉夹,继续送入导丝25~30 cm,动脉夹夹闭近心端,撤出球囊。将3.5 mm×15.0 mm 球囊导管沿导丝送入腹主动脉内,送入过程中松开动脉夹,球囊进入深度为25~30 cm。将球囊加压至20个大气压(2 026.0 kPa),反复前后拉动球囊30~40次,逐步回撤10 cm,损伤腹主动脉内皮。撤出球囊导管,迅速以动脉夹夹闭股动脉,结扎股动脉近心端,松开动脉夹,缝合消毒。
术后常规护理,予青霉素2 500 U/kg肌注,连续3 d。
1.2.3 IVUS检查
术后各组对应饮食喂养4 周,麻醉后暴露切开左侧股三角区,穿刺左股动脉,沿导丝送入IVUS 探头,在超声引导下将探头送至降主动脉左肾动脉开口以上水平,采用机器自动控制系统,缓慢匀速回拉超声导管至髂总动脉分叉处,全程记录超声图像,保存供脱机分析。
1.2.4 苏木素-伊红(hematoxylin-eosin,HE)染色
各组兔完成IVUS检测后,沿耳缘静脉注入过量丙泊酚处死两组实验兔,开腹,动脉夹夹闭膈肌下近心端腹主动脉,结扎两侧肾动脉。从降主动脉与肾动脉开口间向下切取约8 cm腹主动脉,取出腹主动脉。切取左肾动脉开口以下约8 cm的腹主动脉,于肝素水中冲洗后,4%多聚甲醛固定24 h。标尺测量切取动脉,每段1 cm,顺序编号后进行石蜡包埋,每层4 μm逐层切片。部分切片HE 染色后,拍摄图像,取粥样硬化斑块最大切面,Image J 分析计算粥样硬化斑块最大内膜厚度、平均内膜厚度、内膜中膜面积比及血管狭窄比例(斑块面积/管腔总面积)。
1.2.5 免疫组化检测
免疫组化检测假手术组和改良手术组血管中巨噬细胞相关蛋白CD68 及抗吞噬蛋白CD47 的蛋白表达水平。上述石蜡切片进行脱蜡、水化和蒸馏水冲洗。山羊血清封闭1 h后,切片分别与CD68一抗(1∶50)、CD47 一抗(1∶400)在4 ℃孵育过夜。室温下与二抗孵育1 h,用二氨基联苯胺染色,蒸馏水阻断反应,封片后在显微镜下观察拍摄。
1.3 统计学方法
2 结果
2.1 一般情况
正常饮食假手术组无死亡,手术组当日麻醉死亡1只,动脉夹层破裂死亡1只(改良手术组),高脂饲养过程中绝食重度营养不良死亡1 只(经典手术组),剩余12 只(经典手术组与改良手术组各6 只)均完成4周的高脂饮食喂养,每组均有1只出现轻度趾甲溃烂。各组体重变化见表1,经典手术组与改良手术组体重变化比较,差异无统计学意义(图1)。
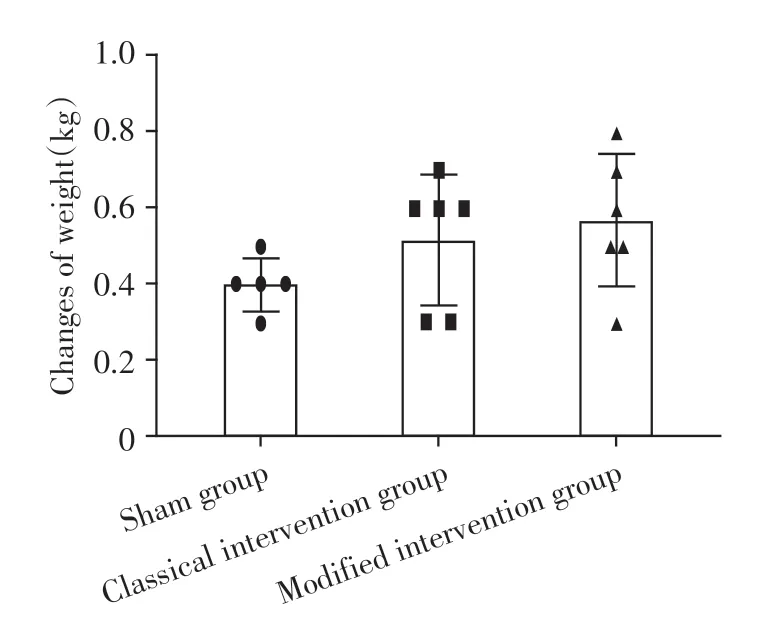
图1 各组兔造模前后体重差值Figure 1 Weight changes of rabbits in each group before and after modeling
表1 各组兔造模前后体重Table 1 The weight of rabbits in each group before and after modeling(kg,±s)

表1 各组兔造模前后体重Table 1 The weight of rabbits in each group before and after modeling(kg,±s)
2.2 兔腹主动脉IVUS结果
各组兔腹主动脉IVUS 图像见图2。假手术组:内膜无增厚,血流通畅,管腔无狭窄;经典手术组:内膜稍增厚模糊,未见管腔明显狭窄与斑块形成;改良手术组:内膜明显增厚,斑块突出于腔内,呈偏心性分布,与管腔分界清晰,回声强度均匀,为内膜增厚回声,与内弹性膜形成的高回声层间分界不清晰,强度低于血管外膜,没有钙化回声,为脂质斑块。

图2 术后高脂饮食4周各组兔腹主动脉IVUS影像Figure 2 IVUS images of abdominal aortas in rabbits of each group after a high-cholesterol diet for 4 weeks
2.3 兔腹主动脉内膜增生情况
各组兔腹主动脉HE 染色和巨噬细胞标志物CD68表达情况见图3。假手术组:管腔单层内皮细胞扁平连续,未见增厚,平滑肌细胞整齐有序,细胞核蓝染,胞浆呈红色,各层细胞及弹力膜结构清晰,无脂质沉积。未见棕黄色蛋白,无巨噬细胞沉积。经典手术组:管腔少部分内膜轻度增厚,增厚内膜中多层平滑肌细胞排列紊乱,可见小空泡,少量棕黄色沉积,巨噬细胞少量浸润,内弹力膜尚清晰。改良手术组:血管纵切面内膜普遍全程不均匀偏心增厚,向管腔凸出,形成斑块。部分内膜断裂,增厚内膜各层细胞紊乱堆叠,胞浆嗜酸红染的平滑肌细胞减少,代之以大量胞浆淡染和充满脂质空泡的泡沫细胞,大量巨噬细胞浸润,各层结构界限模糊,管腔明显狭窄。
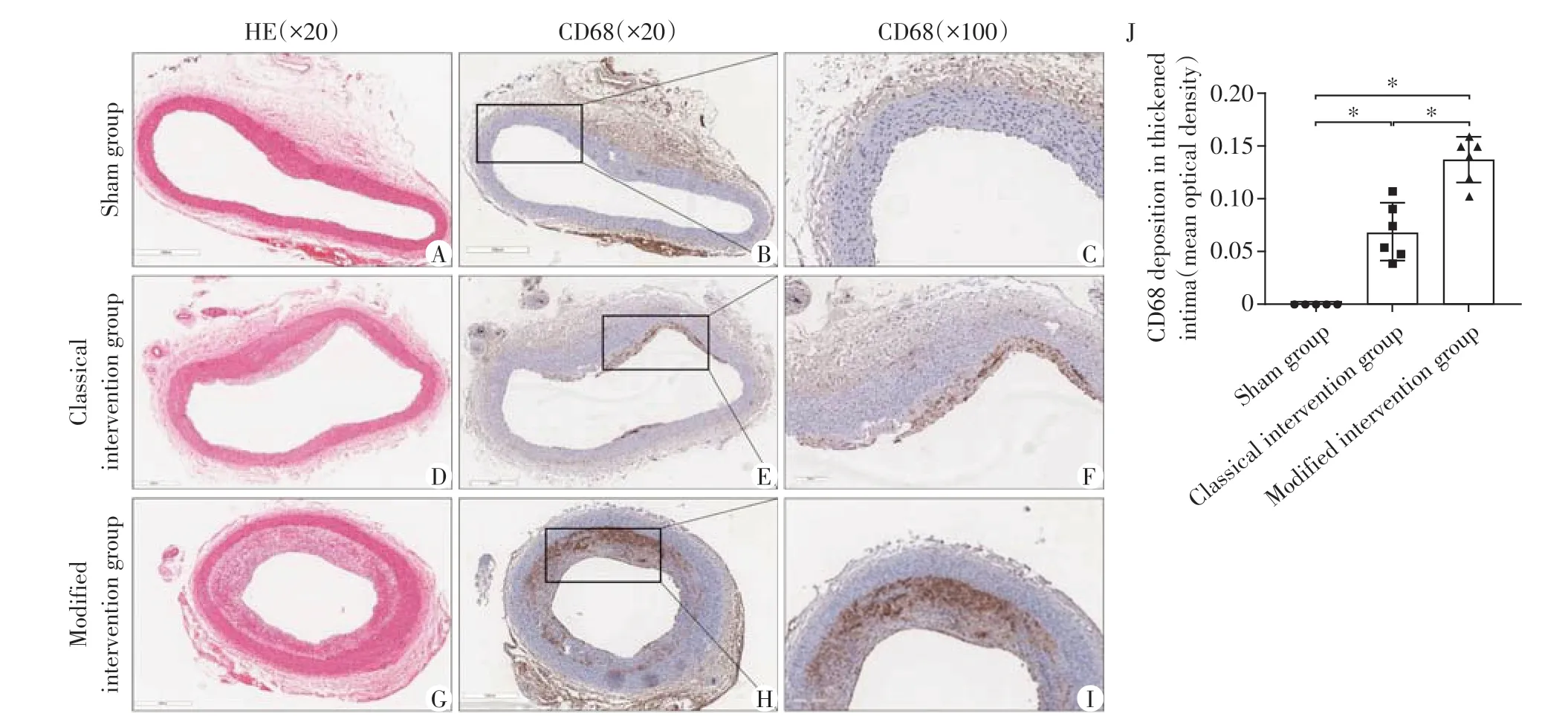
图3 术后高脂饮食4周各组兔的腹主动脉HE染色及CD68蛋白免疫组化染色Figure 3 The HE staining and CD68 immunohistochemical staining of abdominal aortas in rabbits of each group after a high-cholesterol diet for 4 weeks
与假手术组比,手术组内膜增厚程度及管腔狭窄比例差异有统计学意义(P<0.05)。改良手术组内膜最大厚度、平均内膜厚度、内膜中膜面积比、管腔狭窄比例均大于经典手术组(P<0.05,表2)。
表2 各组免腹主动脉内膜增生程度Table 2 The degree of abdominal aorta intima hyperplasia in rabbits of each group(±s)
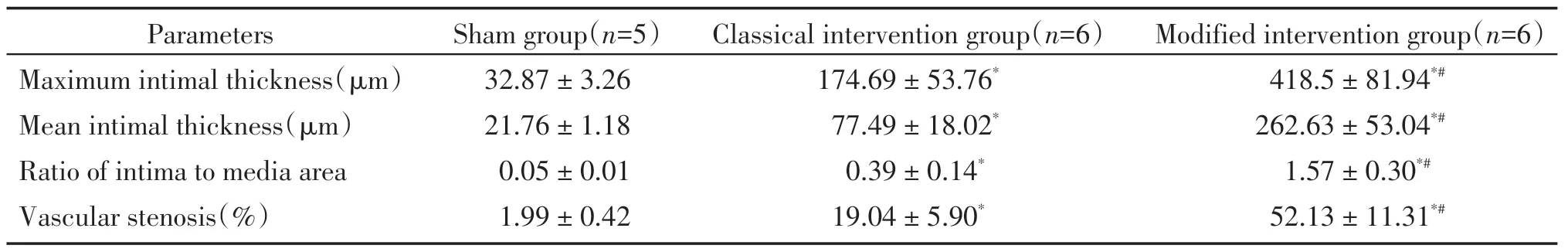
表2 各组免腹主动脉内膜增生程度Table 2 The degree of abdominal aorta intima hyperplasia in rabbits of each group(±s)
Compared with the sham group,*P<0.05;compared with the classical intervention group,#P<0.05.
2.4 早期斑块中CD47的表达
各组腹主动脉HE染色及斑块中的抗吞噬蛋白CD47 的免疫组化检测结果见图4。假手术组的腹主动脉内膜未见棕黄色染色,提示CD47 低表达或不表达;经典手术组可见少量棕黄色染色团块聚集于增生内膜内,提示斑块内CD47低表达;改良手术组可见棕黄色染色团块聚集于泡沫细胞内,颗粒状弥散性表达于细胞外基质。平滑肌层细胞核蓝染,胞质透明,无棕色沉积,各层界限分明,提示斑块内CD47高表达,且局限于增生的内膜。与假手术组和经典手术组比,CD47在改良手术组的表达差异有统计学意义。
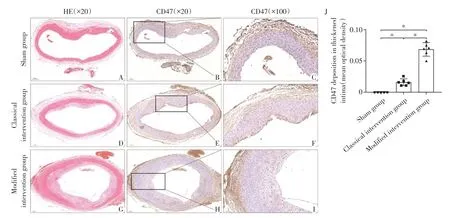
图4 各组兔腹主动脉CD47蛋白免疫组化染色Figure 4 The CD47 immunohistochemical staining of abdominal aortas in rabbits of each group
3 讨论
兔与人类的血脂代谢极为相似,是最早用于建立AS模型的动物之一[11]。单纯高脂饮食造模,造模周期长、慢性并发症较多、模型成功率受个体间差异影响大,实际应用受限[12-14]。现多采用球囊损伤联合高脂饮食,一定程度上缩短了造模时间,但周期仍长达12~16周,且动物死亡率高,模型稳定性不足[15-16]。本研究在传统内皮损伤法的基础上进行改良。经典球囊损伤多采用3.5 mm×15.0 mm 球囊导管8~14 个大气压(810.4~1 418.2 kPa)扩张后回拉3 次造成内皮损伤[17]。在本研究的球囊损伤模型中,首先采用直径2.0 mm的球囊进入股动脉,4个大气压(405.2 kPa)扩张后阻断血流,将导丝沿球囊送入腹主动脉25~30 cm后更换为直径3.5 mm的球囊,减少了术中出血。内皮损伤阶段应用20 个大气压(2 026.0 kPa)扩张球囊,反复前后拉动球囊30~40次,逐步回撤,造成广泛的腹主动脉内皮损伤,且未对兔的术中、术后生存率产生影响。所有手术模型兔均有不同程度的内膜增生,两种手术方案造模成功率均为100%。
陈家元等[18]建立的高脂饮食联合球囊损伤兔腹主动脉模型中,采用经典手术方式,术后4周腹主动脉处于脂纹阶段,出现轻度内膜增生,8周后出现了造影可见的内膜增生和血管狭窄。本研究改良手术方式后,4周即可在IVUS下观察到显著的内膜增生和血管狭窄,且体重改变与经典手术组的差异无统计学意义,提示改良手术方式可加速AS斑块进展。此外,免疫组化结果显示两种手术方式均有细胞内脂质沉积,巨噬细胞浸润,而无明显钙化、脂质核心或坏死核心,说明斑块均为早期软斑块,而改良手术组的内膜厚度和斑块体积较经典手术组显著增加,造成明显血管狭窄,提示改良后的造模方法周期更短、更稳定,可靠性高。
AS 的特点是慢性持续炎症反应和坏死细胞堆积[19]。在AS早期,巨噬细胞吞噬在损伤内膜下积聚的低密度脂蛋白,形成泡沫细胞并发生细胞死亡。凋亡细胞清除缺陷导致巨噬细胞进一步聚集,与积累的死亡细胞及脂质碎片形成坏死核心,诱发持续炎症反应,加速AS进展,形成晚期AS[20]。本研究中可见巨噬细胞在手术组的斑块内浸润,改良手术组中巨噬细胞浸润显著高于经典手术组,且多在内膜深层堆积。CD47 作为阻断巨噬细胞吞噬信号的膜蛋白,因在恶性肿瘤细胞表面过表达,促进肿瘤免疫逃逸而被广泛关注[21]。Kojima 等[22]在小鼠主动脉和人类颈动脉粥样硬化晚期斑块中也发现了CD47的过度表达,并且在小鼠AS 高脂饮食早期应用抗CD47抗体可以显著减少斑块内凋亡细胞数目,缩小斑块体积,促进斑块稳定。本研究首次揭示了兔腹主动脉AS 发展早期出现了只局限于增生内膜中的CD47过表达,且CD47在斑块内不同成分中普遍过表达,提示巨噬细胞清除缺陷在AS早期发挥了重要作用。在IVUS可诊断的早期斑块中,抑制CD47可能成为早期抑制AS发展的新策略。
综上,本研究一方面改良了手术方式,加速了斑块进展,4周即形成了IVUS可诊断的明显增生内膜,狭窄程度较一致,适用于AS斑块的快速诱导和早期斑块机制的研究。另一方面,本研究首次揭示了在兔腹主动脉AS中,抗吞噬分子CD47在斑块早期即有显著过表达,该时期抑制CD47,有可能增加坏死细胞清除,为延缓AS进展提供了新的潜在策略。
