CCR8在卵巢癌浸润性Treg上的表达与意义
2024-03-13陶子琦茅晔鹏刘书娜娄鉴芳严丽娜
陶子琦,茅晔鹏,刘书娜,娄鉴芳,付 鑫,张 磊,严丽娜,3,王 婷,王 芳*
1南京医科大学第一附属医院检验学部,2国家医学检验临床医学研究中心分中心,江苏 南京 210029;3南京市妇幼保健院妇科,江苏 南京 210004
卵巢癌是最致命的妇科恶性肿瘤,由于其发病隐匿,进展迅速,且缺乏有效的早期筛查手段,多数患者确诊时已为晚期。虽然免疫治疗是卵巢癌治疗的一个有前途的新领域,多种有希望的免疫治疗手段已被研发,但仍然需要克服免疫抑制性肿瘤微环境(tumor microenvironment,TME)以提高免疫治疗的疗效[1-3]。TME 中的免疫抑制是促进肿瘤生长与转移最为重要的前提条件之一,是肿瘤免疫治疗的主要障碍之一[4]。免疫抑制性细胞及抑制因子是肿瘤免疫抑制微环境的重要组成部分,调节性T 细胞(regulatory T cell,Treg)是其中的重要一员,通过不依赖于细胞接触(分泌抑制性细胞因子)或依赖于细胞接触(调节抗原呈递细胞功能和介导靶细胞的溶解或凋亡)的机制发挥免疫抑制功能,阻碍肿瘤特异性免疫反应[5-7]。趋化因子-趋化因子受体(C-C motif chemokine receptor,CCR)信号介导的募集作用是肿瘤内Treg浸润的主要机制。研究显示有多个CCR 通过与趋化因子配体(chemokine ligand,CCL)的结合,如CCR4-CCL17/22、CCR5-CCL5、CCR8-CCL1/18 和CCR10-CCL28 等,参与招募Treg到TME[8-11]。与正常组织驻留及外周Treg 相比,人肺癌、乳腺癌及大肠癌等肿瘤浸润性Treg上选择性高表达CCR8[12]。而CCR8 在卵巢癌肿瘤浸润性Treg 上是否高表达,CCR8+Treg 是否是卵巢癌肿瘤浸润Treg 的主要类型,相关问题尚未明确。因此,本研究以小鼠卵巢上皮癌细胞ID8构建的卵巢癌荷瘤C57BL/6小鼠模型为对象,分析CCR8在卵巢癌肿瘤浸润性Treg中的表达,及其对Treg分化的作用。
1 对象和方法
1.1 材料
C57BL/6小鼠卵巢上皮癌细胞ID8(深圳豪泰生物公司);胎牛血清(杭州四季青公司);青霉素-链霉素溶液、红细胞裂解液和DMSO溶液(上海碧云天生物公司);高浓度基质胶(南京优宁维生物公司);RPMI 1640 培养基(Hyclone 公司,美国),X-Vivo 15培养基(Lonza 公司,瑞士);小鼠初始CD4+T Cell 提取磁珠(Miltenyi 公司,德国);AZ084(Med Chem Express 公司,美国);CD3e 单抗、CD28 单抗(eBioscience 公司,美国);重组鼠IL-2(Peprotech 公司,美国);TGF-β(R&D 公司,美国);PE/Cyanine7 标记的抗小鼠CD45、Brilliant Violet 510 标记的抗小鼠CD3、FITC 标记的抗小鼠CD4、PE 标记的抗小鼠Foxp3、Brilliant Violet 421 标记的抗小鼠CCR8、APC标记的抗小鼠细胞毒性T 淋巴细胞抗原4(cytotoxic T-lymphocyte antigen 4,CTLA-4)、APC 标记的抗小鼠程序性细胞死亡蛋白1(programmed cell death protein 1,PD1)、APC标记的抗小鼠淋巴细胞激活基因3(lymphocyte-activation gene 3,LAG-3)、APC标记的抗小鼠可诱导的T 细胞共刺激分子(inducible T cell costimulator,ICOS)等流式抗体(Biolegend 公司,美国);Ⅳ型胶原酶(Gibco 公司,美国);Percoll 细胞分离液、透明质酸酶、DNA酶Ⅰ、谷氨酰胺(Sigma公司,美国)。
1.2 方法
1.2.1 TCGA数据库、GTEx数据库分析
下载426 例TCGA 数据库中上皮性卵巢癌组织(https://portal.gdc.cancer.gov)与88 例GTEx 数据库中卵巢正常组织(http://gepia.cancer-pku.cn/)的RNA-seq 数据,以|Log2TPM|>1 和P<0.05 为显著差异标准对趋化因子CCL1、CCL18 作差异分析,并基于R 包-GSVA[1.46.0]中提供的ssGSEA 算法,计算各类免疫细胞:Treg、中性粒细胞、B 细胞、肥大细胞、Th17 细胞、Tgd细胞的浸润比例,使用Spearman统计方法分析基因CCR8[ENSG00000179934.7]与各免疫细胞的相关性,使用R包-ggplot2[3.3.6]对分析结果进行可视化。
1.2.2 小鼠皮下成瘤实验
本动物实验获得南京医科大学实验动物福利伦理委员会批准(IACUC-2303001)。20 只C57BL/6小鼠购自南京集萃药康生物科技公司。5×106个ID8细胞在复苏后经过3次传代培养,制备成100 μL细胞悬液,同时添加100 μL 20 mg/mL胶原蛋白的高浓度基质胶悬液,混匀后接种在小鼠腋下至侧腹的皮下部位,接种之后,小鼠仍置于SPF环境继续生长21 d后CO2窒息处死,取脾脏、肿瘤组织、外周血样本。
1.2.3 小鼠样本处理
将脾脏组织碾磨后制备成单细胞悬液,使用红细胞裂解液分别分离出脾脏和外周血样本中的单个核细胞。将新鲜的小鼠皮下卵巢肿瘤组织剪成1 mm3的小块,在配制的原代组织消化液[RPMI-1640 培养基+胶原酶Ⅳ(1 μg/mL)+透明质酸酶(100 ng/mL)+DNA 酶Ⅰ(50 U/mL)+谷氨酰胺(1 mmol/L)+1%青霉素-链霉素溶液]中37 ℃消化1 h 后40 μm 滤器过滤,将过滤后细胞悬液使用70%Percoll、30%Percoll梯度离心,得到单个核细胞悬液。
1.2.4 流式检测小鼠样本中Treg细胞上CCR8以及免疫检查点相关蛋白的比例
将小鼠脾脏、外周血、肿瘤组织的单个核细胞悬液铺在流式管底,加入PE/Cyanine7标记的抗小鼠CD45、Brilliant Violet 510 标记的抗小鼠CD3、FITC标记的抗小鼠CD4、PE 标记的抗小鼠Foxp3、Brilliant Violet 421 标记的抗小鼠CCR8、APC 标记的抗小鼠CTLA-4、APC标记的抗小鼠PDI、APC标记的抗小鼠LAG-3、APC 标记的抗小鼠ICOS 等流式抗体,经孵育、破核、洗涤、固定后使用Beckman Cytoflex流式仪进行检测。
1.2.5 体外诱导小鼠Treg细胞实验
雌性C57BL/6 小鼠,6~8 周龄,体重18~20 g。2%戊巴比妥麻醉小鼠,无菌操作下取脾脏,碾磨匀浆分离脾脏细胞,裂解红细胞后得到单个核细胞,以磁珠提取初始CD4+T 细胞。圆底96 孔板以4 μg/mL CD3 单抗4 ℃包被过夜后,加入15 ng/mL hTGF-β、30 U/mL鼠IL-2、2 μg/mL CD28单抗,将初始CD4+T细胞以X-Vivo 15培养基调至1×106个/mL铺在圆底96孔板中,隔天半定量换液并传代。AZ084是一种强效的CCR8 变构拮抗剂,其Ki 值为0.9 nmol/L,以DMSO作为溶剂溶解10 mg AZ084粉末,将其制备为AZ084储存液(5 mmol/L)。依据不同处理方式分为AZ084组、DMSO组与MOCK组。AZ084组在诱导过程中每日加入5 μmol/L 的CCR8 变构拮抗剂AZ084,DMSO组在诱导过程中每日加入与AZ084组同体积的DMSO溶液,MOCK组为空白对照,只诱导分化不做其他任何处理。诱导培养3~5 d,流式检测CD4+Foxp3+Treg细胞的比例。
1.3 统计学方法
所有数据使用SPSS 25.0 统计软件进行数据分析,各组数据均以均值±标准差(±s)表示,两组间的比较,符合正态分布的数据用独立样本t检验,多组间比较用单因素方差分析,非正态性分布数据采用Mann-Whitney 检验。P<0.05 为差异有统计学意义。
2 结果
2.1 趋化因子CCL18 在卵巢癌与癌旁组织中的表达存在显著差异
利用TCGA 与GTEx 公共数据库获取上皮性卵巢癌组织以及卵巢正常组织的RNA-seq 数据,分析CCL1 mRNA 与CCL18 mRNA 在卵巢癌中的表达情况,发现CCL1基因在人类卵巢癌组织(n=426)与卵巢正常组织(n=88)中无明显差异(图1A),CCL18基因在人类卵巢癌组织中显著上调(非配对样本,P<0.05,图1B)。同时对CCL1、CCL18 的受体CCR8 作免疫浸润分析与Spearman相关性分析,绘制棒棒糖图(图2),结果显示CCR8基因与卵巢癌浸润的Treg细胞具有高相关性(R=0.592,P<0.05)。

图1 趋化因子CCL1 和CCL18 mRNA 在TCGA 上皮性卵巢癌组织数据集和GTEx卵巢正常组织数据集中的表达水平Figure 1 Chemokine mRNA expressions of CCL1 and CCL18 in epithelial ovarian cancer tissues of TCGA and normal ovarian tissues of GTEx
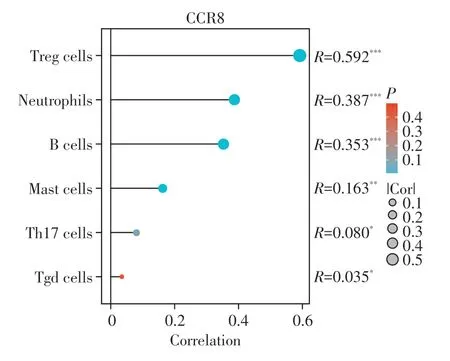
图2 人卵巢癌免疫细胞与CCR8基因的Spearman 相关性分析Figure 2 Spearman correlation analysis between the CCR8 gene expression and immune cell infiltration in human ovarian cancer
2.2 CCR8 及免疫检查点相关蛋白PD-1、CTLA-4、LAG-3、ICOS在卵巢癌小鼠模型的肿瘤组织、外周血及脾脏中Treg上的表达情况
采用CO2窒息法处死8 例C57BL/6 卵巢癌荷瘤小鼠,对其皮下瘤模型进行瘤体大小测量,根据公式V=1/2×a×b2(a为长轴,b为短轴)计算得出肿瘤体积为800~1 200 mm3(图3)。采用流式细胞术(图4)检测8 例荷瘤小鼠的肿瘤组织(图5)、外周血(图6)、脾脏(图7)的单个核细胞悬液中Treg 细胞上的CCR8表达,结果显示小鼠肿瘤浸润性的CCR8+Treg占总Treg的比例为(74.3±13.2)%,而在小鼠脾脏、外周血中分别为(44.0±8.5)%、(16.9±7.8)%,小鼠肿瘤中浸润性CCR8+Treg 占总Treg 的比例显著高于小鼠脾脏、外周血。小鼠外周血、脾脏、肿瘤中浸润性CCR8+Treg 中PD-1+细胞亚群的比例分别为(16.4±8.8)%、(50.0±16.4)%、(80.0±12.4)%,LAG-3+细胞亚群的比例分别为(11.3±6.9)%、(19.6±11.7)%、(74.0±8.7)%,ICOS+细胞亚群的比例分别为(18.3±10.5)%、(20.9±7.5)%、(72.3±6.8)%,CTLA-4+细胞亚群的比例分别为(13.5±6.7)%、(26.1±16.9)%、(49.1±15.7)%。小鼠肿瘤浸润性CCR8+Treg中PD-1+、LAG-3+、ICOS+、CTLA-4+细胞亚群的比例显著高于脾脏和外周血(Mann-Whitney检验,P<0.05,图8)。

图3 C57BL/6小鼠卵巢癌皮下瘤代表图Figure 3 Representative images of subcutaneous tumors in C57BL/6 mice of ovarian cancer
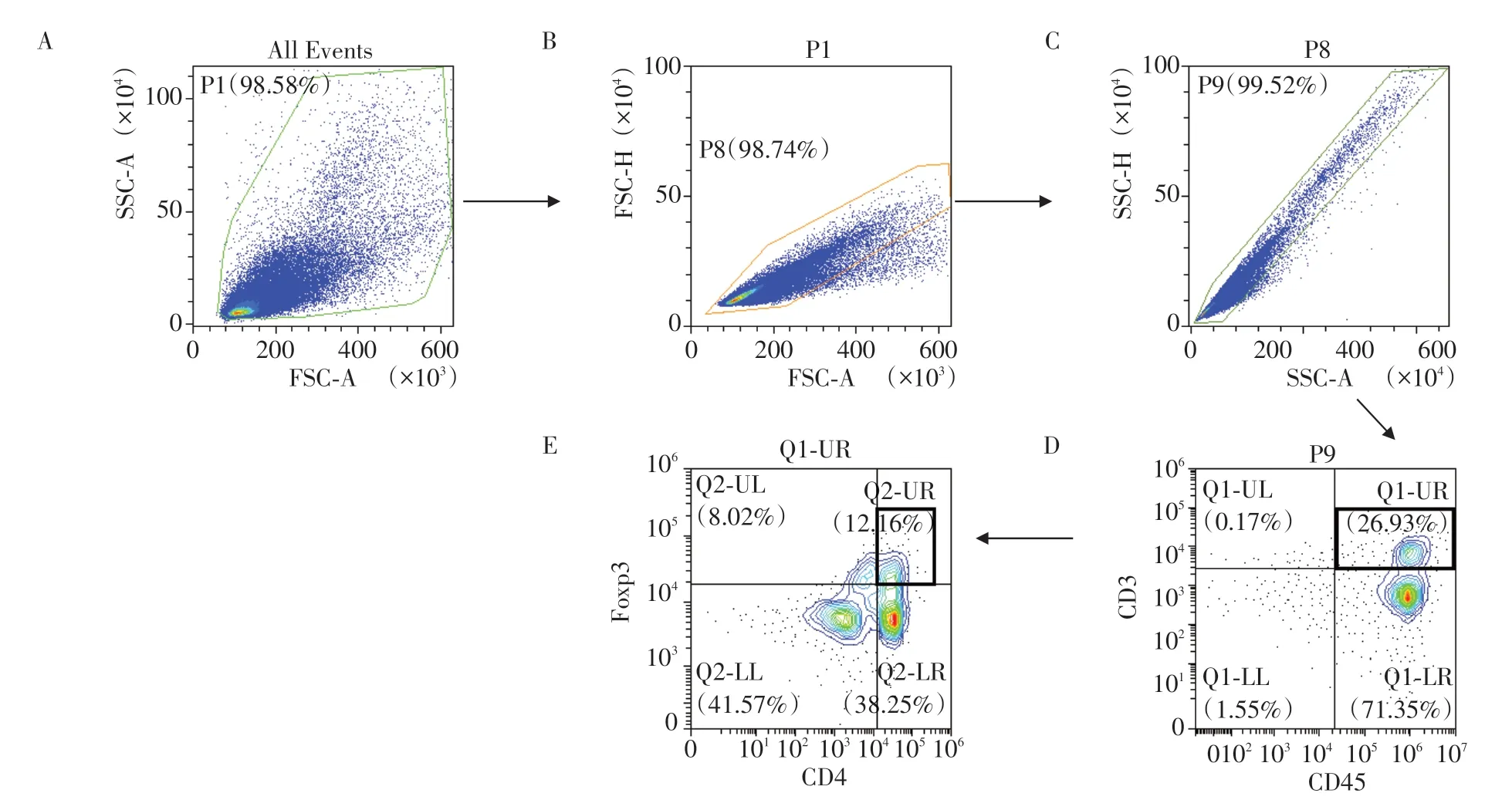
图4 小鼠模型来源样本流式细胞术检测方案Figure 4 A flow cytometry strategy for samples from the mouse model
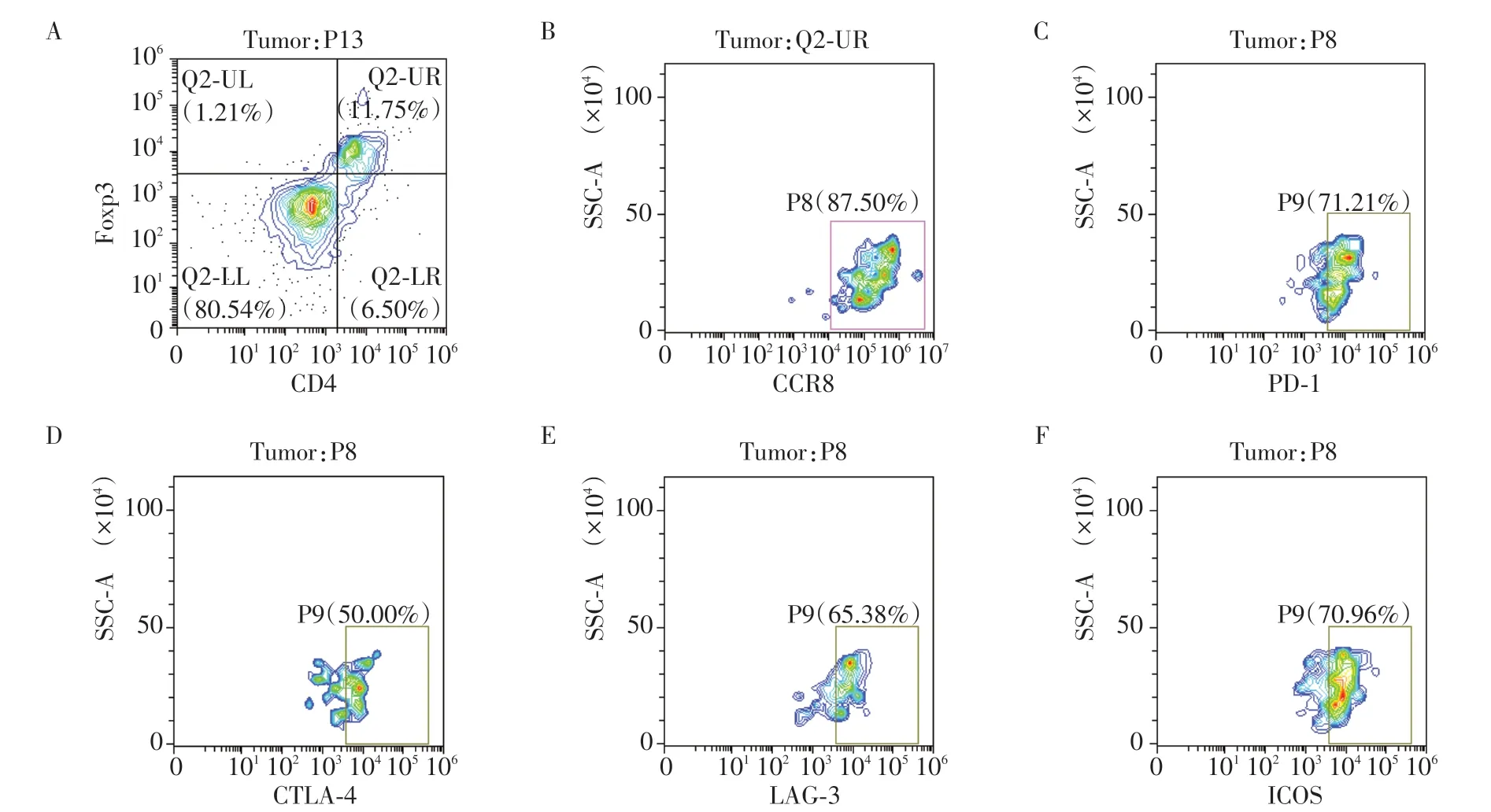
图5 小鼠卵巢癌肿瘤浸润性CCR8+Treg细胞比例与表型流式检测图Figure 5 Proportion and phenotype of tumor infiltrating CCR8+Treg cells in mouse ovarian cancer tissues detected by flow cytometry analysis

图6 小鼠外周血中CCR8+Treg细胞比例与表型流式检测图Figure 6 Proportion and phenotype of CCR8+Treg cells in mouse peripheral blood detected by flow cytometry analysis
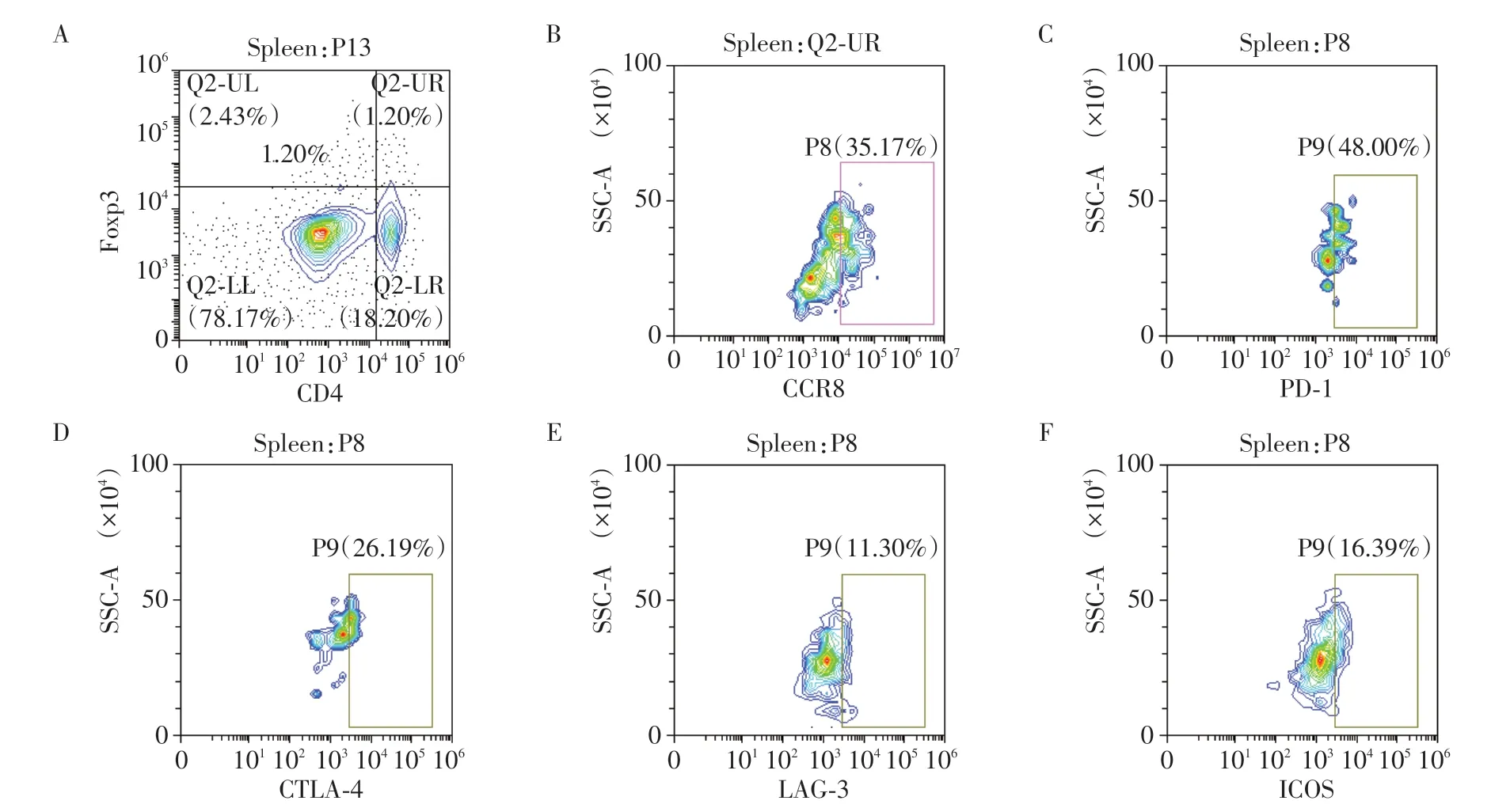
图7 小鼠脾脏中CCR8+Treg细胞比例与表型流式检测图Figure 7 Proportion and phenotype of CCR8+Treg cells in mouse spleens detected by flow cytometry analysis

图8 小鼠肿瘤组织、脾脏、外周血中Treg细胞表型分析Figure 8 The phenotype analysis of Treg cells in mouse tumor tissues,spleens and peripheral blood
2.3 体外实验中CCR8 拮抗剂抑制小鼠的初始CD4+ T细胞向Treg细胞的诱导分化
小鼠脾脏的初始CD4+T 细胞向Treg 细胞诱导分化,结果显示AZ084 组、DMSO 组、MOCK 组的Treg 细胞分化比例分别为(29.1±8.8)%、(52.2±9.6)%、(70.6±16.7)%,AZ084 组与DMSO 组、MOCK组差异均有统计学意义(P<0.05,图9)。

图9 比较AZ084、DMSO、MOCK组初始CD4+T细胞向Treg细胞分化的比例Figure 9 Comparisons in the proportion of naive CD4+T cells differentiating into Treg cells in AZ084,DMSO and MOCK groups
3 讨论
卵巢癌是病死率最高的妇科恶性肿瘤,虽然治疗方法不断改进,但是卵巢癌患者的生存率并没有明显提高。近年来免疫治疗逐渐显示出巨大潜力。TME 的复杂性和多样性对免疫治疗的效果具有重要影响。深入阐明卵巢癌免疫抑制微环境的产生机制,探索提高免疫治疗效果的新策略是卵巢癌治疗的研究方向。卵巢癌免疫抑制微环境形成的主要机制之一是Treg 细胞抑制CD8+效应性T 细胞杀伤肿瘤的功能。肿瘤浸润性Treg高度活化、增殖,具有很大的异质性[13],而趋化因子和细胞因子依赖的募集是Treg 细胞向肿瘤浸润的主要机制。如趋化因子CCL1和CCL18,由肿瘤细胞和TME内的树突状细胞分泌,与Treg细胞上的CCR8受体结合,引导它们向肿瘤部位移动[14-15]。细胞因子IL-2,通过与Treg 细胞表面上的CD25(IL-2 受体的α链)结合,能够促进Treg 细胞的活性和增殖。在一些肠癌模型中,通过增加IL-2的浓度可以显著增加Treg细胞在TME中的数量[16]。因此,在抗肿瘤免疫治疗中,Treg细胞的调节和耗竭策略被认为是有效的方法。然而,由于缺乏对肿瘤浸润性Treg群体的良好选择性,这些策略往往导致严重的不良反应[17]。因此需要开发一种针对肿瘤浸润性Treg 细胞的特异性靶向标志物。
本研究发现在小鼠模型中,CCR8 作为卵巢癌最稳定和差异表达的趋化因子受体,CCR8+Treg是卵巢癌浸润性Treg 的主要类型,CCR8+Treg 中PD-1+、CTLA-4+、ICOS+、LAG-3+亚群也显著高于脾脏和外周血液,提示CCR8+Treg 可能是卵巢癌主要的浸润性Treg,在肿瘤免疫抑制微环境中发挥主导作用,其抑制性与共刺激性的亚群都比外周组织中更活跃,因此可能在卵巢癌免疫逃逸中发挥作用。同时,CCR8变构拮抗剂AZ084 明显抑制初始CD4+T 细胞向Treg 细胞的诱导分化。最新研究也显示,在人类乳腺癌、肺癌、结肠癌、肝癌以及小鼠黑色素瘤、非小细胞肺癌等模型中,肿瘤浸润性Treg 细胞上的CCR8 表达增高[18],与本研究的结论基本一致。因此靶向卵巢癌浸润性CCR8+Treg,选择性地清除CCR8+Treg 或抑制其功能,可控制或改善TME 的免疫抑制状态,有利于提高卵巢癌免疫治疗的疗效。但目前研究暂不足以说明CCR8对肿瘤浸润性Treg发挥功能具有必要性,后续将进一步研究直接敲除Treg上的CCR8基因对肿瘤浸润性Treg 免疫表型与功能的影响以及CCR8+Treg 功能调控的分子机制,从而为卵巢癌的靶向免疫治疗提供更精准的分子诊断依据。
