神经肽Y/Y1受体激活β-catenin信号通路介导心肌细胞损伤
2024-03-13任志欣钱炳俊
胡 君,戴 丽,陈 霞,任志欣,钱炳俊
江苏医药职业学院公共卫生与管理学院,江苏 盐城 224005
近年来,心源性猝死(sudden cardiac death,SCD)的发病率显著增加并呈年轻化趋势,严重威胁着人类的生命健康。SCD本质上表现为心脏电传导功能紊乱,多发生于有心脏基础病变的心肌病患者,如心肌肥厚、冠心病、心肌梗死等。这些疾病造成患者的心肌细胞发生不同程度的损伤,是猝死发生的物质基础[1-2]。了解心肌细胞损伤的诱因并探讨其相应的分子机制,对于心肌疾病的精准诊疗以及预防SCD猝死具有重要意义。
神经肽Y(neuropeptide Y,NPY)是1 种由36 个氨基酸组成的小分子多肽,是心肌组织中含量最丰富的神经肽类物质。心肌梗死、心衰等发生时,血清和心肌组织中NPY表达均显著增加[3]。然而NPY在心肌细胞中的功能目前没有统一的认识。研究发现NPY高表达对心血管系统具有损伤作用,可进一步引发高血压和心肌肥厚[4];敲除NPY可有效缓解缺血诱导的心肌细胞凋亡和功能障碍[5]。然而也有研究认为,缺乏NPY的急性心肌缺血小鼠表现出更严重的进行性心肌炎症和心肌纤维化[6],提示NPY高表达可能是机体的一种反馈保护机制。因此深入探讨不同状态下NPY 对心肌细胞的作用及相应机制具有重要意义。
目前已发现的NPY作用受体有8种亚型。激活细胞表面不同亚型的受体可产生不同的生物学效应。Y1 受体是心肌细胞表面主要的表达亚型。高血压大鼠心肌组织Y1受体表达增加,参与调节心肌细胞的能量生成[7]。NPY 通过Y1 受体可促进内皮细胞和血管平滑肌细胞的增殖和迁移。然而NPY/Y1受体信号转导是否参与β肾上腺素受体持续激活诱导心肌损伤目前尚未可知。经典Wnt/β-catenin信号通路在细胞生长、增殖、迁移以及凋亡等过程中扮演重要角色。糖尿病性心肌病中,心肌组织糖原合成酶激酶3β(glycogen synthesis kinase 3β,GSK3β)mRNA 下降,p-GSK3β增加,诱导细胞质中β-catenin入核,启动下游靶基因表达,导致细胞凋亡[8]。NPY是否影响心肌细胞中经典Wnt信号通路未见相关报道。基于此,本研究建立异丙肾上腺素(isoprenaline,ISO)诱导的小鼠心肌损伤模型和Y1 受体特异性激活剂[Leu31,Pro34]-NPY 诱导的H9C2 细胞模型,探讨NPY/Y1 受体信号转导是否通过β-catenin信号通路诱导心肌细胞损伤。
1 材料和方法
1.1 材料
1.2 方法
1.2.1 实验动物分组
4周龄雄性小鼠随机分成4组,包括对照组、ISO组、BIBO3304+ISO组、BIBO3304组,每组10只。对照组皮下注射生理盐水;ISO组皮下注射20 mg/(kg·d)ISO;BIBO3304+ISO 组腹腔注射0.1 mg/(kg·d)BIBO3304,30 min 后皮下注射20 mg/(kg·d)ISO;BIBO3304 组腹腔注射0.1 mg/(kg·d)BIBO3304,所有组连续给药14 d。
1.2.2 HE和Masson染色
收集各组小鼠心肌组织置于4%多聚甲醛中固定过夜,用梯度乙醇进行脱水处理、石蜡包埋、切片(5 μm),最后置70 ℃烘箱烤片2.5 h,HE染色观察心肌纤维形态结构;Masson染色观察心肌纤维化程度。
1.2.3 细胞培养
H9C2细胞接种于6孔培养板上,用含10%胎牛血清的L-DMEM 培养24 h后,无血清L-DMEM 饥饿处理过夜,用不同浓度(0、10、100 nmol/L)[Leu31,Pro34]-NPY处理细胞24 h或48 h后进行相应的实验。
1.2.4 荧光定量PCR
TRIzol 法提取细胞样品中的总RNA,采用反转录试剂合成cDNA。Real-time RT-PCR 检测心肌组织中NPY 和细胞中肥大基因心房钠尿肽(atrial natriuretic peptide,ANP)、β-肌球蛋白重链(β-myosin heavy chain,β-MHC)mRNA 表达,以GAPDH 作为内参。具体引物序列见表1。
另外要介绍另一家名为“Victory Hotel”的餐厅,食物质素很好,座落在地底的酒窖也令人目不瑕接,其所收藏的陈酿及经典酒款,当中不少是上世纪80及90年代的澳大利亚老酒,更甚者是它划分了令人疯狂爱上的Burgundy酒窖区域,予游客任君选购。

表1 PCR引物序列Table 1 PCR primer sequences
1.2.5 Western blot检测蛋白表达
心肌组织或细胞样品中加入PIPA 裂解液(含1 mmol/L 蛋白酶抑制剂和1 mmol/L 磷酸化酶抑制剂)提取心肌或细胞的总蛋白。蛋白定量后与上样缓冲液混合,金属浴煮沸5 min变性,之后进行SDSPAGE电泳分离。快速湿转将蛋白转移到PVDF膜,5%脱脂牛奶室温封闭1 h,加入一抗(NPY,1∶1 000稀释;p-GSK3β,1∶1 000 稀释;t-GSK3β,1∶1 000 稀释;active β-catenin,1∶1 000稀释;GAPDH,1∶5 000稀释),4 ℃摇床孵育过夜。TBST 清洗3 次,每次10 min。之后加入HRP-标记的二抗(1∶5 000稀释)室温孵育2 h,TBST 清洗3 次,每次10 min。ECL 显影,Image J软件对蛋白灰度值进行定量分析。
1.2.6 CCK-8法检测H9C2细胞活力
H9C2 细胞以6×104个/mL 接种至96 孔培养板上,24 h后细胞饥饿过夜,分别加入不同浓度(0、10、100 nmol/L)的[Leu31,Pro34]-NPY 处理细胞48 h。之后向每孔中加入10 μL CCK-8 工作液,37 ℃培养箱内孵育2 h。用酶标仪检测450 nm处每孔的吸光度值,并计算心肌细胞活力。
1.2.7 免疫荧光染色
H9C2 细胞以1×105个/mL 密度接种至24 孔板中,24 h 后细胞饥饿过夜。Y1 受体特异性拮抗剂BIBO3304(1 μmol/L)或β-catenin特异性抑制剂ICG001(1 μmol/L)预处理细胞30 min 后,用100 nmol/L[Leu31,Pro34]-NPY 处理细胞。4%多聚甲醛固定细胞,PBS清洗3次。0.2%TritonX-100处理30 min,PBS 清洗3 次。3%BSA 封闭细胞60 min,PBS 清洗3 次。细胞骨架染色:加入Actin-Tracker Red-555 4 ℃过夜后滴加DAPI 染细胞核10 min,PBS 清洗3 次,荧光显微镜观察拍照。β-catenin 入核检测:孵育β-catenin 一抗4°C 过夜,PBS 清洗3 次后加入AF488 标记的抗兔二抗(1∶100 稀释),室温下孵育2 h;滴加DAPI染细胞核10 min,PBS清洗3次,荧光显微镜观察拍照。采用Image J 软件对细胞面积进行定量分析。
1.3 统计学方法
数据结果采用GraphPad Prism 7软件进行处理。符合正态分布的计量资料以均数±标准差(±s)表示。两组间数据比较采用独立样本t检验;多组间数据比较采用单因素方差分析。两两比较采用SNK-q检验,P<0.05为差异有统计学意义。
2 结果
2.1 ISO组小鼠心肌组织NPY水平增加
与对照组相比,ISO组小鼠皮下注射20 mg/(kg·d)ISO 14 d 后,心肌组织中NPY mRNA 和蛋白表达显著增加,差异有统计学意义(P<0.05,图1)。
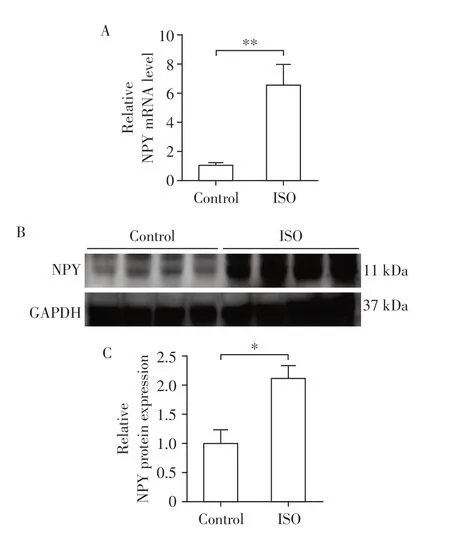
图1 小鼠心肌组织中NPY mRNA和蛋白表达Figure 1 Expression of NPY mRNA and protein in myocardial tissue of mice
2.2 BIBO3304缓解ISO诱导的心肌损伤和纤维化
对照组小鼠皮下注射生理盐水2 周后,心肌纤维没有出现明显损伤,心肌细胞排列整齐,纤维结构清晰,无明显纤维化。与对照组相比,ISO 组小鼠心肌组织HE 染色出现明显的心肌细胞坏死、心肌细胞溶解;Masson 染色显示心肌组织胶原沉积明显增加,并向周围间质延伸。与ISO 组相比,BIBO3304+ISO组心肌细胞损伤有所缓解,心肌组织胶原沉积明显减少。与对照组相比,BIBO3304组小鼠心肌纤维结构和心肌胶原沉积程度无明显改变(图2A、B)。与对照组相比,ISO组小鼠心肌肥大基因ANP、β-MHC mRNA 表达显著增加;与ISO 组相比,BIBO3304+ISO 组小鼠ANP、β-MHC mRNA 表达降低(P<0.01)。与对照组相比,BIBO3304 组小鼠ANP、β-MHC mRNA表达无明显变化(图2C、D)。
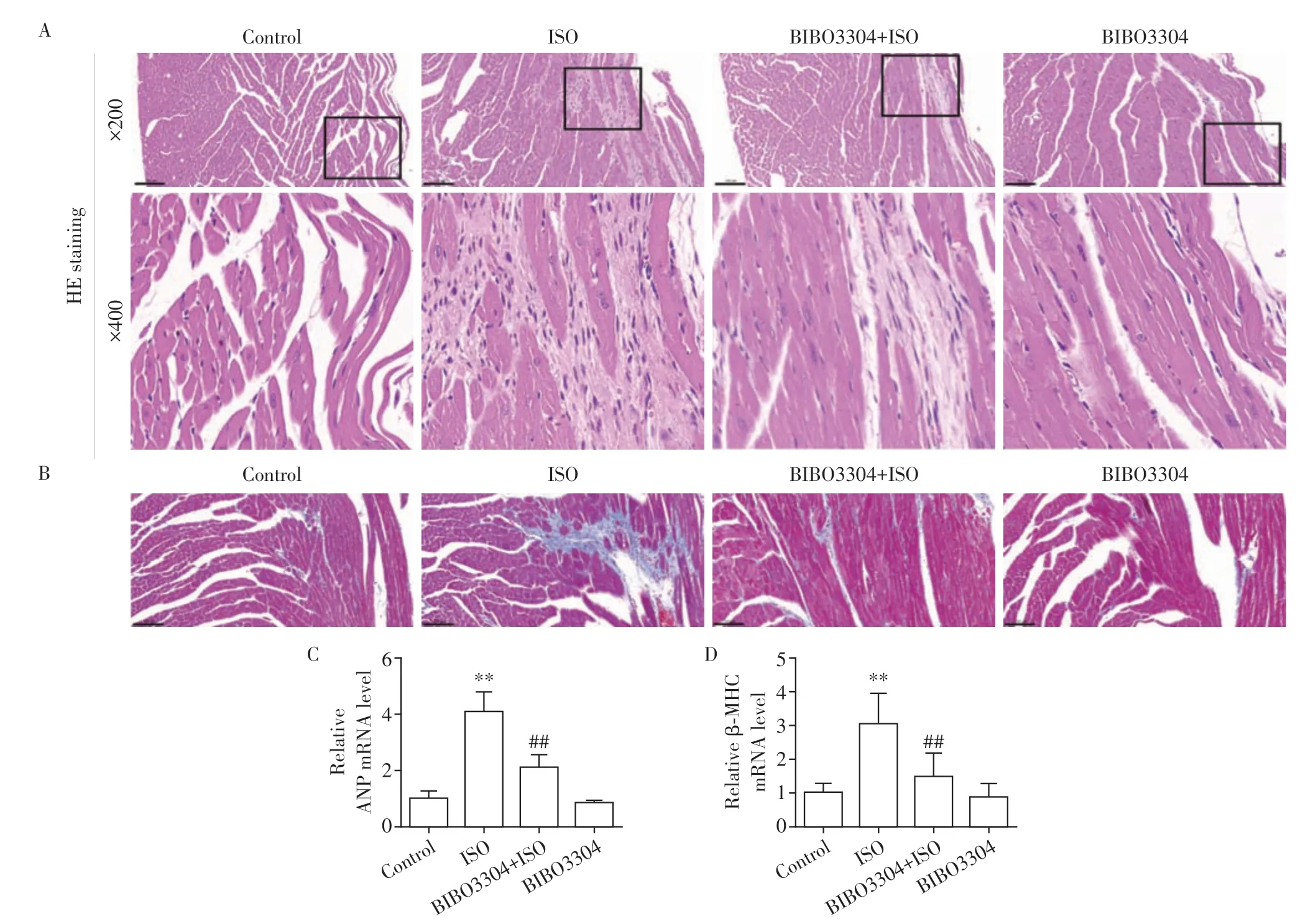
图2 BIBO3304缓解ISO诱导的心肌损伤和纤维化Figure 2 BIBO3304 alleviated ISO-induced myocardial injury and fibrosis
2.3 [Leu31,Pro34]-NPY诱导H9C2心肌细胞损伤
为探索NPY/Y1受体对心肌细胞的直接生物学效应,用不同浓度(0、10、100 nmol/L)的Y1受体特异性激活剂[Leu31,Pro34]-NPY 处理H9C2细胞24 h,定量PCR 结果显示心肌肥大基因ANP、β-MHC mRNA 表达显著增加(P<0.01,图3A、B)。CCK-8检测发现,[Leu31,Pro34]-NPY 处理H9C2 细胞48 h后细胞活力明显下降(P<0.01),呈现剂量依赖效应(图3C)。
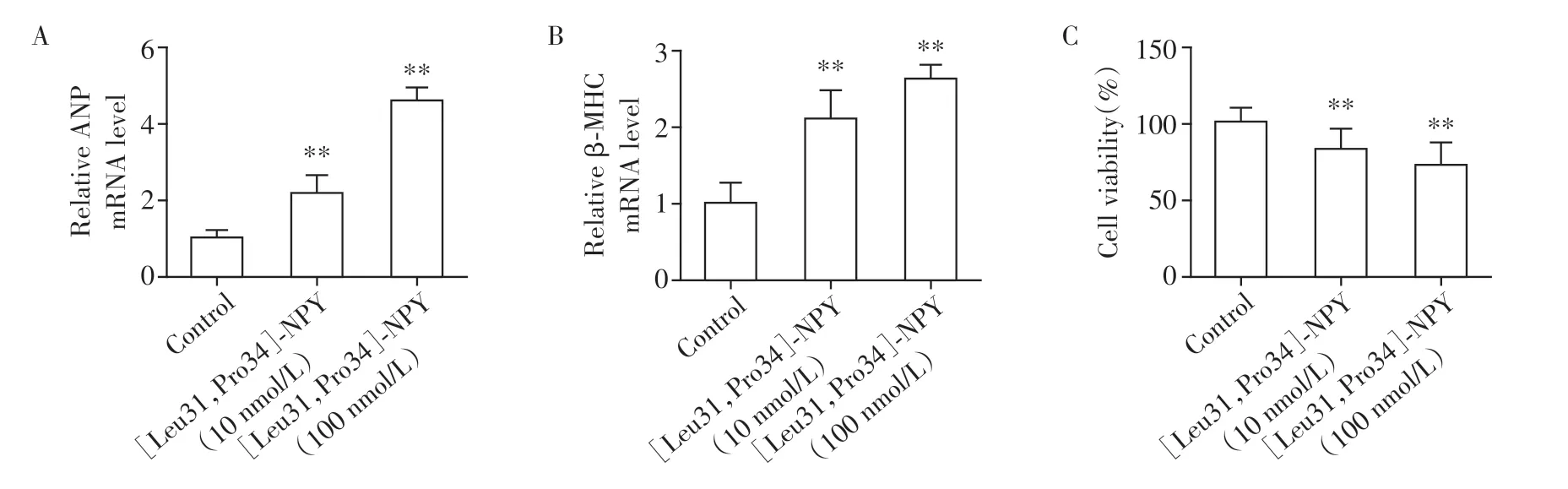
图3 [Leu31,Pro34]-NPY诱导H9C2细胞损伤Figure 3 [Leu31,Pro34]-NPY induced injury of H9C2 cells
2.4 BIBO3304 缓解ISO 诱导激活的β-catenin 信号通路
与对照组相比,ISO组p-GSK3β、active β-catenin表达增加,p-GSK3β/t-GSK3β比值增加,提示β-catenin信号通路激活。与ISO 组相比,BIBO3304+ISO组active β-catenin 和p-GSK3β/t-GSK3β表达显著下降(P<0.05)。BIBO3304 组与对照组相比,active βcatenin和p-GSK3β/t-GSK3β表达差异无统计学意义(图4)。

图4 BIBO3304抑制ISO诱导的β-catenin信号通路蛋白表达Figure 4 BIBO3304 inhibited ISO-induced protein expressions of β-catenin pathway
2.5 [Leu31,Pro34]-NPY激活β-catenin信号通路
与对照组相比,Y1 受体激动剂[Leu31,Pro34]-NPY 增加active β-catenin、p-GSK3β表达,active βcatenin/GAPDH、p-GSK3β/t-GSK3β比值增加(P<0.05,图5A~C),提示β-catenin信号通路激活。与对照组相比,[Leu31,Pro34]-NPY促进细胞核β-catenin增加;与[Leu31,Pro34]-NPY 组相比,BIBO3304 抑制细胞核β-catenin积累(图5D)。
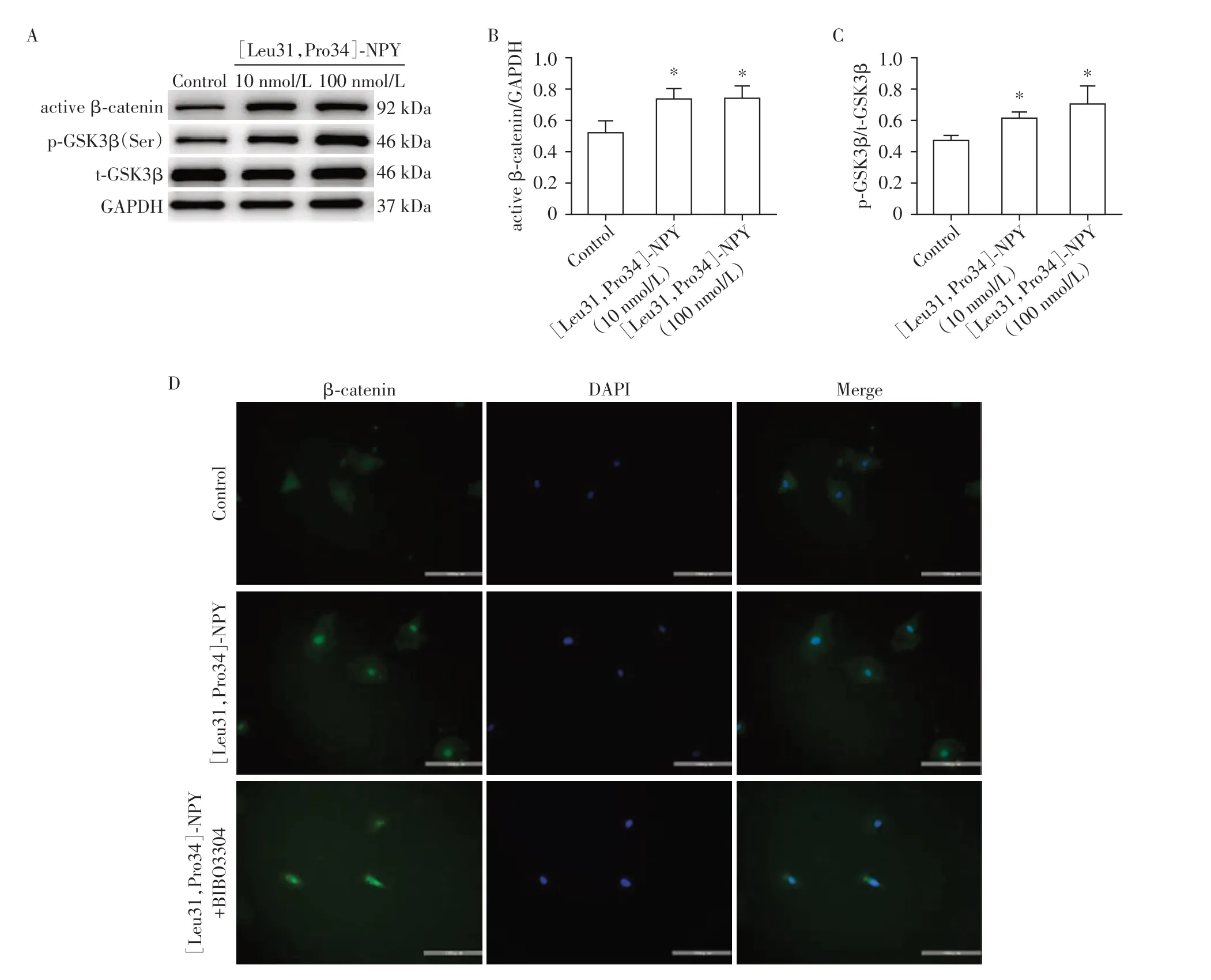
图5 [Leu31,Pro34]-NPY激活H9C2细胞的β-catenin信号通路Figure 5 [Leu31,Pro34]-NPY activated the β-catenin pathway in H9C2 cells
2.6 抑制β-catenin 信号通路缓解[Leu31,Pro34]-NPY诱导的H9C2细胞损伤
与[Leu31,Pro34]-NPY 组相比,ICG001 显著抑制[Leu31,Pro34]-NPY 诱导的H9C2 细胞心肌肥大基因ANP、β-MHC mRNA 表达上升(P<0.05)和细胞面积增加(P<0.01),缓解心肌细胞活力下降(P<0.01,图6)。

图6 ICG001缓解[Leu31,Pro34]-NPY诱导的H9C2细胞损伤Figure 6 ICG001 alleviated cell injury induced by[Leu31,Pro34]-NPY in H9C2 cells
3 讨论
本研究构建ISO 诱导的小鼠心肌损伤模型和[Leu31,Pro34]-NPY 诱导的H9C2 细胞模型,探索NPY/Y1 受体信号转导在心肌损伤中的作用及机制。结果显示:ISO 诱导小鼠心肌组织NPY mRNA和蛋白表达增加、心肌细胞损伤和心肌纤维化,特异性拮抗Y1受体可有效缓解ISO诱导的心肌损伤、纤维化以及心肌肥大基因表达;体外实验证实特异性激活Y1 受体增加心肌肥大基因表达和心肌细胞面积,降低心肌细胞活力。体内外实验均表明NPY通过Y1 受体转导可促进心肌细胞GSK3β磷酸化,增加细胞内active β-catenin 表达;拮抗Y1受体信号转导可有效抑制ISO 诱导的心肌组织p-GSK3β和active β-catenin表达增加。[Leu31,Pro34]-NPY促进H9C2细胞核β-catenin积累;BIBO3304抑制[Leu31,Pro34]-NPY诱导的细胞核β-catenin表达。β-catenin转录激活的特异性抑制剂ICG001显著缓解[Leu31,Pro34]-NPY诱导的心肌细胞肥大和细胞活力下降。
NPY 是心肌组织中含量最丰富的神经肽类激素,参与多种心血管疾病如高血压、应激性心肌病、糖尿病性心肌病等的发生发展[9-10]。在生理或病理状态下,机体交感神经兴奋增强使得神经末梢NPY分泌和释放增加,血清NPY 水平显著升高,进一步可促进血管收缩和心肌重构。此外,心肌内皮细胞、血小板、巨噬细胞等也可以合成和释放NPY。一般认为,NPY在心肌组织中可发挥短时和长时两种效应。短时效应是NPY调节钙离子信号,影响心肌细胞兴奋收缩偶联;长时效应则是NPY作为一种细胞因子,调节心肌细胞肥大和凋亡等。前期研究发现,多种心血管疾病发生时血清和心肌组织中NPY水平均显著增加。在体外培养的心肌细胞中,H2O2可直接诱导细胞内NPY表达增加,下调心肌细胞中NPY表达,显著缓解氧化应激导致的心肌细胞凋亡[5]。本研究通过皮下注射ISO构建小鼠心肌损伤模型,14 d 后发现心肌组织NPY mRNA 和蛋白的表达显著上升,提示在β肾上腺素受体持续激活诱导的心肌损伤过程中,NPY 的表达同样增加,与之前的研究结果一致。
NPY通过与细胞表面的Y受体特异性结合发挥生物学效应。NPY 及其受体的遗传多态性与心血管疾病的发病发展具有显著相关性[11-12]。然而关于NPY 在心肌组织中的功能目前仍存在较大争议。研究发现,血清NPY 水平与患者心肌肥厚程度呈正相关,是影响心力衰竭患者1 年生存率的独立因素[13-14];NPY 敲除后,心肌缺血导致的心肌功能障碍、细胞凋亡等可有效缓解[5],提示NPY/Y受体介导了心肌肥大、细胞损伤和心肌功能障碍的发生发展。然而也有研究认为NPY 增强巨噬细胞p62/SQSTM1依赖性自噬和核因子E2相关因子2(nuclear factor-erythroid 2 related factor 2,NRF2)介导的抗氧化信号通路[15]。此外NPY促进血管生成、减轻小鼠急性心梗后的心肌重塑、抑制心肌炎症和纤维化[6],提示NPY 可能对心肌损伤有抑制作用。因此深入探讨心肌组织中NPY/Y 受体信号转导对心血管疾病的预防和精准诊疗具有重要意义。
目前已发现8 种亚型的NPY 作用受体,除了受体Y3外,其余亚型的受体均为G蛋白偶联受体。激活不同亚型的受体可以产生不同的生物学效应。Y1 受体是心肌细胞表达的主要亚型。短时效应方面,Y1受体激活后增加心肌细胞的正性收缩。阻断抑制NPY/Y1受体信号转导被认为是β受体阻滞剂治疗室性心律失常的一种有效辅助方式[16]。长时效应方面,NPY通过Y1受体可促进内皮细胞和血管平滑肌细胞的增殖和迁移[17]。在高血压大鼠模型中,心肌组织Y1受体mRNA和蛋白表达增加,参与调节心肌细胞的能量生成。NPY/Y1 受体信号转导还介导了血管收缩效应和肺高血压[9,18]。本研究发现Y1受体特异性拮抗剂BIBO3304有效缓解了ISO诱导的小鼠心肌细胞排列紊乱、心肌纤维化及心肌肥大基因表达,提示NPY/Y1受体介导了ISO诱导的小鼠心肌损伤。此外,Y1 受体特异性的激活剂[Leu31,Pro34]-NPY 刺激H9C2 细胞后,小鼠心肌细胞肥大基因ANP、β-MHC mRNA 表达增加,细胞面积增大,细胞活力显著下降,进一步证实了NPY/Y1 受体信号转导对心肌细胞具有直接损伤效应。
β-catenin是经典Wnt信号通路的关键下游效应因子,参与心肌肥大、纤维化、心衰等多个过程的调节[19-20]。当Wnt 信号通路激活后,GSK3β自身磷酸化水平增加,抑制GSK3β对β-catenin 的磷酸化降解,最终导致细胞质内游离β-catenin 蛋白表达增加,β-catenin 转入细胞核,作为核转录辅因子调节下游靶基因的表达。GSK3β活性降低或GSK3β缺陷型的小鼠心脏细胞分裂紊乱,可导致扩张性心肌病的发生[21]。此外,在心肌肥厚的大鼠心脏和肾脏中均发现了Wnt/β-catenin 信号通路的激活,而阻断该信号通路可有效改善这两个组织的损伤[22]。本研究中在ISO组小鼠心肌组织和[Leu31,Pro34]-NPY处理的H9C2 细胞中均发现了p-GSK3 β 和activeβ-catenin 的高表达;BIBO3304 可抑制ISO 诱导的β-catenin 信号通路的激活;BIBO3304 抑制[Leu31,Pro34]-NPY 诱导的β-catenin 入核;ICG001 有效改善[Leu31,Pro34]-NPY 诱导的心肌细胞肥大和细胞活力下降,提示NPY/Y1 受体信号转导可能通过β-catenin 信号通路介导了心肌细胞损伤和纤维化。前期研究发现,在压力超负荷引起的小鼠心肌肥厚模型中,心肌组织Wnt配体Wnt1、Wnt3a表达增加,同时β-catenin 水平上调,与心肌损伤和纤维化程度一致[22]。在心肌肥大和损伤过程中,高表达的NPY是否通过调节心肌细胞中Wnt配体的表达亚型和表达水平影响GSK3β的磷酸化状态,导致Wnt 信号通路激活,尚需进一步研究。
综上所述,本研究认为在β肾上腺素受体持续激活诱导的心肌损伤过程中,NPY 合成和释放增加,其通过与Y1 受体结合激活β-catenin 信号通路;增加的β-catenin 转入细胞核,调节下游靶基因的表达,介导了心肌细胞损伤和纤维化(图7)。本研究只观察了NPY/Y1受体信号转导对心肌细胞中经典Wnt 信号通路核心因子β-catenin 表达的影响,后续研究将基于NPY/Y1信号转导影响β-catenin 的机制做进一步探讨,以期为以NPY为靶点的心血管疾病的精准预防和临床诊疗提供理论依据。
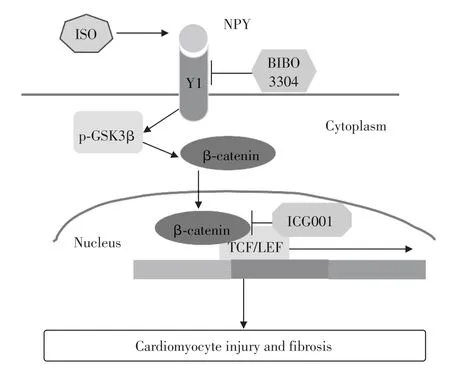
图7 神经肽Y/Y1受体激活β-catenin信号通路介导心肌细胞损伤Figure 7 NPY/Y1 receptor activiation mediates cardiomyocyte injury through β -catenin signaling pathway
