间质性肺疾病合并肺癌的机制及治疗进展
2024-03-13何梦钰解卫平
陈 玲,张 群,何梦钰,解卫平,孔 辉
南京医科大学第一附属医院呼吸与危重症医学科,江苏 南京 210029
间质性肺疾病(interstitial lung disease,ILD)是一组可同时累及肺间质、肺实质,具有异质性的非肿瘤、非感染性肺部疾病。结缔组织疾病相关性ILD、特发性肺纤维化(idiopathic pulmonary fibrosis,IPF)、结节病等是临床常见ILD类型。ILD患者肺癌发生率显著高于一般人群,韩国一项全国性纵向队列研究发现ILD患者肺癌发生率为156.62例/万,为普通人群的3.6 倍,IPF 患者肺癌发生风险更高,为普通人群的8倍[1]。肺癌的手术治疗、放射治疗、化学治疗、免疫治疗及靶向治疗可导致ILD 或原有ILD急性加重(acute exacerbation,AE)。发生AE-ILD的肺癌患者病情重、预后差、病死率高。ILD合并肺癌的治疗极具挑战性,一些阻断两者共同发病机制的药物可能是治疗ILD合并肺癌的有效方法。本文就ILD 合并肺癌的发病机制、治疗风险和治疗进展进行综述。
1 发病机制
ILD与肺癌有共同的危险因素,如吸烟,吸入石棉、二氧化硅等[2]。一些与IPF 相关的基因突变,如SFTPA2、SFTPA1、TERT 等(表1),同样增加肺癌发生风险[3]。SFTPA1、SFTPA2 编码表面活性蛋白A(surfactant protein-A,SP-A),SFTPA1、SFTPA2 突变影响SP-A 分泌[4]。SP-A 能降低肺泡表面张力、调节炎症及免疫,SP-A 缺乏及功能障碍与多种疾病相关[5]。Kim等[6]发现SP-A缺陷加重博来霉素诱导的小鼠肺纤维化,补充外源性SP-A 可逆转肺纤维化。在肺癌中,SP-A参与调节肿瘤巨噬细胞的极化及募集,发挥抗肿瘤作用[5]。
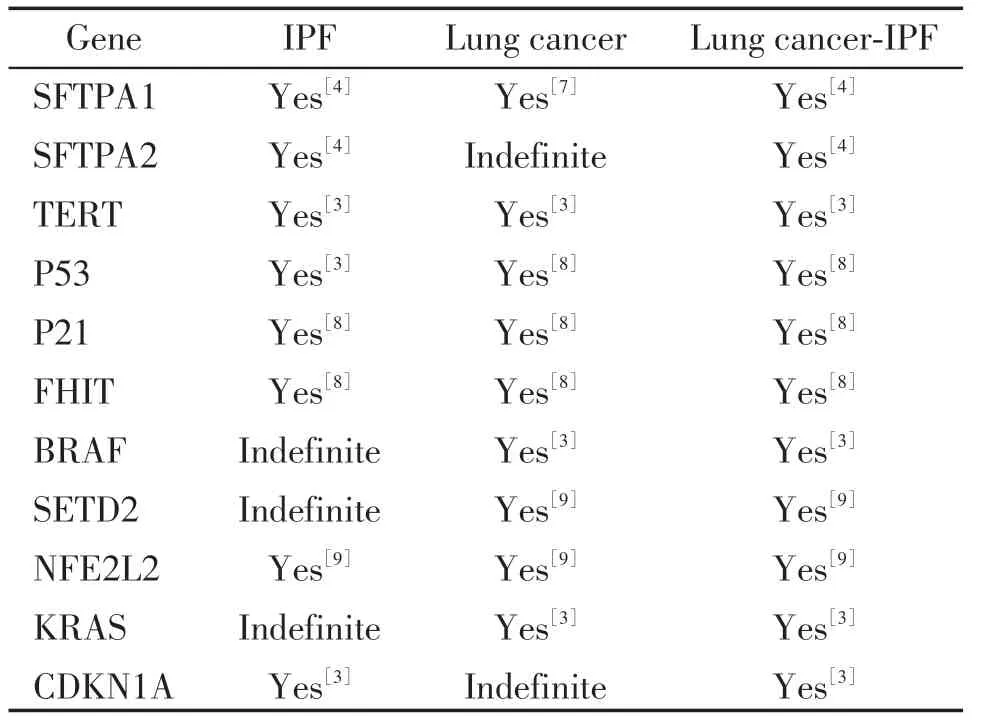
表1 IPF、肺癌、肺癌-IPF相关突变基因Table 1 Mutated genes in IPF,lung cancer,and lung cancer-IPF
肌成纤维细胞同时具有成纤维细胞与平滑肌细胞特征,正常瘢痕修复过程中其可通过细胞凋亡被清除[10]。肺泡上皮细胞急性损伤激活炎症细胞,释放多种细胞因子,如白细胞介素(interleukin,IL)-1β、转化生长因子(transforming growth factor,TGF)-β等,引起成纤维细胞、足细胞、间充质细胞等转化为肌成纤维细胞[10]。肺纤维化疾病中,肌成纤维细胞凋亡减少,处于持续激活状态,过度释放胶原、纤维蛋白原等细胞外基质[10-11]。成纤维细胞是肿瘤间质的主要组分,与癌症相关的成纤维细胞称为癌症相关成纤维细胞(cancer-associated fibroblast,CAF)。CAF 来源于多种细胞,如肌成纤维细胞、星状细胞、间充质转化的上皮细胞与内皮细胞等[12]。肌成纤维细胞与肿瘤细胞接触后分化为CAF,CAF 通过重塑细胞外基质,分泌TGF-β、肝细胞生长因子、基质细胞衍生因子-1 等,促进肿瘤细胞侵袭与转移[12]。细胞外基质的刚度增加可阻碍免疫细胞识别、杀灭肿瘤细胞[13]。CAF还可分泌IL-6等募集肿瘤相关巨噬细胞,诱导其向免疫抑制表型(M2 型)极化,利于肿瘤细胞免疫逃逸[13]。
多种分子及信号通路参与IPF与肺癌的发病过程。TGF-β、血管内皮生长因子(vascular endothelial growth factor,VEGF)、血小板衍生生长因子(platelet derived growth factor,PDGF)及成纤维细胞生长因子(fibroblast growth factor,FGF)、结缔组织生长因子等均在IPF 及肺癌中表达升高[3]。TGF-β、Wnt/βcatenin、shh、Notch、PI3K/AKT 等信号通路为IPF及肺癌常见的下游信号通路[3]。
2 ILD合并肺癌患者的抗肿瘤治疗风险
肺癌的治疗增加ILD及AE-ILD的发生风险,分析肺癌治疗中发生ILD及AE-ILD人群的高危因素,识别、筛查高危人群,可减少肺癌治疗中ILD及AEILD的发生,降低患者病死率,改善患者预后。
2.1 手术治疗
手术治疗相关AE-ILD的发生率为9%~21%,术后发生AE-ILD 的肺癌患者病死率高,为33.3%~100.0%[14]。目前尚缺乏量化ILD合并肺癌患者手术风险的高特异性模型。荟萃分析显示,男性患者、间质性肺炎表型、高血清涎液化糖链抗原-6、高乳酸脱氢酶、白细胞增多、低氧分压、手术范围大、手术时间长均为术后AE-ILD的危险因素[15]。术前肺功能、胸部CT等检查有助于评估肺癌患者术后AE-ILD的风险。Ohsawa 等[14]发现一氧化碳弥散量百分比小于40%的ILD 合并肺癌患者术后易出现严重并发症。术前CT中磨玻璃结节范围、肺实变范围及肺动脉干直径是肺癌患者术后发生AE-ILD的独立预测因子,基于术前CT特征构建的模型可预测术后AE-ILD的发生风险[16]。
2.2 放射治疗
体部立体定向放射治疗(stereotactic body radiotherapy,SBRT)被推荐用于不适合手术的早期非小细胞肺癌(non-small cell lung cancer,NSCLC),放射性肺损伤是其常见并发症,主要包括放射性肺炎和放射性肺纤维化。研究发现,2级以上(常见不良事件评价标准CTCAE分级)放射性肺损伤发生率约为9.1%,年龄、肿瘤体积、肿瘤分期、平均肺剂量、V20(接受>20 Gy 照射的肺体积)是发生严重放射性肺损伤的危险因素[17]。ILD 增加放射性肺损伤的发生风险,接受SBRT 的ILD 患者发生2 级和3 级以上放射性肺损伤的风险分别是无ILD 患者的3.5 倍和10.3 倍[18]。对于替代选择较少,希望行根治性治疗的患者,可考虑谨慎行SBRT 治疗,但需尽量避免肺毒性,如限制剂量、隔日治疗等[19]。
2.3 化学治疗
化学治疗是肺癌合并ILD 患者的有效治疗手段。研究发现,与单纯小细胞肺癌患者相比,小细胞肺癌合并ILD患者接受化学治疗后的疾病缓解率、无进展生存期、总生存期差异无统计学意义[20]。尽管化疗相关AE-ILD不常见,但其仍是肺癌治疗中潜在的致命并发症,有必要对准备行化疗的肺癌合并ILD患者进行充分评估。胸部CT表现为普通型ILD的患者,化疗更易发生AE-ILD(30%vs.8%,P=0.005)[21]。不同化疗方案的AE-ILD 发生风险存在差异,含铂的化疗方案AE 发生率小于非铂类方案(10.3%vs.26.5%),其中顺铂、卡铂、依托泊苷、紫杉醇、长春瑞宾、多西他赛、吉西他滨、长春地辛相关AE-ILD 发病率分别为16.5%、8.0%、5.6%、12.3%、19.6%,31.6%、16.7%、5.9%[22]。
2.4 靶向治疗
表皮生长因子受体(epidermal growth factor receptor,EGFR)是NSCLC 最常见的突变,EGFR-酪氨酸激酶抑制剂(tyrosine kinase inhibitors,TKI)相关ILD 发生率为0~5.7%[23]。男性、吸烟、IPF、肺功能差、放疗、低血清球蛋白是靶向治疗中诱发AE-ILD的危险因素[24]。EGFR-TKI 联合其他治疗方案可增加ILD 及AE-ILD 的发生风险。吉非替尼单药治疗时AE-ILD发病率为0.6%,而联合卡铂、培美曲塞治疗时AE-ILD 发病率为2.4%[25]。EGFR-TKI 与放射治疗联用可增加放射性肺炎发生风险,联用时间大于20 d 是2 级以上放射性肺损伤的独立预测因素[26]。目前接受靶向治疗的ILD合并肺癌患者研究较少,需进一步评估靶向治疗对ILD 合并肺癌患者的相关风险及开发相关模型筛选ILD合并肺癌靶向治疗的人群。
2.5 免疫治疗
免疫检查点抑制剂(immune checkpoint inhibitors,ICI)是目前部分晚期NSCLC 的一线治疗方案。一项荟萃分析研究显示,与未合并ILD 的肺癌患者相比,合并ILD 的肺癌患者ICI 相关肺炎发病率更高,但通常病情较轻,易于控制,两者客观缓解率及疾病控制率差异无统计学意义[27]。而另一项荟萃分析发现合并ILD 的NSCLC 患者3 级以上ICI 相关肺炎发生率高达12%,ICI用于一线及二线以上治疗时合并ILD 患者的客观缓解率分别为67%和26%,作者认为合并ILD的患者应慎用ICI,二线以上应用ICI 时可能风险大于获益[28]。ILD、哮喘、COPD、放疗、联合治疗、鳞癌、肺功能差、呼吸困难、肺部感染是ICI相关ILD的危险因素,程序性死亡受体-1(programmed death receptor-1,PD-1)抑制剂治疗较程序性死亡配体-1(programmed death receptor ligand-1,PD-L1)抑制剂治疗的ILD发生风险高[29]。
3 ILD合并肺癌患者的“双靶”治疗进展
ILD合并肺癌的治疗具有挑战性,肺癌手术、放化疗、靶向及免疫治疗均可导致ILD及AE-ILD。鉴于肺癌与ILD 存在相似的突变基因、细胞活动过程、生长因子、信号通路等,阻断肺癌及ILD 共同发病机制的药物可同时治疗肺癌及ILD,具有良好应用前景。
3.1 靶向TGF-β信号通路
TGF-β功能障碍与纤维化、肿瘤等疾病密切相关。TGF-β促进成纤维细胞、上皮细胞、周细胞等转化为肌成纤维细胞,调节细胞外基质重塑,发挥促纤维化作用[30]。肿瘤发展早期阶段,TGF-β诱导细胞周期停滞及细胞凋亡发挥抗肿瘤作用,当癌基因激活和/或抑癌基因失活后,肿瘤细胞对TGF-β诱导的抗肿瘤作用不敏感,出现不可控地增殖[31]。TGF-β诱导肿瘤细胞发生上皮-间充质转化,促进肿瘤细胞侵袭、转移[12]。TGF-β激活CAF,刺激血管生成,促进细胞因子分泌、细胞外基质沉积,抑制免疫细胞,参与构建肿瘤微环境[31]。多种靶向TGF-β信号通路的药物被研发应用于肿瘤或纤维化疾病中,目前部分药物已进入临床前及临床研究阶段,如Fresolimumab(GC1008)、Galunisertib(LY2157299)、Vactosertib(TEW-7197)、Trabedersen(AP12009)等[32]。吡非尼酮是一种TGF-β1及其他生长因子抑制剂,具有抗炎、抗纤维化等作用,被用于治疗IPF[33]。吡非尼酮还具有抗肿瘤作用,可抑制免疫功能正常荷瘤小鼠的肿瘤生长,其机制可能与增加细胞毒性T 淋巴细胞、减少髓系抑制性细胞,激活抗肿瘤免疫反应有关[34]。吡非尼酮联合手术、放化疗、免疫治疗等具有治疗ILD合并肺癌的前景。吡非尼酮可预防术后AE-IPF的发生,研究发现与仅接受手术的肺癌患者相比,术前口服吡非尼酮者术后30 d(10.5%vs.0%)及90 d(21.1%vs.3.2%)AE-IPF发生率显著降低[35]。动物模型研究发现,放射治疗后接受吡非尼酮的小鼠肺组织胶原蛋白沉积及纤维化程度更轻,存活时间更长,死亡率更低,因此吡非尼酮可能改善放射性肺损伤[36]。体外研究发现,吡非尼酮还可增加肺癌细胞对紫杉醇或紫杉醇+卡铂的敏感性,包括抑制细胞增殖,促进细胞凋亡,且吡非尼酮联合紫杉醇或紫杉醇+卡铂对非肿瘤细胞无明显细胞毒性作用[37]。一项纳入14 例肺癌合并IPF 的队列研究发现,吡非尼酮联合基于卡铂化学治疗或ICI 治疗的1 年内AE-IPF 累积发生率为18%,吡非尼酮可能对合并IPF 的NSCLC 患者化疗相关AE-IPF 具有预防作用[38]。Qin等[34]发现,吡非尼酮联合PD-L1抑制剂具有协同抗肿瘤作用,且联合PD-L1抑制剂可同时抑制肿瘤生长及减轻博来霉素诱导的小鼠肺纤维化。
3.2 靶向血管生成相关因子及其受体
VEGF、PDGF、FGF 具有促血管生成作用。VEGF-A为VEGF超家族中研究最广泛的因子,参与调节内皮细胞增殖、迁移及血管通透性等[39-40]。研究发现VEGF-A 异构体在肺纤维化中具有不同作用,如VEGF-A165a 可促进Ⅱ型肺泡上皮、内皮细胞、成纤维细胞增殖,增加细胞外基质分泌,而VEGFA165b 拮抗VEGF-A165a 的效应[41]。贝伐珠单抗是抗VEGF 抗体,一项纳入13 项研究的荟萃分析发现联合贝伐珠单抗组ILD 发生率显著低于单纯靶向治疗组,但贝伐珠单抗联合化疗并未显著降低ILD 发生率[42]。贝伐珠单抗可抑制ICI药物引起的小鼠肺间质T淋巴细胞浸润、肺血管通透性增高,减轻肺部炎症反应[43]。
尼达尼布是一种小分子TKI,靶向PDGFR、VEGFR、FGFR 等,被多个指南推荐用于治疗IPF 或进展性肺纤维化[44]。尼达尼布抑制T 淋巴细胞、单核细胞释放IL-2、IL-4、IL-5等炎症介质,阻碍成纤维细胞增殖、迁移、转化,减少细胞外基质异常沉积,发挥抗纤维化作用[45]。血管生成与肿瘤生长、侵袭、转移密切相关,尼达尼布阻断PDGFR、VEGFR、FGFR等促血管生成受体,抑制血管生成,发挥抗肿瘤作用[46]。结合尼达尼布的抗肿瘤及抗纤维化作用,其可能用于治疗ILD 合并肺癌或肺癌治疗相关肺纤维化。陆续有尼达尼布治疗IPF合并NSCLC的病例报道,Shiratori 等[47]报道了1 例三线化疗失败、合并IPF 的晚期NSCLC 患者,尼达尼布治疗后肿瘤病灶得到部分缓解。尼达尼布可能治疗放射性肺炎,研究发现尼达尼布+泼尼松治疗组放射性肺炎患者1年无进展生存率显著高于单纯泼尼松治疗组(72%vs.40%,P=0.037)[48]。一项Ⅲ期临床试验显示,接受尼达尼布联合化疗(卡铂+白蛋白结合型紫杉醇)治疗的晚期NSCLC患者较单纯化疗患者有更长的无事件生存期,尼达尼布联合化疗可提高非鳞癌NSCLC患者的总生存期[49]。尼达尼布治疗EGFR-TKI 相关ILD 也有报道,Fang 等[50]报道1 例发生奥希替尼相关ILD的肺腺癌患者接受尼达尼布治疗后症状及胸部CT表现较前明显改善。动物模型显示,尼达尼布联合PD-L1抑制剂可通过抑制肿瘤细胞增殖、促进肿瘤细胞凋亡,抑制血管新生、促进血管正常化,增加免疫细胞浸润,激活肿瘤免疫微环境等发挥抗肿瘤、抗肿瘤转移、抗纤维化作用[51]。
4 小结与展望
ILD 及肺癌可相伴出现,ILD 增加肺癌风险,是肺癌治疗过程中少见而致命的并发症。肺癌及ILD存在共同的危险因素及相似的发病机制。成纤维细胞、TGF-β、血管生成相关信号通路等在肺癌及肺纤维化的发生、发展中起重要作用。目前靶向肺癌及ILD共同发病机制的药物正处于开发阶段。一些同时具有抗纤维化及抗肿瘤作用的药物,如吡非尼酮、尼达尼布,在ILD合并肺癌中展现出良好的治疗前景。但目前吡非尼酮、尼达尼布对ILD 合并肺癌患者的治疗效果尚需更多临床研究进一步验证。未来可能有更多阻断ILD及肺癌共同发病机制的药物被研发、应用,以降低ILD 合并肺癌患者的病死率,改善预后。
