泥鳅抗菌肽制备及其抑制致鳗弧菌作用
2024-03-13窦宝杰丁闻卢静郭全友吕明生王淑军
窦宝杰,丁闻,卢静 ,郭全友,吕明生 ,王淑军
(1.江苏海洋大学 江苏省海洋生物资源与环境重点实验室,江苏 连云港 222005;2.江苏海洋大学 江苏省海洋生物技术重点实验室,江苏 连云港 222005;3.中国水产科学院 东海水产研究所,上海 200090)
泥鳅(Misgurnusanguillicaudatus)属于鲤形目鳅科,在亚洲广泛分布[1]。泥鳅富含优质蛋白质、透明质酸、多糖、维生素、矿物质和必需氨基酸,具有极高的营养价值和食用价值[2-3]。泥鳅脂肪和胆固醇含量低,属高蛋白低脂肪食品,是潜在的优质动物蛋白资源[2]。目前,市场上泥鳅加工产品仍以直接加工为主,如泥鳅干、麻辣泥鳅、泥鳅粉等[4],其精深加工技术和应用亟需研究。
抗菌肽主要来源于植物和动物的提取以及微生物发酵,分子量多分布在2~7 kDa[5-7]。与传统抗生素相比,抗菌肽具有抗菌能力强、抗菌谱广、不易产生耐药性等特点[5]。目前的研究发现,抗菌肽的作用机理主要是破坏细菌膜结构,导致菌体死亡[8]。对于泥鳅源抗菌肽的研究,裴颖等[9]使用Tris-HCl 法对泥鳅中的抗菌肽进行提取,发现其对嗜水气单胞菌、大肠杆菌、金黄色葡萄球菌抑菌效果明显。通过酶法生产的抗菌肽具有安全性高、酶解过程易于控制、生产得率高等优点[8]。然而,使用酶解法提取泥鳅抗菌肽的研究相对较少,值得进一步研究。
本文以泥鳅为原料,选用5 种蛋白酶对其进行酶解,并对酶解产物进行初步超滤纯化,制备出具有抑制致病菌作用的抗菌肽,初步探索其抗菌机制,以期为泥鳅的精深加工提供参考。
1 材料与方法
1.1 材料与试剂
泥鳅(M.anguillicaudatus):连云港金水湾食品有限公司;胰蛋白酶(20 万U/g)、中性蛋白酶(20 万U/g)、碱性蛋白酶(20 万U/g):宁夏和氏璧生物技术有限公司;酸性蛋白酶(20 万U/g)、木瓜蛋白酶(20 万U/g):南京庞博生物工程有限公司;金黄色葡萄球菌、大肠杆菌、副溶血性弧菌(Vibrioparahaemolyticus)、哈维氏弧菌(Vibrioharveyi)、鳗弧菌(Vibrioanguillarum)、温和水气单胞菌(Aeromonastemperate)、嗜水气单胞菌(Aeromonashydrophila):江苏省海洋生物资源与环境重点实验室保藏;2,2-二苯基-1-苦基肼(2,2-diphenyl-1-picrylhydrazyl,DPPH):美国Sigma 公司。
1.2 仪器与设备
5804R 高速冷冻离心机:艾本德(中国)有限公司;ALPH4 真空冷冻干燥机:江苏海企国际股份有限公司;THZ-103B 恒温培养摇床、DK-8D 恒温水浴锅:上海一恒科学仪器有限公司;Multiskan FC 全波长酶标仪:美国Thermo fisher 公司;BPX-52 生化培养箱:上海博迅实业有限公司;JSMIT-800 扫描电镜:日本东京JEOL 公司。
1.3 方法
1.3.1 泥鳅肉糜的酶解与纯化
1.3.1.1 泥鳅肉糜的酶解
利用胰蛋白酶、酸性蛋白酶、木瓜蛋白酶、中性蛋白酶、碱性蛋白酶5 种蛋白酶,以泥鳅肉糜为底物,底物质量分数为30%(即30 g 肉糜中加入70 mL 水制成匀浆),每克肉糜中添加900 U 蛋白酶,在一定条件下酶解4 h,沸水浴中灭酶15 min,冷却后4 ℃下4 000 r/min离心20 min,取上清液[10-12]。胰蛋白酶、酸性蛋白酶、木瓜蛋白酶、中性蛋白酶、碱性蛋白酶酶解产物分别命名为Y、S、M、Z、J。具体酶解条件见表1。

表1 不同蛋白酶的酶解条件Table 1 Enzymatic hydrolysis conditions of different proteases
1.3.1.2 酶解产物的纯化
将Y、S、M、Z、J 先使用0.45 μm 滤膜过滤,去除其中大分子杂蛋白。随后利用超滤装置对抽滤得到的液体进行分离纯化。经5 kDa 和10 kDa 的超滤膜超滤,每种泥鳅酶解产物获得3 种组分,即<5 kDa、5~10 k Da、>10 kDa,依次标记为Y1、Y2、Y3,S1、S2、S3,M1、M2、M3,Z1、Z2、Z3,J1、J2、J3。对各组分进行冷冻干燥用于后续试验。
1.3.2 酶解产物的抗菌活性
以大肠杆菌和金黄色葡萄球菌为受试菌,测定菌液的光密度值(OD600nm)以比较产物的抗菌活性。在无菌试管中加入酶解产物与5 mL 液体培养基,接种200 μL 菌悬液(菌浓度1×104CFU/mL),以不加酶解产物作为对照,充分混匀,将试管放入37 ℃恒温培养摇床中培养20 h 后,测定OD600nm[13-15]。
1.3.3 酶解产物的抗致病菌活性
1.3.3.1 不同组分抗致病菌的活性
方法同1.3.2,分别测定泥鳅木瓜蛋白酶酶解产物M、M1、M2、M3 对常见病原菌哈维氏弧菌、鳗弧菌、温和水气单胞菌、嗜水气单胞菌、副溶血性弧菌的抑菌作用。抑菌率(X,%)的计算公式如下。
式中:An 为试验组的吸光度;An0为对照组吸光度;A0为空白组吸光度。
1.3.3.2 不同浓度M1 抑制鳗弧菌的活性
将M1 梯度稀释,测定其对鳗弧菌的抗菌活性,计算出IC50值。
1.3.4 M1 抗氧化活性的测定
1.3.4.1 DPPH 自由基清除作用
将M1 稀释成不同浓度梯度,将0.2 mL 酶解产物M1 与0.2 mL 的DPPH(0.1 mmol/L)依次加入,置于暗处,30 min 后测量OD517nm[16-17]。DPPH 自由基清除率计算公式如下。
式中:Y为DPPH 自由基清除率,%;Ax 为DPPH与M1 反应的吸光度;Ax0为乙醇与M1 反应的吸光度;A0为DPPH 与水的吸光度。
1.3.4.2 羟自由基清除作用
将M1 稀释成不同浓度梯度,将0.1 mL 酶解产物M1、0.1 mL 9 mmol/L FeSO4、0.1 mL 9 mmol/L 水杨酸(无水乙醇溶液)、0.1 mL H2O2混合,37 ℃水浴15 min,测量OD510nm[16-17]。羟自由基清除率计算公式如下。
式中:W为羟自由基清除率,%;Ax 为样品的吸光度;Ax0为空白试剂的吸光度;A0为不含样品的对照的吸光度。
1.3.4.3 超氧阴离子自由基清除活性
将M1 稀释成不同浓度梯度,将0.2 mL M1 与1 mL Tris-HCl(50 mmol/L)混合,25 ℃温育10 min,立即加入30 μL 邻苯三酚(6 mmol/L),室温放置30 min,测量OD320nm。 超纯水和VC分别作空白对照和阳性对照[16-17]。超氧阴离子自由基清除率计算公式如下。
式中:Z为超氧阴离子自由基清除率,%;Ax 为M1+Tris-HCl+邻苯三酚的吸光度;Ax0为M1+Tris-HCl+HCl 的吸光度;A0为水+Tris-HCl+邻苯三酚吸光度。
1.3.4.4 还原力测定
将M1 稀释成不同浓度梯度,将0.2 mL M1、0.2 mL磷酸盐缓冲溶液(0.2 mol/L,pH6.6)和0.2 mL 的1% 铁氰化钾混合,50 ℃孵育20 min,然后加入0.2 mL 10%三氯乙酸,混合后5 000 r/min 离心10 min。将0.5 mL上清液、2.5 mL 蒸馏水与0.1 mL 的氯化铁混合,测量OD700nm,超纯水和VC作参照[16-17]。
1.3.5 M1 抗菌机理研究
1.3.5.1 M1 对鳗弧菌生物膜的作用
将24 孔板每孔添加新鲜的LB 培养基1 mL,40 μL菌液,加入M1 以达到不同浓度,37 ℃静置培养24 h。弃掉培养液,磷酸盐缓冲液(phosphate buffered saline,PBS)轻洗3 次,每孔加入0.1% 结晶紫溶液1 mL,染色20 min。倒出染色液,用去离子水冲洗3 遍。于45 ℃烘箱干燥,加入95% 乙醇脱色3 min,将脱色液移入96孔板,测定OD570nm[18-19]。
电镜检测菌体的生物膜:将24 孔板中一孔添加新鲜的LB 培养基2 mL,100 μL 菌液,加入M1 使之浓度达到IC50值,放入无菌玻璃片,37 ℃培养24 h。以不加入M1 为对照。待生物被膜形成后,弃去培养液,用PBS 冲洗3 次,风干,向孔板中加入2 mL 2.5% 戊二醛固定生物膜。再分别用30%、50%、70%、80%、90%、100% 乙醇脱水10 min,喷金后电镜观察[20]。
1.3.5.2 M1 抑制致病菌细胞膜的作用
通过测量细胞成分的释放(OD260nm)来测定细胞膜的完整性。首先将鳗弧菌培养至对数期,然后5 000 r/min离心5 min。用0.1 mol/L PBS(pH7.4)洗涤沉淀3 次,与不同浓度样品在37 ℃培养4 h,在260 nm 测定释放的核酸[21]。
1.4 数据的统计分析
所有试验均设3 个平行样,数据以平均值±标准差表示。采用Origin 2018 制图,SPSS Statistics 26 对数据的差异性进行分析。
2 结果与讨论
2.1 蛋白酶对酶解产物抗菌活性的影响
图1、图2 为经不同蛋白酶酶解后,泥鳅酶解产物对大肠杆菌与金黄色葡萄球菌活性的影响。

图1 泥鳅酶解产物对大肠杆菌的抑制活性Fig.1 Inhibitory activity of enzymatic hydrolysates of Misgurnus anguillicaudatus on Escherichia coli

图2 泥鳅酶解产物对金黄色葡萄球菌抑制活性Fig.2 Inhibitory activity of enzymatic hydrolysates of Misgurnus anguillicaudatus on Staphylococcus aureus
由图1 可以看出,泥鳅蛋白酶酶解产物各组分对大肠杆菌抑制活性差异明显。其中,添加木瓜蛋白酶酶解产物组分M1 的OD 值最低,说明M1 抑制大肠杆菌活性作用最强。图2 显示添加酸性蛋白酶酶解产物组分S1 和木瓜蛋白酶酶解产物组分M1 的OD 值低于其他组分,说明这2 个组分抑制金黄色葡萄球菌活性高于其他组分。经过超滤后分子量小于5 kDa 的酶解产物抑制大肠杆菌和金黄色葡萄球菌活性更强,这与王蕾[22]的结果相似。研究发现从泥鳅中提取的抗菌肽能够杀死大部分革兰阳性菌,部分革兰阴性菌[23]。研究表明,不同浓度的泥鳅肽可对多种细菌产生抑制作用[24]。酶解产物抗菌活性的强弱与选用的蛋白酶有关[25]。吴林泽等[26]发现,使用碱性蛋白酶酶解的罗非鱼下脚料粗肽对金黄色葡萄球菌的抗菌效果好。虽然这5 种蛋白酶都具有制备抗菌肽的潜力,但不同蛋白酶对蛋白的酶切位点不同,其产生的抗菌肽的数量与质量也不同。根据效果,选用木瓜蛋白酶进行后续研究。
2.2 泥鳅木瓜蛋白酶酶解产物对致病菌的抑制作用
泥鳅木瓜蛋白酶酶解产物各组分对致病菌的抑制作用见表2。

表2 泥鳅木瓜蛋白酶酶解产物各组分对致病菌的抑制作用Table 2 Inhibitory effects of various components of enzymatic hydrolysates of papain of Misgurnus anguillicaudatus on pathogenic bacteria
由表2 可知,在泥鳅木瓜蛋白酶酶解产物中,分子量越小其抗菌效果越强。其中M1 对常见水产动物致病菌嗜水气单胞菌、鳗弧菌、哈维氏弧菌、温和水气单胞菌、副溶血性弧菌均具有一定的抑制作用。M1 对不同致病菌的抗菌效果不同,对鳗弧菌的抑菌活性更强,具体结果见图3。

图3 泥鳅多肽M1 抑制鳗弧菌活性Fig.3 Inhibitory activity of polypeptide M1 from Misgurnus anguillicaudatus on Vibrio anguillarum
由图3 可知,随着M1 浓度的增加,对鳗弧菌抑制活性增加。通过计算,其IC50值为15.76 mg/mL。杨富敏[27]利用碱性蛋白酶酶解扇贝裙边,其产物分子量集中在1~3 kDa,可以抑制大肠杆菌和金黄色葡萄球菌的生长。康丹丹等[28]通过木瓜蛋白酶制备多肽,其对金黄色葡萄球菌、单增李斯特菌和化脓性链球菌的最低抑制浓度(minimum inhibitory concentration,MIC)分别为5、10、2.5 mg/mL。王碧超[29]以金枪鱼骨头制备的胶原基抗菌肽,其抑制大肠杆菌MIC 和最小杀菌浓度(minimum bactericidal concentration,MBC)值分别为4 mg/mL 和8 mg/mL。结果表明,泥鳅酶解多肽M1 具有一定抗菌作用。
2.3 泥鳅多肽M1 的抗氧化活性
泥鳅多肽M1 的抗氧化活性见图4~图7。
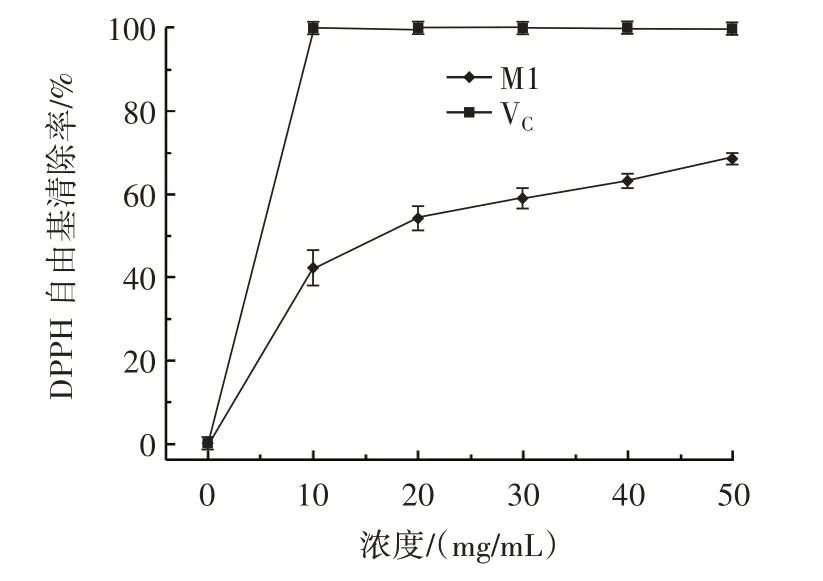
图4 泥鳅多肽M1 的DPPH 自由基清除活性Fig.4 DPPH scavenging activity of polypeptide M1 from Misgurnus anguillicaudatus

图5 泥鳅多肽M1 的羟自由基清除活性Fig.5 Hydroxyl radical scavenging activity of polypeptide M1 from Misgurnus anguillicaudatus

图6 泥鳅多肽M1 的超氧阴离子自由基清除活性Fig.6 Superoxide radical scavenging activity of polypeptide M1 from Misgurnus anguillicaudatus

图7 泥鳅多肽M1 的还原力Fig.7 Reducing activity of polypeptide M1 from Misgurnus anguillicaudatus
由图4 可知,当M1 浓度达到20 mg/mL,其DPPH自由基清除率超过50%。DPPH 自由基是一种相对稳定的脂质自由基,加入抗氧化剂后能够抑制自由基的氧化[30]。常雷[31]利用蛋白酶酶解蟾蜍皮获得抗氧化肽和抗菌肽,其DPPH 自由基清除活性IC50值分别为2.24 mg/mL 和1.004 mg/mL。由图5 可知,M1 羟自由基清除活性较好,通过计算其IC50值为5.43 mg/mL。一般认为某种物质的IC50低于10.0 mg/mL 时,说明其具有良好的抗氧化性[30-31]。由图6 可知,当M1 浓度为2 mg/mL 时,其超氧阴离子自由基活性达到43.58%,其IC50值7.33 mg/mL,说明其具有良好的超氧阴离子自由基清除活性。由图7 可知,随着M1 浓度的提升,其吸光度不断提升。当M1 浓度为2 mg/mL,其吸光度为0.18,说明M1 具有良好的还原力。研究表明,分子量较小的肽,具有更强的抗氧化活性,并且多肽中疏水性氨基酸的比例越高其抗氧化活性越强[32]。Zhi 等[33]研究发现扇贝蛋白质酶解物中低分子量的组分具有更强的氧自由基吸收能力。综上,泥鳅蛋白经过蛋白酶酶解后形成的小分子多肽具有较好的抗氧化性。
2.4 泥鳅多肽M1 的抗菌机理
2.4.1 M1 对鳗弧菌生物膜的抑制作用
M1 对鳗弧菌生物膜的抑制作用见图8,鳗弧菌生物被膜电镜图见图9。
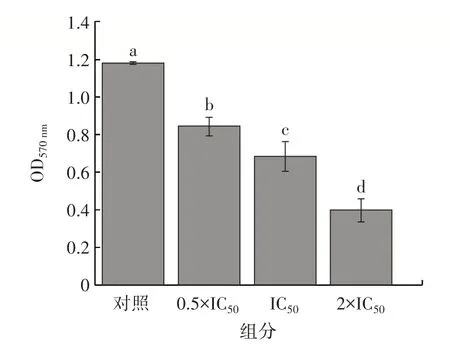
图8 M1 对鳗弧菌生物膜的抑制作用Fig.8 Inhibitory effect of M1 on biofilm of Vibrio anguillarum

图9 鳗弧菌生物被膜电镜图Fig.9 Scanning electron micrograph of biofilm of Vibrio anguillarum
由图8 可知,随着M1 浓度的提升,染色液的OD值显著降低,M1 对鳗弧菌生物膜的形成具有抑制作用。生物被膜是微生物黏附于介质的表面,通过分泌的胞外基质包裹而形成的三维网状结构,是微生物在环境中定植的物质基础[34]。抑制生物膜的形成可以减少细菌的黏附和聚集,从而抑制鳗弧菌的感染。
如图9 所示,未经M1 处理的玻片中,鳗弧菌菌体密集集中的黏附在玻片的表面,相互堆叠,结构紧密,互相连结,显示了菌株良好的生物膜形成能力。相反,经过M1 处理后(图9c、图9d)鳗弧菌之间稀疏和松散,形成孔隙,表明生物被膜的形成受到了影响。这与赵洋等[20]获得的结果相似。结果表明,泥鳅多肽M1使鳗弧菌的生长受到抑制,可以明显减少鳗弧菌生物膜的形成。
2.4.2 M1 对鳗弧菌细胞膜完整性的作用
M1 对鳗弧菌细胞膜完整性的作用见图10。

图10 M1 对鳗弧菌细胞膜完整性的作用Fig.10 Effect of M1 on cell membrane integrity of Vibrio anguillarum
由图10 可知,当M1 浓度高于IC50的50% 时,检测到细胞内容物的释放量(OD260nm)显著增加,说明泥鳅多肽M1 对鳗弧菌的细胞膜具有损伤作用。此外,经过M1 处理后(图9c、图9d),鳗弧菌表面更加粗糙,并且部分鳗弧菌表面发生皱缩,形态发生改变,这说明鳗弧菌细胞膜出现了损伤。相反,未经M1 处理的鳗弧菌(图9a、图9b)生长状态良好,未出现明显的形态变化。研究表明,抗菌肽会与菌体细胞的膜蛋白结合,抑制菌体的新陈代谢,导致菌体死亡裂解[35]。抗菌肽会提高膜的渗透性并破坏细胞膜结构,从而使核酸、蛋白质和其他细胞成分渗漏[36]。胡平等[37]研究发现蛴螬多肽Probrelin 会影响白色念珠菌细胞膜的完整性,从而抑制白色念珠菌的生长。推测M1 通过与鳗弧菌细胞膜的相互作用,使细菌的细胞膜产生缺陷,导致细菌控制物质进出困难,进而使得细菌破裂,导致细胞内容物溢出。
3 结论
以连云港泥鳅为原料,每克肉糜中添加900 U 木瓜蛋白酶,在55 ℃条件下酶解4 h。经过超滤分离,分子量小于5 kDa 酶解产物M1 对多种病原菌的生长具有抑制作用,其对鳗弧菌的抗菌效果最好,抑制鳗弧菌的IC50值为15.76 mg/mL。泥鳅多肽M1 具有清除DPPH自由基、羟自由基和超氧阴离子自由基的作用,抗氧化活性较好。M1 可以明显抑制鳗弧菌的生物膜的形成,破坏鳗弧菌的细胞膜,引起鳗弧菌形态的改变,导致细胞内容物的流出。本研究为进一步开发泥鳅多肽、发现更多天然抗菌物质、提高泥鳅的经济价值提供参考。
