铬元素在蛹虫草中的富集及机理
2024-03-13何茜刘阳徐方旭王泽柳叶飞
何茜,刘阳,徐方旭 ,王泽,5,柳叶飞,6
(1.沈阳师范大学 生命科学学院,辽宁 沈阳 110034;2.沈阳师范大学粮食学院,辽宁 沈阳 110034;3.沈阳师范大学 实验教学中心,辽宁 沈阳 110034;4.辽宁省功能性蛹虫草重点实验室,辽宁 沈阳 110034;5.沈阳市功能性蛹虫草产业技术研究院,辽宁 沈阳 110034;6.辽宁省蛹虫草种质资源库,辽宁 沈阳 110034)
蛹虫草(Cordycepsmilitaris),又名北冬虫夏草、虫草花,属子囊菌门、核菌纲、麦角菌目、麦角菌科、虫草属,为该属的模式种之一[1-4]。作为“新资源食品”,蛹虫草的药理作用与冬虫夏草极为相似,其药用成分虫草酸、虫草多糖、虫草素含量及超氧化物歧化酶(superoxide dismutase,SOD)活性等均高于冬虫夏草,具有抗肿瘤、抗疲劳、降血糖、抗衰老、提高免疫力等功效[5]。
糖尿病是一种慢性疾病,长期服用降糖药可引起食欲改变、血小板减少、乳酸蓄积、肾功能损害、维生素B12吸收受阻等,甚至会导致巨幼红细胞性贫血和心脑血管疾病[6-7]。铬是葡萄糖耐量因子的重要组成成分,作为胰岛素增强剂,铬对维持人体内正常的糖代谢起关键作用[8-9]。研究表明,Cr3+在人体中含量极少[10-13],而无机铬对人体的毒性较大,有机铬安全性相对较高[14-17],且易被人体吸收,具有缓解应激[18-19]、增强免疫力、改善胴体品质等作用[20-21]。
基于以上背景,本研究以蛹虫草子实体为载体,富集人体必需的微量元素铬,探讨蛹虫草的耐铬能力和富铬作用,以及铬元素对蛹虫草产量和品质的影响,并借助转录组学技术筛选出富铬蛹虫草的差异基因,找到差异基因参与的代谢通路,旨在阐明蛹虫草富集铬元素的分子机理,为糖尿病替代治疗提供新的思路。
1 材料与方法
1.1 材料与试剂
蛹虫草PT07:沈阳师范大学特种菌业研究所栽培,-80 ℃冰箱储存;吡啶甲酸铬(纯度:99.9%):陕西源倍春生物科技有限公司;马铃薯:市售;葡萄糖、琼脂粉、蛋白胨、磷酸二氢钾、硫酸镁(均为分析纯):北京鼎国昌盛生物技术有限责任公司;总RNA 提取试剂RNAiso Plus、PrimesoriptTMRT reagent kit with DNA Eraser 试剂盒:宝生物工程(大连)有限公司;脱氧核糖核酸酶I:北京凡知医学科技有限公司;NEB Next Ultra RNA 文库制备试剂盒:美国NEB 公司;Oligo(dT)磁珠:苏州海狸生物医学工程有限公司;裂解缓冲液:上海恒斐生物科技有限公司。
1.2 仪器与设备
ESJ-182 电子天平:沈阳龙腾电子有限公司;LDZX-50KBS 立式压力蒸汽灭菌锅:上海申安医疗器械厂;Illumina HiSeq 4000 高通量测序平台系统:武汉基诺赛克科技有限公司;Agilent 2100 生物分析仪:美国安捷伦科技有限公司。
1.3 方法
1.3.1 培养基的制备
马铃薯葡萄糖固体培养基(potato dextrose agar,PDA):马铃薯200 g、葡萄糖20 g、琼脂粉20 g、蛋白胨3 g、磷酸二氢钾2 g、硫酸镁1 g、去离子水1 000 mL,于121 ℃条件下灭菌30 min。
马铃薯葡萄糖液体培养基(potato dextrose broth,PDB):马铃薯200 g、葡萄糖20 g、蛋白胨3 g、磷酸二氢钾2 g、硫酸镁1 g、去离子水1 000 mL,于121 ℃条件下灭菌30 min。
栽培培养基:小麦40 g,去离子水或铬溶液60 mL,于121 ℃条件下灭菌30 min。
1.3.2 液体发酵培养
在配制好的PDB 培养基中添加吡啶甲酸铬,使铬元素的添加浓度分别为0、50、100、150、200、300、400、500、600、700、800、900、1 000 μg/mL,装液量为100/250(mL/mL),于121 ℃条件下灭菌40 min,冷却至常温后接种,接种量为10%。在22 ℃条件下130 r/min振荡培养7 d,每个试验组设5 个重复。
将发酵后的培养液于4 000 r/min 离心15 min 后过滤获得菌丝体,用去离子水洗涤3 次,充分洗去附带的培养基成分,冲洗过的菌丝体于60 ℃烘干至恒重,测定菌丝体生物量。
1.3.3 固体平板培养
根据液体发酵培养结果,将活化的蛹虫草菌株接种于铬元素含量分别为200、400、600、800 μg/mL 灭菌后的PDA 平皿培养基中心,以未添加铬元素作为对照组,每个试验组设5 个重复,于22 ℃真菌培养箱中培养7 d 后,测量菌落直径。
根据GB 5009.268—2016《食品安全国家标准食品中多元素的测定》[22]测定蛹虫草菌丝体中铬元素含量,富铬率(G,%)计算公式如下。
式中:m为菌丝体中铬元素含量,mg/kg;C为菌丝体生物量,g/100 mL;M为培养基中铬元素添加浓度,μg/mL。
1.3.4 铬元素对蛹虫草产量及品质的影响
以加去离子水为空白对照组,添加不同浓度的铬溶液作为试验组(铬元素添加浓度分别为200、400、600、800 μg/mL)。使用直尺测量直径(cm)、高度(cm),按如下公式计算生物转化率(T,%)、污染率(R,%)。
式中:n为蛹虫草子实体干重,g;N为小麦培养基干重,g;s为组内污染盒数;S为组内总盒数。
1.3.5 总RNA 提取和转录组测序
对照组(CK):栽培培养基中未添加铬元素的蛹虫草子实体;试验组(SY):栽培培养基中铬元素浓度为400 μg/mL 的蛹虫草子实体。称取对照组和试验组蛹虫草样本各200 mg,每组样品3 个生物学重复,进行转录组测序试验。
1.3.6 实时荧光定量聚合酶链式反应(real time- quantitative polymerase chain reaction,RT-qPCR)验证试验
RT-qPCR 引物如表1 所示,总RNA 提取采用Trizol试剂盒;cDNA 合成采用PrimesoriptTMRT reagent kit with DNA Eraser 试剂盒。
1.4 数据处理
采用SPSS 22.0 软件对数据进行统计分析。
2 结果与分析
2.1 在液体发酵培养条件下的耐铬能力
为确定蛹虫草在液体发酵培养条件下的耐铬能力,采用液体发酵培养对蛹虫草菌丝体的生物量进行测定,如图1 所示。

图1 不同浓度铬元素对蛹虫草菌丝生物量的影响Fig. 1 Effects of different concentrations of chromium on the mycelial biomass of Cordyceps militaris
由图1 可知,在液体发酵培养条件下,蛹虫草菌丝生物量随铬元素添加浓度的增大呈先上升后下降的趋势。培养基中铬元素添加浓度在0~400 μg/mL 范围内,随铬元素添加浓度的增大,蛹虫草菌丝生物量也不断增加,当发酵培养基中铬元素添加浓度达到400 μg/mL 时,蛹虫草菌丝生物量达到最高值0.53 g/100 mL,且与对照组相比差异显著(P<0.05);而培养基中铬元素添加浓度为400~1 000 μg/mL 时,随铬元素添加浓度的增大,蛹虫草菌丝生长明显受到抑制,铬元素添加浓度为1 000 μg/mL 时,蛹虫草菌丝基本不能生长,表明添加过高浓度的铬元素会产生一定的毒性。综上,在液体发酵培养时,铬元素的最适添加浓度为400 μg/mL。
2.2 在液体发酵培养条件下的富铬作用
为确定蛹虫草菌丝在液体发酵培养条件下的富铬作用,对蛹虫草菌丝的铬含量和富铬率进行测定,如图2 所示。
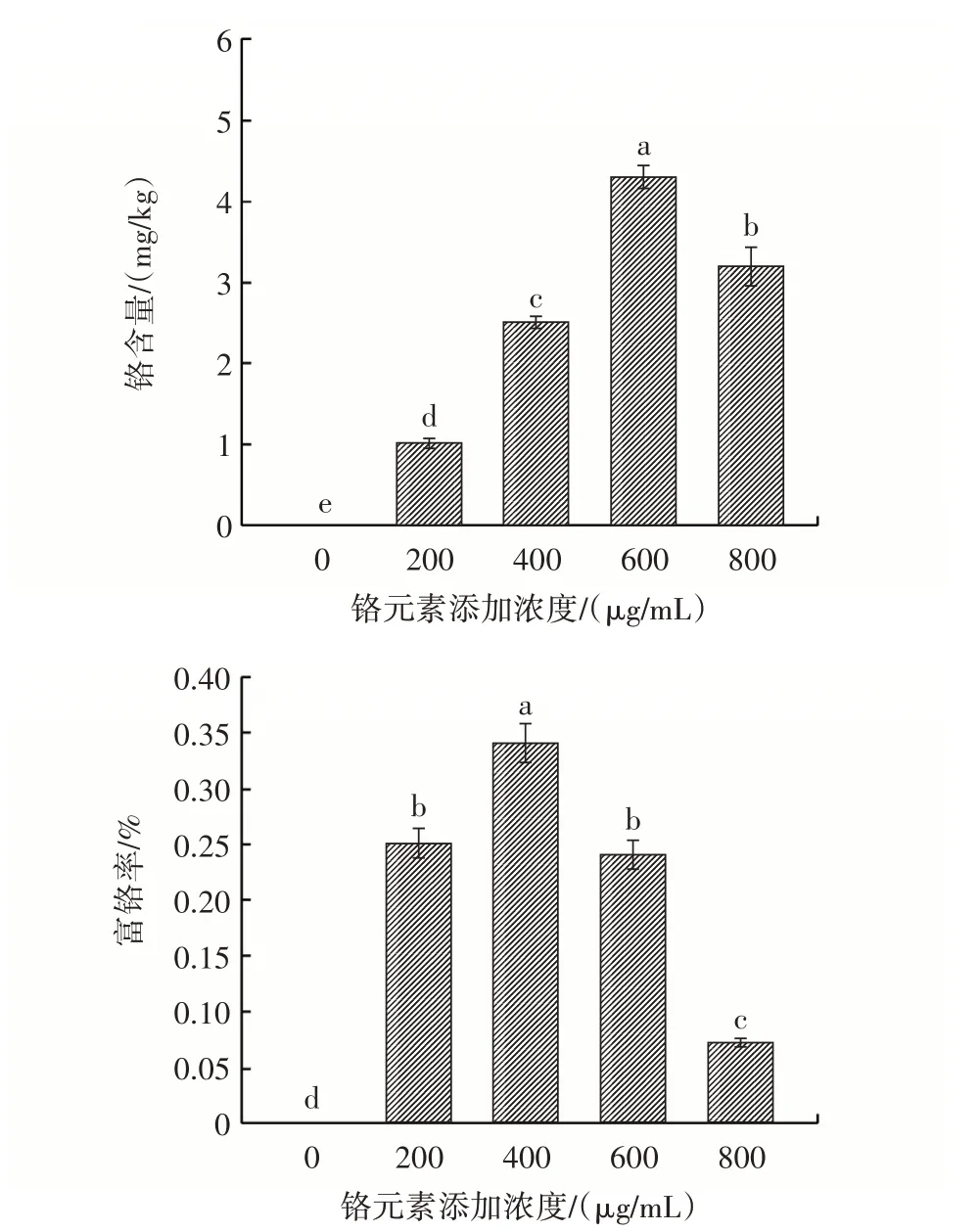
图2 不同浓度铬元素对蛹虫草菌丝中铬含量和富铬率的影响Fig.2 Effects of different concentrations of chromium on the chromium content and the chrome-rich rate in Cordyceps militaris mycelia
从图2 可以看出,在液体发酵培养条件下,蛹虫草菌丝中铬含量随铬元素添加浓度的增大呈先上升后下降的趋势,在铬元素添加浓度为600 μg/mL 时,蛹虫草菌丝中铬含量达到最高值4.5 mg/kg,且与对照组相比差异显著(P<0.05)。但是从蛹虫草菌丝的富铬率可以看出,液体发酵培养基中铬元素添加浓度为400 μg/mL 时,富铬率达到最大值0.34%,这与菌丝生物量达到最大时的发酵培养基中铬元素添加浓度一致。综上所述,在蛹虫草液体发酵培养时,添加铬元素浓度以400 μg/mL 为宜。
2.3 在固体平板培养条件下的耐铬能力
为确定蛹虫草在固体平板培养条件下的耐铬能力,对蛹虫草菌丝的菌落直径进行测定,如图3 所示。
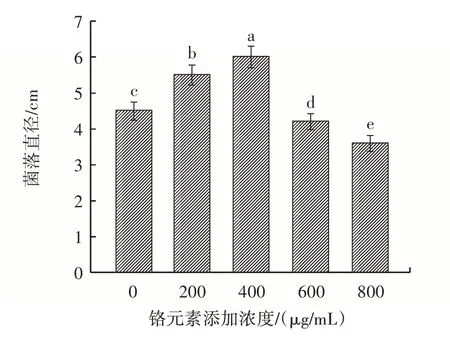
图3 不同浓度铬元素对菌落直径的影响Fig.3 Effects of different concentrations of chromium on the colony diameter
从图3 可知,当固体培养基中铬元素添加浓度在0~400 μg/mL 范围时,菌落直径与铬元素添加浓度呈正相关性,在铬元素添加浓度为400 μg/mL 时达到最大值6.0 cm,且与对照组相比差异显著(P<0.05);而随着固体培养基中铬元素添加浓度的不断增加,菌丝生长受到抑制,与液体发酵培养的结果一致。
2.4 在固体平板培养条件下的菌丝形态
添加不同铬元素对蛹虫草菌丝生长状态的影响,如图4 所示。

图4 不同铬浓度对蛹虫草菌丝形态的影响Fig.4 Effect of different chromium concentrations on the mycelium morphology of Cordyceps militaris
从图4 中可以直观地看出蛹虫草菌丝在固体平板上的生长状态。蛹虫草菌丝在未添加铬元素的培养基里,长势良好,厚薄均匀。培养基中添加200~400 μg/mL铬元素后,菌落直径与对照组相比明显增大,且长势正常,表明低浓度的铬元素有助于蛹虫草的生长;当培养基中铬元素添加浓度增大时,菌落直径逐渐变小,且菌丝边缘出现稀疏状态,表明培养基中铬元素浓度过高会对蛹虫草的生长产生一定的抑制作用。
2.5 不同浓度铬元素对蛹虫草生长状态的影响
添加不同铬元素对蛹虫草栽培时生长状态的影响,如图5 所示。

图5 不同浓度铬元素对蛹虫草生长状态的影响Fig.5 Effects of different concentrations of chromium on the growth of Cordyceps militaris
由图5 可知,与对照组相比,低浓度铬元素的添加不仅未影响蛹虫草的生长,而且提高了蛹虫草的外观品质,但高浓度的铬元素对蛹虫草子实体的生长影响较大,在铬元素添加浓度为800 μg/mL 时,蛹虫草子实体发生了畸变,甚至出现了一定程度的病原菌感染,表明高浓度的铬元素不仅抑制了蛹虫草的生长,而且具有一定的致病性。
2.6 不同浓度铬元素对蛹虫草农艺性状的影响
添加不同铬元素对蛹虫草子实体农艺性状的影响,如表2 所示。
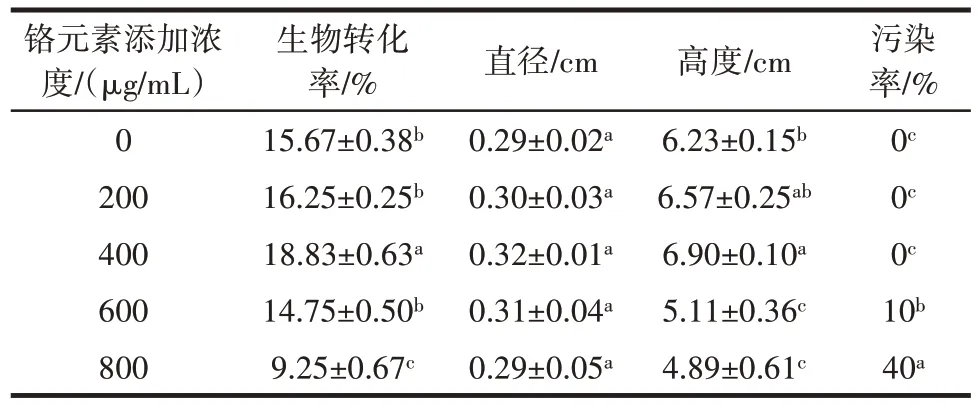
表2 不同浓度铬元素对蛹虫草农艺性状的影响Table 2 Effects of different concentrations of chromium on the agronomic trait of Cordyceps militaris
从表2 可以看出,蛹虫草栽培培养基中添加了铬元素后,子实体的直径、高度、生物转化率随培养基中铬元素添加浓度的增加而呈先上升后下降的趋势,在铬元素添加浓度为400 μg/mL 时,子实体高度和生物转化率均达到最大值,且与对照组相比,差异显著(P<0.05),这与液体发酵培养和固体平板培养的结果吻合。培养基中添加较高浓度的铬元素后,污染率明显提高,可见较高浓度的铬元素对蛹虫草子实体的生长具有一定的胁迫作用,降低了子实体对病原菌的抵抗能力。
2.7 质控数据分析
样品经过上机测序,得到图像文件,由测序平台自带软件进行转化,生成原始数据,即下机数据。对每个样品的下机数据分别进行统计汇总,结果如表3 所示。
从表3 可以看出,各组有效数据约占原始数据的91.45%、91.06%、90.56%、90.93%、91.03%、91.19%;对照组和试验组碱基测序错误率分别为0.02% 和0.03%;纯化后Q20 碱基比大于97%,Q30 碱基比大于93%,鸟嘌呤和胞嘧啶含量大于50%。结果表明,转录组测序数据丰富,质量高。
2.8 差异基因表达分析
采用R 语言ggplots2 软件包绘制差异表达基因的火山图,展示基因分布情况、基因的表达倍数差异和显著性,结果如图6 所示。
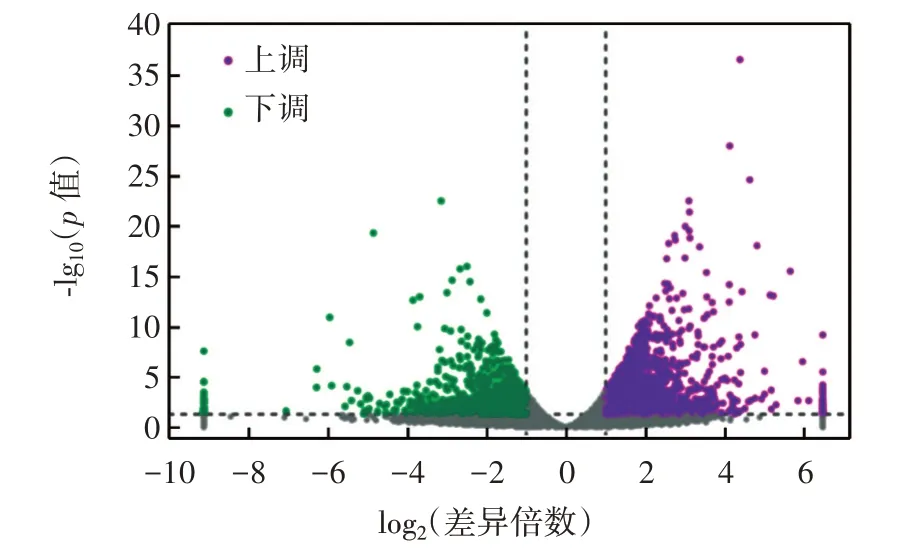
图6 差异基因表达火山图Fig.6 Volcano map of differential expression genes
由图6 可知,蛹虫草栽培培养基中添加铬元素后,与对照组相比共筛选出8 512 个差异表达基因(differential expression genes,DEGs),根据p<0.05 和|log2差异倍数|>1 进一步筛选出796 个差异显著表达基因,其中上调基因483 个,下调基因313 个。
2.9 基因本体(gene ontology,GO)富集分析
采用Top GO 进行GO 富集分析,结果如图7 所示。
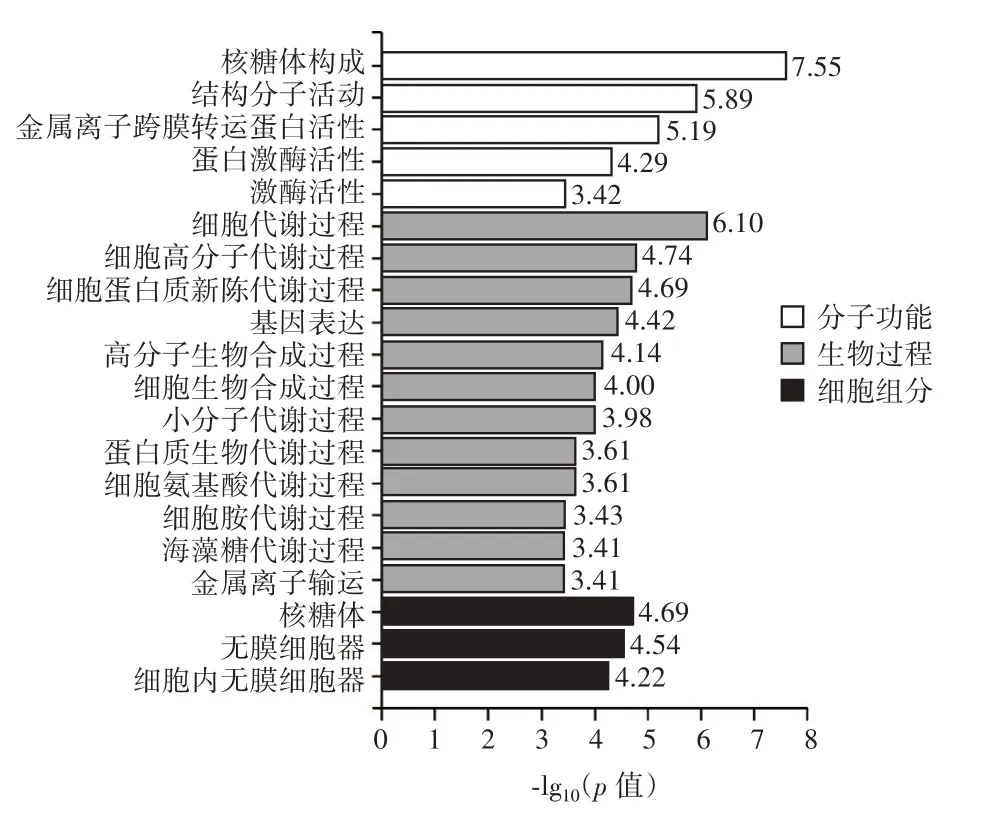
图7 GO 功能注释Fig.7 GO functional annotation
由图7 可知,差异基因在细胞组分这类中,分子功能富集最明显的GO 功能包括核糖体构成、结构分子活动、金属离子跨膜转运蛋白活性、蛋白激酶活性、激酶活性;生物过程富集最明显的GO 功能包括细胞代谢过程、细胞高分子代谢过程、细胞蛋白质新陈代谢过程、基因表达、高分子生物合成过程、细胞生物合成过程、小分子代谢过程、蛋白质生物代谢过程、细胞氨基酸代谢过程、海藻糖代谢过程、细胞胺代谢过程、金属离子输运;细胞组分富集最明显的GO 功能包括核糖体、无膜细胞器、细胞内无膜细胞器。
2.10 京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)富集分析
使用cluster profiler 进行KEGG 富集分析,利用KEGG 通路库注释的差异基因对每个通路的基因列表和基因数目进行计算,结果如图8 所示。
从图8 可以看出,796 个差异显著表达基因共富集到20 条代谢通路。其中,注释到核糖体、半胱氨酸和蛋氨酸代谢、氨基糖和核苷酸糖代谢、甲烷代谢和氨基酸生物合成5 条通路的基因较多。
2.11 关键KEGG 代谢通路与差异表达基因解析
差异表达基因富集的关键KEGG 代谢通路主要有丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)代谢通路、谷胱甘肽代谢通路、硫代谢通路、氨基酸代谢通路、核糖体途径这5 个代谢通路,结果见表4。
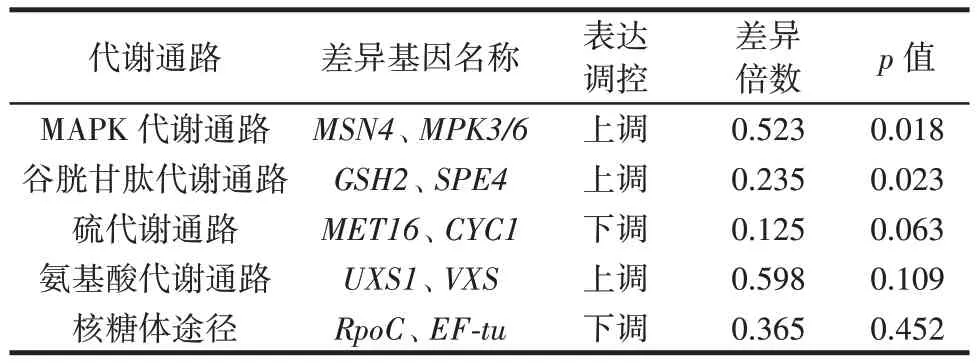
表4 关键KEGG 通路的差异表达基因解析Table 4 Analysis of DEGs enriched in key KEGG pathways
由表4 可知,MAPK 代谢通路能够在细胞受到不同的外界刺激后,通过信号转导产生不同的细胞生物学反应[22]。MSN4主要编码锌指蛋白的合成,MSN4基因上调表明细胞受到铬元素胁迫后产生适应性,有助于蛹虫草在铬元素刺激后的正常生长,有利于活细胞的正常代谢。GSH2基因上调表明铬元素环境下蛹虫草中谷胱甘肽合成酶上升,缓解了蛹虫草在铬元素胁迫下产生的氧化应激压力。此外,铬元素主要是通过硫酸盐转运蛋白进入到细胞中,MET16和CYC1基因明显下调意味着铬元素抑制了细胞中硫酸盐的摄取[23-24]。由此可见,在富铬蛹虫草的培育过程中,适量补充硫可以减轻铬元素对蛹虫草的胁迫[25]。
2.12 RT-qPCR 对基因表达的验证
进一步选取代表性差异表达基因MSN4、MPK3/6、GSH2、MET16对转录组学数据进行RT-qPCR 验证,结果如图9 所示。
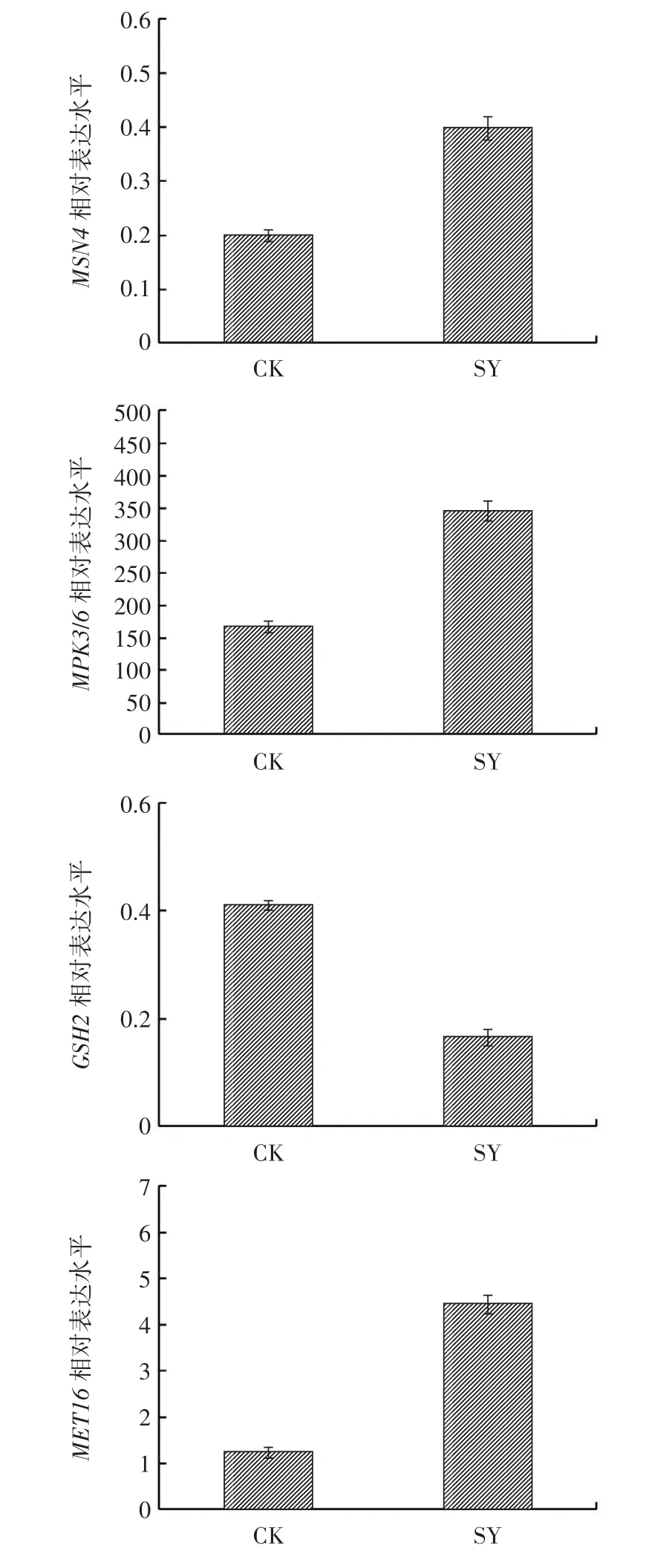
图9 4 种代表性差异表达基因的表达图谱Fig.9 Expression pattern of four representative DEGs
从图9 可以看出,与对照组(CK)相比,MSN4、MPK3/6、MET16基因表达水平提高,GSH2基因表达水平下降,且差异明显,这与关键KEGG 通路的差异基因表达的结果一致。
3 结论
本文探究了不同浓度铬元素对蛹虫草生长和质量的影响,结果表明无论是液体发酵培养、固体平板培养、还是栽培过程中,培养基中的铬元素最适添加浓度均为400 μg/mL。高浓度的铬元素会抑制蛹虫草的生长,主要表现为污染率升高、子实体畸变。此外,通过对富铬蛹虫草(400 μg/mL)和普通蛹虫草的Illumina HiSeq 4000 高通量测序分析,筛选出796 个差异显著表达基因,并解析了差异显著表达基因的代谢通路,从分子水平阐明蛹虫草富铬作用的机制。
