电针预处理对脂多糖诱导的认知障碍小鼠线粒体动力学的影响
2024-03-13陈梦洁丁玲玲炎茹玉罗见生宁甲齐周瑞玲
陈梦洁 丁玲玲 炎茹玉 罗见生 宁甲齐 周瑞玲 于 波
首都医科大学附属北京中医医院麻醉科,北京 100010
围手术期神经认知障碍(perioperative neurocognitive disorder,PND)指术前和术后1 年内出现的认知功能改变,会导致患者术后痴呆症状和死亡率增加,且尚无有效治疗措施。神经炎症是PND 的关键驱动因素,多种促炎性细胞因子,如白细胞介素1β(interleukin-1β,IL-1β)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)已被证实与其密切相关[1-3]。小鼠脑室内注射脂多糖(lipopolysaccharide,LPS)通过激活小胶质细胞增加促炎性细胞因子表达,最终引发认知障碍,此方法可有效建立炎症相关PND 模型[4]。研究证实,电针预处理抑制神经炎症、线粒体功能障碍和小胶质细胞活化,可有效减轻PND[5-7]。也有研究表明,术前针刺干预降低老年患者PND 发生率[8]。线粒体动力学指线粒体通过持续的分裂融合改变自身形态和数量以满足细胞能量代谢及其他生物学功能的过程[9]。发动蛋白相关蛋白1(dynamin-relatedprotein 1,DRP1)和线粒体融合蛋白2(mitofusin 2,MFN2)是线粒体分裂融合的关键调节因子,DRP1 募集到线粒体外膜形成环状结构,通过切割线粒体膜分裂出不同大小的线粒体,MFN2 位于线粒体外膜,通过促进线粒体融合恢复线粒体功能[10-11]。本研究通过建立神经炎症诱导的PND 模型,观察电针对PND 小鼠DRP1 和MFN2 表达的影响,探讨电针预处理改善脂多糖诱导的小鼠认知障碍的机制。
1 材料与方法
1.1 实验动物
10~11 周龄SPF 级雄性C57BL/6 小鼠45 只,体重25~27 g。购于斯贝福(北京)生物技术有限公司,生产许可证号:SCXK(京)2019-0010;合格证号:No.110324221104426272。饲养于北京市中医研究所动物室,室温22~24 ℃,湿度55%~65%。本研究通过首都医科大学附属北京中医医院实验动物福利伦理委员会批准(BJTCM-M-2023-04-01)。
1.2 主要仪器及试剂
0.18 mm×13.00 mm 无菌针灸针(北京中研太和医疗器械有限公司);华佗牌电子针疗仪(苏州医疗用品厂有限公司);立体定位仪器(Kopf Instruments,Model900);行为学软件(宁波安来软件科技有限公司);流式细胞仪(美国Beckman,Cyto FLEXS)。LPS(美国Sigma,批号:SV30010);JC-1 线粒体膜电位(mitochondrial membrane potential,MMP)试剂盒(上海碧云天生物技术有限公司,货号:C2006);腺苷三磷酸(adenosine triphosphate,ATP)试剂盒(上海碧云天生物技术有限公司,货号:S0026);酶联免疫吸附试验试剂盒(美国RayBiotech,货号:ELM-IL-1β,ELM-TNFα);DRP1 兔抗(美国CST,货号:#8570);MFN2 兔抗(美国CST,货号:#9482);山羊抗兔二抗(美国CST,货号:#7074)。
1.3 模型制备和分组
按随机数字表法将小鼠分为对照组、模型组和电针组,每组15 只。模型组和电针组制备LPS 诱导的认知障碍小鼠模型,对照组注射2 μl 人工脑脊液。腹腔注射2%戊巴比妥钠(0.2 ml/100 g)麻醉小鼠后,使用立体定位仪在右侧脑室给药,坐标为前囟向后0.5 mm,矢状缝右侧1.0 mm,深度2.0 mm[12]。LPS(2 μg)溶于2 μl 人工脑脊液(140 mmol/L NaCl,3.0 mmol/L KCl,2.5 mmol/L CaCl2,1.0 mmol/L MgCl2,1.2 mmol/L Na2HPO4,pH=7.4)。颅骨钻钻开颅骨,10 μl 微量注射器针尖缓慢进入颅内,注射速度设置为0.667 μl/min,并将针头保持在原位2 min,以使药物充分扩散。以小鼠出现记忆下降视为造模成功[13]。
1.4 电针干预
电针组于造模前2 周行电针预处理,选取神庭、百会、足三里和内关(足三里和内关选取左侧,电针干预1 周后换右侧),小鼠清醒状态俯卧位固定。穴位定位参考《实验针灸学》[14],神庭位于小鼠头部前正中线,额顶骨缝交界线前方;百会位于顶骨正中;足三里位于膝关节后外侧,腓骨小头下约5 mm 处;内关位于前肢内侧,腕关节上1 mm 左右的尺桡骨缝间。电子针疗仪的刺激参数设为:疏密波,频率2 Hz/100 Hz,电流强度1~2 mA,以针柄震颤同时动物保持安静状态的针刺强度为佳,30 min/次,5 次/周,连续2 周。对照组和模型组仅固定,无电针刺激。
1.5 标本采集
在造模后6 h 取材,每组随机取5 只小鼠用于检测炎症因子,2%戊巴比妥钠按0.2 ml/100 g 腹腔注射麻醉后,剪开小鼠胸腔,暴露心脏,用0.9%NaCl 溶液(4℃预冷)灌注,当见右心耳溢出淡色液体,且肝脏及两肺颜色变白时停止灌注。快速断头取出整个脑组织,其海马组织匀浆,4℃下12 000 r/m(离心半径10 cm)离心10 min,取上清于-80℃冰箱保存待检。行为学测试结束后,每组剩余的10 只小鼠立即取材,操作同上,获取海马组织。其中每组5 只小鼠新鲜海马组织制备单细胞悬液,剩余5 只小鼠海马组织于-80℃冰箱保存。
1.6 观察指标及检测方法
1.6.1 旷场实验评估自发活动和焦虑行为 造模后第1天,每组10 只小鼠完成旷场实验后进行水迷宫空间探索测试。旷场实验箱上方架摄像头,将小鼠放置在正中央格,同时进行摄像和计时。记录小鼠移动总路程,中央区停留时间和穿越中央区次数。
1.6.2 Morris 水迷宫评估小鼠的记忆能力 水迷宫分为4 个象限(①~④),平台放置在②象限(目标象限)。小鼠在造模前接受隐藏平台训练连续5 d,4 次/d。小鼠被训练在60 s 内爬上平台,若未在60 s 内到达平台,则被引导到平台上站立15 s。空间探索试验在撤离平台的水迷宫中进行60 s 的测试。记录穿越原平台次数和目标象限停留时间百分比。
1.6.3 酶联免疫吸附试验检测海马组织炎症因子水平 取海马组织上清液,按照试剂盒说明,用酶标仪检测标准品孔与样本孔的光密度,依据标准曲线计算样本中TNF-α、IL-1β 的水平。
1.6.4 流式细胞术检测海马MMP 水平 取海马单细胞悬液至流式管,加入JC-1 工作液混匀、孵育、离心弃上清。缓冲液重悬细胞,并用流式细胞仪检测。MMP较低时显示绿色荧光,MMP 较高时显示红色荧光。计算绿色与红色荧光强度的比值,比值升高表明MMP下降,比值降低表明MMP 升高。
1.6.5 化学发光法检测海马组织ATP 水平 取小鼠海马组织,参照说明书裂解组织,配制ATP 工作液。每孔加入工作液,室温放置5 min。孔内加上标准品或样品,混匀后测定相对光单位值。根据标准曲线计算出样品中ATP 的水平。
1.6.6 蛋白质印迹法检测海马组织中DRP1 和MFN2 的表达 取小鼠海马组织加入蛋白酶抑制剂、磷酸酶抑制剂和RIPA 裂解液,组织匀浆离心取上清。电泳,电转和封闭后4℃过夜孵育一抗DRP1(1∶1 000)、MFN2(1∶1 000)和β-actin(1∶1 000)。次日加入二抗孵育1 h。以目的蛋白与内参蛋白灰度值的比值作为目的蛋白的相对表达量。
1.7 统计学方法
采用SPSS 25.0 统计学软件进行数据分析,GraphPad 8.4.0 绘图软件作图。计量资料采用均数±标准差(±s)表示,比较采用t 检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 三组旷场实验结果比较
模型组移动总路程、中央区停留时间和穿越中央区次数与对照组比较,差异无统计学意义(P>0.05)。电针组移动总路程、中央区停留时间和穿越中央区次数与模型组比较,差异无统计学意义(P>0.05)。见图1。
2.2 三组记忆能力比较
模型组穿越原平台次数和目标象限停留时间百分比低于对照组,差异有统计学意义(P<0.05)。电针组穿越原平台次数和目标象限停留时间百分比高于模型组,差异有统计学意义(P<0.05)。见图2。

图2 三组记忆能力比较(n=10)
2.3 三组海马组织IL-1β、TNF-α 水平比较
模型组海马组织IL-1β、TNF-α 水平高于对照组,差异有统计学意义(P<0.05)。电针组海马组织IL-1β、TNF-α 水平低于模型组,差异有统计学意义(P<0.05)。见图3。

图3 三组海马组织IL-1β、TNF-α 水平比较(n=5)
2.4 三组海马组织MMP 和ATP 水平比较
模型组海马绿/红荧光比值高于对照组,MMP、ATP 水平低于对照组,差异有统计学意义(P<0.05)。电针组海马组织绿/红荧光比值低于模型组,MMP、ATP 水平高于模型组,差异有统计学意义(P<0.05)。见图4。

图4 三组海马组织MMP 和ATP 水平比较(n=5)
2.5 三组海马组织DRP1 和MFN2 表达水平比较
模型组海马组织DRP1 表达水平高于对照组,MFN2 表达水平低于对照组,差异有统计学意义(P<0.05)。电针组海马组织DRP1 表达水平低于模型组,MFN2 表达水平高于模型组,差异有统计学意义(P<0.05)。见图5。
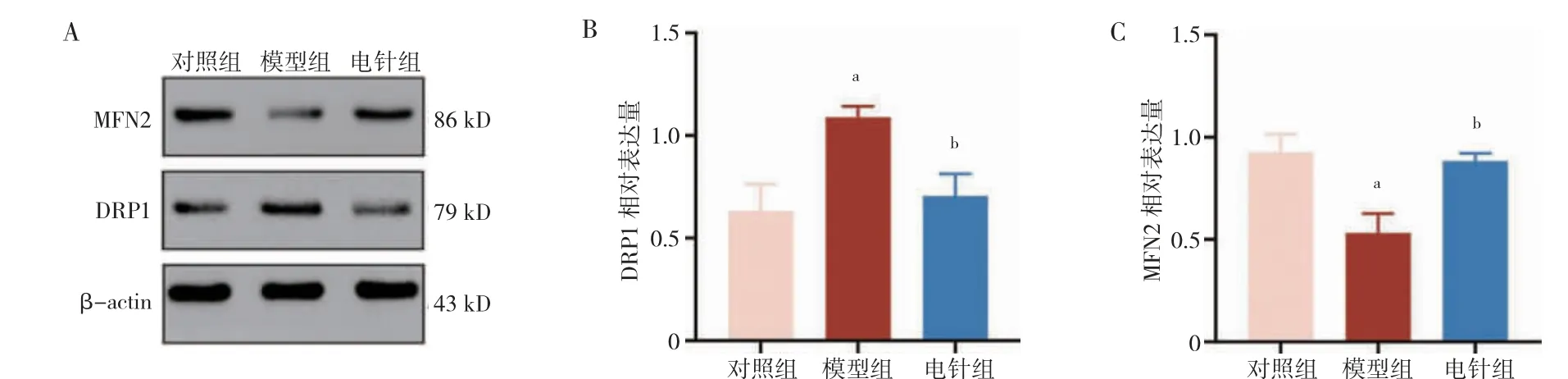
图5 三组海马组织DRP1 和MFN2 表达水平比较(n=5)
3 讨论
本研究中旷场实验结果显示,三组小鼠自发活动和焦虑行为比较,差异无统计学意义(P>0.05),排除自发活动和焦虑行为对空间探索测试结果产生影响。空间探索测试结果显示,模型组小鼠出现记忆障碍,炎症相关PND 模型建立成功。本研究中,与模型组比较,电针组穿越原平台次数和目标象限停留时间百分比增加,提示电针可改善LPS 诱导的记忆障碍。
有研究显示,针刺神庭、百会、内关可降低老年患者术后谵妄发生率和炎症反应[15]。针刺足三里可驱动迷走神经-肾上腺轴,促进抗感染物质释放[16]。神经炎症是PND 关键发病机制的观点受到广泛认可[17-18]。手术激活全身免疫反应导致小胶质细胞活化,进而释放更多促炎性细胞因子,加剧神经炎症和脑损伤[19]。本研究结果显示,海马组织中IL-1β 和TNF-α 含量在造模后6 h 增加,而电针预处理逆转LPS 引起的炎症因子增加,同既往研究一致[20]。
神经炎症导致神经元线粒体功能障碍(MMP 和ATP 水平降低),受损的线粒体进一步放大炎症反应,从而形成恶性循环[21]。线粒体功能障碍是神经退行性疾病相关认知障碍的突出病理特征,MMP 下降导致氧化磷酸化异常,进而影响神经元能量供应[22]。DRP1过表达引发线粒体碎片化,MFN2 表达下降导致线粒体融合缺陷,致使线粒体功能失调,脑缺血小鼠的死亡率增加[23-24]。本研究结果显示,与对照组比较,模型组小鼠海马MMP 和ATP 水平降低,DRP1 的表达增加,MFN2 的表达减少,提示LPS 引起线粒体功能受损,线粒体分裂融合的动态平衡被打破。研究表明,线粒体动力学失衡参与胫骨骨折内固定术小鼠的认知障碍,而海马中DRP1 的表达量不变[25]。这与本研究结果不一致,可能是因为模型或检测时间不同所致。与模型组比较,电针组小鼠海马MMP 和ATP 水平增加,MFN2 的表达升高,DRP1 的表达降低,提示电针可改善线粒体功能,抑制线粒体过度分裂,促进线粒体融合。
综上所述,电针改善LPS 诱导的认知障碍,减轻神经炎症,其机制可能与调节线粒体动力学稳态有关。这些发现可为电针改善PND 增加新的理论依据及治疗靶点。
利益冲突声明:本文所有作者均声明不存在利益冲突。
