2020年云南省鸡呼吸系统疫病病因分析
2024-03-12张振兴李占鸿宋建领
张振兴,李占鸿,王 斌,宋建领*
(1. 云南省畜牧兽医科学院,云南省热带亚热带动物病毒病重点实验室,云南 昆明 650224; 2. 威信县动物疫病预防控制中心, 云南 威信 657900)
鸡呼吸道疫病作为禽类主要传染病之一[1],已经严重威胁了云南省禽类养殖业的健康可持续发展,其表现症状主要为咳嗽、打喷嚏、眼睛红肿流泪、产蛋鸡产出畸形蛋等,剖检特征主要包括鼻窦内充满大量黏液、眼睑肿胀、喉气管有炎症并伴有出血症状,脾、肾、肝、肺脏等器官出现淤血且有坏死特征等,尤其是由于部分养殖场环境卫生不达标、养殖不合理,更易造成呼吸系统疫病的暴发和蔓延[2-4]。为进一步探究云南省本土鸡呼吸道疫病的主要传染病因,试验以2020年昆明、红河、曲靖、大理、楚雄、昭通等地疑似感染呼吸道疫病的鸡养殖场采集的111份样品为研究对象,进行副鸡禽杆菌、鸡毒支原体(Mycoplasma gallisepticum, MG)、滑液囊支原体(Mycoplasma synoviae, MS)、新城疫病毒(Newcastle disease virus, NDV)、传染性支气管炎病毒(Infectious bronchitis virus, IBV)、传染性喉气管炎病毒(Infectious laryngotracheitis virus, ILTV)、禽流感病毒(Avian influenza virus, AIV)、鼻气管鸟杆菌(Omithobacterium rhinotracheale, ORT)等常见鸡呼吸系统传染病病原核酸检测,为云南省鸡养殖场有效防疫并减少生产损失提供科学依据。
1 材料与方法
1.1 病料和阳性样品
病料:在云南省昆明、红河、曲靖、大理、楚雄、昭通等地出现咳嗽、打喷嚏、呼吸困难等呼吸道症状的养鸡场采集临床症状明显的病鸡肺脏、脾脏、喉气管等混合组织样品111份,冷藏送实验室检测,不同地区采集鸡场数量、规模、品种和日龄情况见表1。

表1 不同地区采集鸡场信息表Table 1 Information of chicken farms collected in different regions
阳性样品:副鸡禽杆菌、ORT由本实验室分离鉴定保存,NDV、AIV血凝抑制抗原购自哈尔滨维科生物技术开发公司,IBV、ILTV和MG和MS弱毒疫苗购自云南雄云生物科技有限公司。
1.2 主要试剂与仪器
RNA/DNA核酸提取试剂盒、RT-PCR 试剂盒、PCR试剂盒、DL-2 000 Marker等,均购自宝生物工程(大连)有限公司。超净工作台(型号为LA2-4A1),购自ESCO公司;PCR仪(型号为 9700),购自美国ABI公司;凝胶成像系统(型号为 2000),购自美国Bio-Rad公司。
1.3 病料处理及核酸提取
将采集的不同养殖场疑似患病鸡的肺脏、脾脏、喉气管等组织样品混合剪碎,按照体积比1:10的比例加入生理盐水充分研磨,研磨的混合物反复冻融3次,3 000 r/min离心10 min,按照RNA/DNA 核酸提取试剂盒说明书,分别提取组织上清液核酸。
1.4 引物的合成
根据国内外已发表的副鸡禽杆菌基因序列、MG基因序列、MS基因序列、NDV基因序列、IBV基因序列、ILTV基因序列、AIV基因序列、ORT基因序列及参考文献[5-9],分别由本实验室设计引物IC-F/IC-R、MG-F/MG-R、MS-F/MS-R、NDV-F/NDV-R、IBV-F/IBV-R、ILTV-F/ILTV-R、AIV-F/AIV-R、ORT-F/ORT-R,引物信息见表2,引物由北京擎科生物科技有限公司昆明分公司合成。

表2 引物序列信息表Table 2 Information list of primer sequence
1.5 病原核酸的检测及测序分析
通过RT-PCR或PCR方法分别检测NDV、AIV、IBV、ILTV、ORT、副鸡禽杆菌、MG和MS核酸。RT-PCR 扩增体系 (总体积为 25 μL)) : RNase Free dH2O 8.5 μL,2×1 Step Buffer 12.5 μL,Prime Script 1step Enzyme Mix 1 μL,20 μmol/L 上、下游引物各0.5 μL,模板RNA 2 μL。RT-PCR扩增程序: 50 ℃反转录30 min; 94 ℃预变性2 min; 94 ℃变性30 s,45 ℃退火30 s, 72 ℃延伸1 min,共35个循环; 72 ℃再延伸7 min。PCR扩增体系(总体积为25 μL) : RNase Free dH2O 8.5 μL, rTaq Buffer 12.5 μL,20 μmol/L上游引物、下游引物各1 μL,模板DNA 2 μL。PCR扩增程序: 95 ℃预变性5 min; 94 ℃变性1 min, 50 ℃退火1 min, 72 ℃延伸1 min,共35个循环;72 ℃再延伸7 min。根据病原核酸检测结果对111份样品进行呼吸系统病因分析,各病原选择1至3个阳性样品的PCR产物委托北京擎科生物科技有限公司昆明分公司进行测序,通过Blast分析对病原进行确诊。
2 结果与分析
2.1 病原核酸检测
对111份疑似鸡呼吸系统疫病样品进行8种病原的核酸检测,副鸡禽杆菌核酸阳性样品21份(图1A),阳性率为18.92%;MG核酸阳性样品12份(图1B),阳性率为10.81%;MS核酸阳性样品6份(图1C),阳性率为5.41%;NDV核酸阳性样品5份(图1D),阳性率为4.50%;IBV核酸阳性样品3份(图1E),2.70%;ILTV核酸阳性样品44份(图1F),阳性率为39.64%;AIV核酸阳性样品10份(图1G),阳性率为9.00%;ORT核酸阳性样品21份(图1H),阳性率为18.92%。

图1 阳性样品PCR扩增结果A. 副鸡禽杆菌;B. MG;C. MS;D. NDV;E. IBV;F. ILTV;G. AIV;H. ORT M. DNA分子量标准(DL2000);1.阳性对照; 2.阴性对照; 3~8.样品(采集的所有样品都进行了PCR检测,图中只列出了部分样品的结果)Fig.1 PCR results of positive samplesA. Avibacterium paragallinarum;B. MG;C. MS;D. NDV;E. IBV;F. ILTV;G. AIV;H. ORT M. DL 2000 DNA Marker; 1. Positive control; 2. Negative control; 3~8. The samples(All samples collected were tested by PCR, and only a subset of the results are shown in the figure)
2.2 病原混合感染分析
在确定样品单一病原检测结果的基础上,本试验对样品混合感染不同病原的数据进行统计(表3),结果表明,有36份检测样品为混合感染,占检测总数的32.43%,其中有21份检测样品混合感染2种疫病,占检测总数的18.92%;13份检测样品混合感染3种疫病,占检测总数的11.71%;2份检测样品混合感染4种疫病,占检测总数的1.80%。

表3 云南省不同鸡场混合感染病原核酸检测结果Table 3 Detection results of pathogeny nucleic acid of mixed infection samples in different chicken farms in Yunnan Province
2.3 部分阳性样品测序分析
试验选择部分阳性样品的PCR产物进行测序,对获取的序列进行Blast比对分析,结果表明,阳性样品序列与Genbank数据库中公布的相同病原序列高度相似。构建的系统发育树显示,阳性样品序列分布于同种病原的不同毒株序列之间(图2到图10)。以上结果表明,根据样品核酸PCR检测结果作出的病原诊断结果准确可靠。

图2 1份副鸡禽杆菌核酸阳性样品16S rRNA 基因序列进化树Fig.2 Phylogenetic tree of 16S rRNA gene sequence of 1 avibacterium paragallinarum positive sample
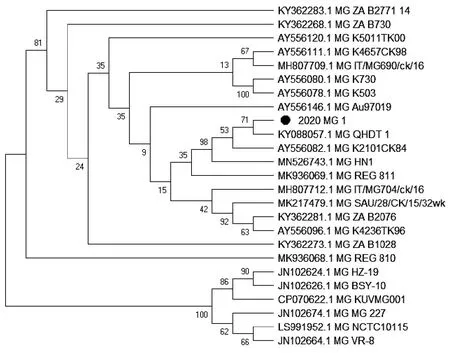
图3 1份MG核酸阳性样品LP基因序列进化树Fig.3 Evolutionary tree of LP gene sequence of 1 MG positive sample

图4 1份MS核酸阳性样品heat shock ATP-dependent protease基因序列进化树Fig.4 Evolutionary tree of heat shock ATP-dependent protease gene sequence of 1 MS positive sample

图5 1份NDV核酸阳性样品F基因序列进化树Fig.5 Evolutionary tree of F gene sequence of 1 NDV positive sample

图6 1份NDV核酸阳性样品F基因序列进化树Fig.6 Evolutionary tree of F gene sequence of 1 NDV positive sample

图7 2份IBV核酸阳性样品 N基因序列进化树Fig.7 Evolutionary tree of N gene sequence of 2 IBV positive samples

图8 1份ILTV核酸阳性样品TK基因序列进化树Fig.8 Evolutionary tree of TK gene sequence of 1 ILTV positive sample

图9 2份AIV核酸阳性样品HA基因序列进化树Fig.9 Evolutionary tree of HA gene sequence of 2 AIV positive samples
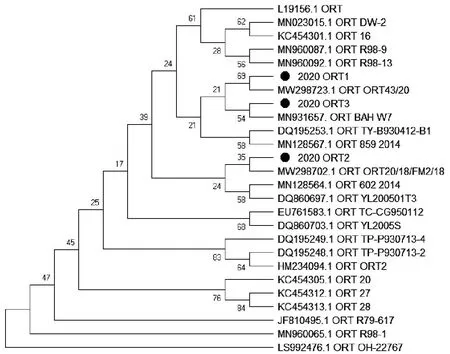
图10 3份ORT核酸阳性样品16S rRNA基因序列进化树Fig.10 Evolutionary tree of 16S rRNA gene sequence of 3 ORT positive samples
3 讨 论
在云南省鸡的养殖饲养过程中,呼吸道疫病普遍存在,各日龄鸡均可发生呼吸道疫病感染,治疗、防护不合理、不及时等可能会引起多种疾病的交叉感染或继发感染,除引起呼吸道明显症状外,还会导致鸡生长缓慢甚至死亡的发生,给云南省养鸡业带来巨大的经济损失[9]。引起鸡呼吸道疫病的原因和种类有很多,具体包括病毒性病原、细菌性病原与非微生物性病因[1]。病毒性病原如AIV、NDV、IBV、ILTV等是影响鸡健康养殖的最重要因素[1,3,6];细菌性病原如副鸡禽杆菌、大肠杆菌、支原体、鼻气管鸟杆菌等单一感染导致病情较轻,但常常与病毒性疫病混合感染,导致鸡群发病率和死亡率升高,仍不可忽视。在养殖条件较差的鸡场,其它非微生物性病因仍是鸡群发生呼吸系统的主要因素之一,如饲养密度过大、消毒卫生不规范、季节更换造成的应激反应、室内温度不稳定、环境中灰尘或有害气体过多等,这些都需要引起养殖业主的注意[2,9]。
2020年在111份疑似发生呼吸系统疫病病鸡中,检测到副鸡禽杆菌和鼻气管鸟杆菌阳性率均为18.92%,而2017年的阳性率分别为49.12%和33.33%[9],说明2020年云南家禽呼吸道疫病病原中的细菌性病原的比例明显下降。由病毒(AIV、NDV、IBV、ILTV)引起的病例共计57例,占比为51.35%,值得注意的是,ILTV核酸的阳性率高达39.64%;由支原体(MG和MS)引起的病例共计15例,占比为13.51%,与2017年的检测阳性率(84.21%)[9]相比下降最为显著。说明近几年来云南省家禽养殖规模化程度越来越高,设施设备越来越好,管理比较规范,减少了条件致病菌性疫病的发生。但ILT的防控形势十分严峻,应引起家禽养殖场的高度重视,可能存在免疫后带毒情况,应在加强疫苗免疫的同时,做好生物安全措施的执行,减少ILT隐性感染造成的经济损失。另外37.84%的病例出现明显症状但未测得病原核酸阳性,说明某些养鸡场仍存在管理方面的漏洞,尤其是冬季在做好保温的同时,合理通风换气、减少鸡舍灰尘或有害气体浓度,注意饲料营养成分均衡、减少应激等[10]。
本次检测发现单一病原引起鸡呼吸道疫病的比例为29.73%,多种病原共同引起鸡呼吸道疫病的比例为32.43%,其中2种病原核酸阳性率为18.92%,3种病原核酸阳性率为11.71%,4种病原核酸阳性率为1.80%,说明云南省鸡群中多重感染仍然比较严重。在鸡群呼吸道疫病防控中,根据发病原因,针对性的进行治疗和预防,才能获得比较理想的防控效果。根据调查,多重病原感染的鸡群比单一病原感染鸡群的呼吸道病情更加严重[11],共感染比例大且严重的原因主要与呼吸道病原体之间协同致病有一定关联[8]。Feng等[12]研究表明,鸡感染H9N2后,可导致机体免疫力下降,进一步导致NDV和IBV免疫失败,从而增加鸡群感染NDV或IBV的几率。Kleven等也证实[13],当发生共感染时,鸡体内的MG可阻碍ORT等在体内的清除,甚至MG可作为第一病原体,因其抗原的多样性抑制免疫应答,为细菌或病毒性病原体的入侵创造条件。因此,在制定免疫程序中,必须充分考虑疫苗免疫之间的合理间隔时间,2种疫苗或多种疫苗同时免疫的科学性等因素,提高鸡群免疫效果的同时,降低疫苗免疫频次,降低疫苗免疫对鸡群造成的应激反应。
4 结 论
云南省2020年度鸡呼吸系统疾病由多种病原引起,其中以副鸡禽杆菌、ILTV、ORT为主;对感染呼吸道疫病的鸡群应采取综合防控措施,制定科学的免疫程序,以降低呼吸道疫病的发生率,减少损失。
