碳酸乙烯酯合成过程热力学分析与动力学模拟
2024-03-12吕全明刘银川贺来宾
吕全明,刘银川,李 娜,贺来宾
(中石化(上海)石油化工研究院有限公司,上海 201208)
碳酸乙烯酯(EC)是一种性能优良的绿色化工产品,被广泛用于电池电解液、有机合成中间体、表面活性剂、纤维和制药等行业[1-6]。随着新能源汽车的普及,动力电池电解液的需求激增,而EC具有介电常数高、热稳定性强、相容性好、安全性高和寿命长等优点,是动力电池电解液的良好溶剂[7-9]。EC的生产方法主要有光气法、乙烯氧化法、尿素醇解法和环氧乙烷(EO)与CO2酯化加成法等[10-14]。其中,EO与CO2酯化加成法是最具工业前景的EC合成方法[15-16],一方面是因为EO与CO2酯化加成法符合“绿色化学”的科学理念,其原子利用率为100%,具有原子经济性;另一方面,其合成原料CO2是温室气体的重要成分,EO与CO2酯化加成法可以将CO2固定在化工产品中,开拓了一条碳捕集利用与封存(CCUS)的绿色路线,对减少温室效应有着积极贡献。
EO与CO2酯化加成法有均相法和非均相法两种[10,12,17-21]。均相法具有催化剂用量少和催化效率高的优点,但催化剂和反应产物难以分离,分离所需能耗高且会不可避免的引起催化剂损失。非均相法所用催化剂与产品易分离,且催化活性高、选择性好,受到国内外学者的广泛关注。
热力学分析是判断反应发生可能性和反应程度的重要依据,也是确定反应工艺操作条件和设计反应器的重要依据[22-23];而反应工艺条件的优化和工业反应器的设计离不开反应动力学建模。Zhang Bo等[5]和吴青海等[12]计算了气相EO与CO2合成固态EC的主反应热力学,然而在该研究反应温度范围内EC应为液态产物。此外,Zhang Bo等[5]、吴青海等[12]、李扬等[24]分别研究了季铵盐和离子液体催化EO与CO2合成EC的主反应动力学,发现该主反应为一级反应,其反应速率与EO浓度成线性关系。
鉴于离子交换树脂是一种性能优秀的非均相催化剂,而目前尚未见其用于催化EO与CO2酯化加成合成EC的反应动力学研究报道。因此,本课题首先对EO与CO2酯化加成合成EC的反应过程进行热力学分析,判断主副反应的热力学差异;然后以离子交换树脂为非均相催化剂,在100 ℃、3 MPa条件下研究EC合成中试装置不同停留时间下的产物分布;进而,建立包含反应物EO和产物EC的宏观反应动力学模型,以为非均相法EO与CO2酯化加成合成EC的工艺优化和工业反应器选型、设计提供必要的依据。
1 反应热力学计算
EO与CO2的反应过程如图1所示。由图1可知,该反应过程的主反应为EO与CO2酯化加成为EC;但在有水存在情况下,EO会水合生成乙二醇(EG),EC会水解生成EG,EG会进一步与EO反应生成一缩二乙二醇(DEG)和二缩三乙二醇(TEG)。由于工业生产中,原料EO与CO2中不可避免的会带有微量水,因此上述副反应不可避免。除此之外,极微量的EO会发生聚合反应生成聚醚类化合物,由于其占比极小,因此本文的热力学计算中不涉及EO聚合过程。
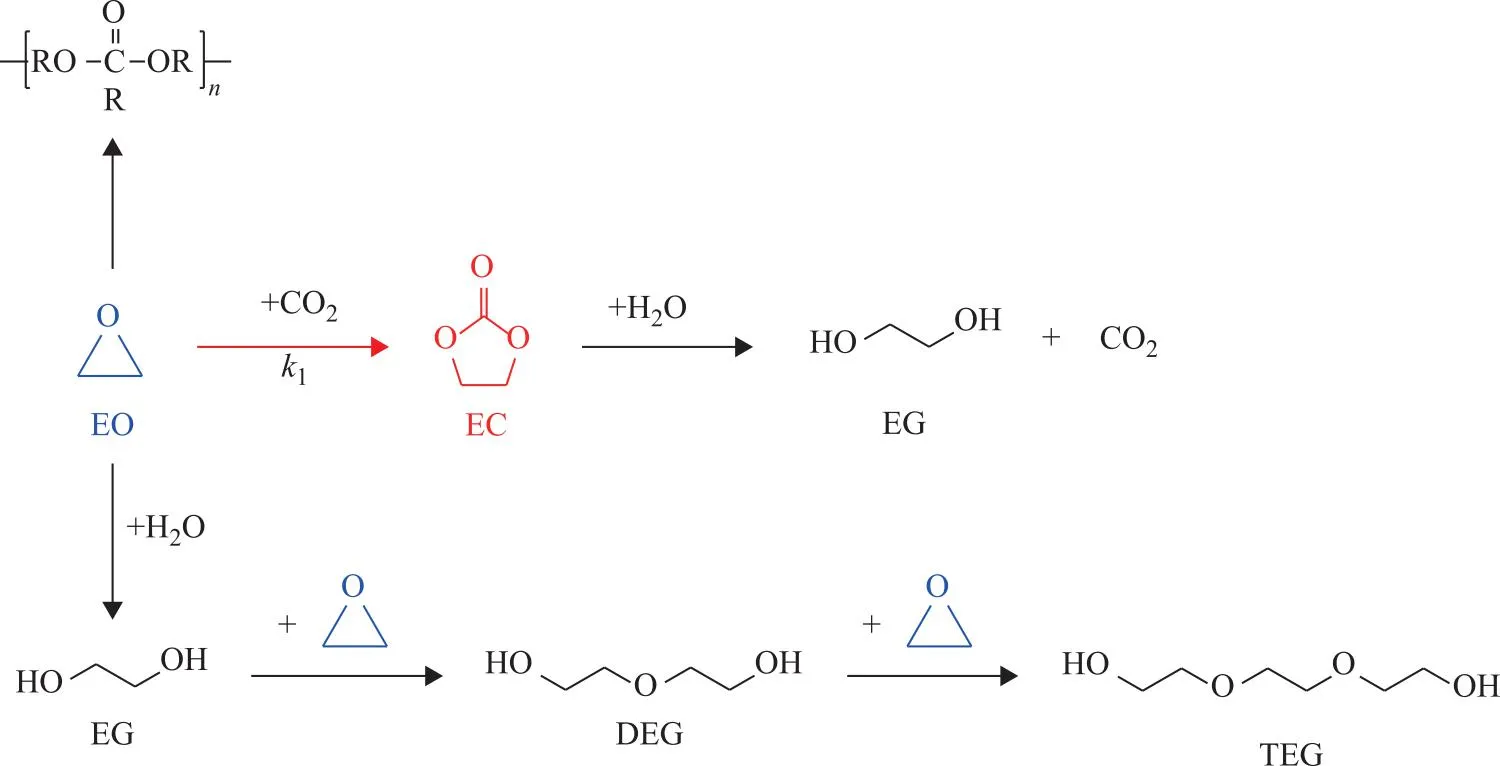
图1 EO与CO2合成EC的反应路径
1.1 获取理想气体标准摩尔生成焓、标准摩尔熵和定压摩尔热容


表1 组分的热力学数据[25]
1.2 不同温度下物质汽化热的计算

(1)
式中:ΔvHb为物质在常压沸点下的汽化热,kJ/mol;Tb为常压沸点,K;Tc为临界温度,K;Tr=T/Tc为对比温度,其中,T为任意反应温度,K;Tbr=Tb/Tc;指数n与物质的性质有关。各物质的物性参数如表2所示。

表2 反应体系中不同组分的Tb,Tc,ΔvHb,n[25]
1.3 液态组分和的计算
(2)
(3)
1.4 标准反应焓变、标准反应熵变、标准吉布斯自由能变和标准平衡常数的计算
(4)
(5)
(6)
(7)
式中:R为标准摩尔气体常数;nB为参与反应的各物质的化学计量系数。
1.5 反应热力学计算结果分析


图2 不同温度下反应的

(8)

由式(8)可知,由于气相CO2作为反应物参与反应,提高反应系统CO2的分压可以促进主反应的进行,因此在后续动力学试验中,压力选取为3 MPa。此外,低温有利于提高平衡转化率,使EO的转化程度提高。
2 反应动力学试验
2.1 装置及流程
为测定EO与CO2酯化加成为EC宏观反应动力学数据,在工业试验装置(图3)上进行了动力学试验。该装置由原料储存和定量输送系统、预热系统、反应系统、产品储存和定量输送系统、温度和压力控制系统组成,产物采集在出料泵后由取样管线实现。
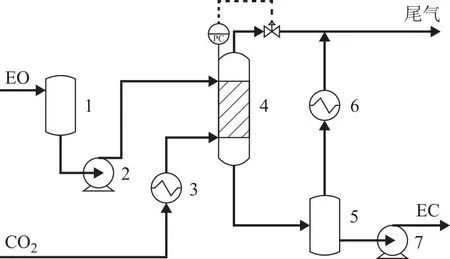
图3 EO与CO2合成EC的工业试验装置
来自界区外的原料EO经过增压泵泵入反应器,与经预热后进入反应器的CO2接触,在压力3 MPa、温度100 ℃下发生催化反应,反应产物进入产物储罐,由泵送出界区。整个系统的压力由反应器顶部的压力调节阀控制,未反应的CO2和不凝气送出界区,达标后排放。催化剂为复合材料型球形颗粒,由中石化(上海)石油化工研究院有限公司生产。工业试验过程中,EO进料量为29.0~87.5 kg/h,CO2进料量为EO进料量的1.5倍。产物样品在泵后取样口处用玻璃取样瓶密闭液体取样,取样按GB/T 6681—2003标准要求进行。取样前充分置换3次以上以保证样品具有代表性,每个停留时间下取样次数不少于10次,剔除明显误差后将其余样品的平均值作为样品测试结果。
2.2 分析方法
反应原料中主要含有EO,反应液相产物中主要含有EO、EC,以及极微量的EG,DEG,TEG,H2O等。样品利用美国Agilent 公司制造的GC 7890气相色谱仪进行检测,检测器为氢火焰离子化(FID)检测器,采用HP-FFAP (50 m×0.32 mm×0.50 μm)毛细管色谱柱测定全部组分的峰面积,并以校正面积归一化法计算所有组分的含量。典型的操作条件如下:以N2作为载气,初始柱温为100 ℃,采用程序升温控制,以30 ℃/min升到220 ℃,保持6 min,汽化室和检测室的温度为300 ℃。最后用碳平衡的方法校核反应进出口物料平衡。
3 反应动力学建模
3.1 动力学参数求解
以离子交换树脂为非均相催化剂催化的EO与CO2酯化加成为EC的反应过程中,CO2相对于EO大大过量,只要保证反应系统中CO2的分压足够,可以认为主反应速率对CO2的浓度是零级。EO与CO2的反应为亲核加成反应,其反应速率对EO为一级[5,12,24]。在微量水的存在下,EO开环水合、EC水解和聚合副反应极少发生,在整个反应中占比不足0.25%,极微量的副产物对系统的动力学行为没有显著影响。其次,副反应的存在不改变主反应的催化机理,因而不会改变主反应级数。副反应对主反应的影响体现在主反应速率常数(k)中。因此,可以将多个副反应“集总”到主反应中来以简化反应网络、降低模型的复杂性,同时仍考虑副反应对主反应的总体影响。根据图1所示的反应路径,以离子交换树脂为非均相催化剂催化的EO与CO2酯化加成为EC的主反应宏观动力学模型如式(9)~式(10)所示。
rEO=-kcEO
(9)
rEC=kcEO
(10)
上述动力学模型中k受反应条件(温度、压力、催化剂种类和浓度等)的影响,需要确定,为了获得离子交换树脂为非均相催化体系的速率常数k值,在压力为3 MPa、温度为100 ℃下进行了不同停留时间下的动力学试验。k由反应组分摩尔分数的残差平方和(S)最小来确定,由MATLAB的Lsqnonlin函数搜索S的最小值实现,如式(11)所示。
(11)
得到的k及其在95%置信水平下的置信区间为(3.227 9±0.248 2)h-1,可以发现其置信区间远小于速率常数估计值。拟合结果如图4所示,由图4可以看出,通过拟合得到的计算值与试验值吻合良好,说明模型能很好地预测反应过程中组分摩尔分数的变化。对应的宏观动力学模型参数统计检验结果如表3所示,其中Ne为试验次数,Np为参数个数,F值为回归均方与模型计算误差均方和之比,ρ2为决定性指标,F0.05为相对水平5%相应自由度下的F值。一般认为当F值大于10倍的F0.05,ρ2大于0.9时,模型是可靠的。由表3可以看出,从统计学的角度来看,该模型的速率常数的模拟值是可靠的。

表3 宏观动力学模型参数统计检验结果

图4 反应物EO和产物EC的试验值与计算值的比较
3.2 动力学模型验证
使用EC作为动力电池电解液溶剂时对其纯度要求较高,若反应生成的EC摩尔分数较高,就可以大大降低后续分离精制过程中的能耗。某企业要求反应器出口EC摩尔分数大于98.90%,由动力学模型计算和工业试验结果可知,单个反应器在停留时间为6 h时,出口产物中EC的摩尔分数为95.64%,不能满足企业要求,需对反应器进行改造。
企业要求工艺改造需保证反应停留时间不变。在保持停留时间不变前提下,为提高EC收率,需要提高反应釜中EO的平均浓度,因此设计采用双釜串联代替单釜操作以满足企业工艺改造要求。由所建反应动力学模型可知,EO转化为EC的反应为一级反应,而双釜串联进行一级反应时,当两釜容积相等时所需总反应器体积最小。因此,反应器改造为两个等体积反应器串联操作为最佳选择。反应器改造完成并稳定运行一定周期后,宏观动力学模型的计算值与工业试验值(总停留时间为6 h)的比较结果如图5所示。由图5可以看出,工业试验值和模型计算值吻合良好,第二反应器出口产物中EC摩尔分数计算值为98.91%,与工业试验值误差小于0.12%,且均满足企业要求,说明所建立的宏观反应动力学模型是准确可靠的。

图5 单釜和双釜串联反应器中反应物和产物的计算值与工业试验值比较
4 结 论
通过热力学公式计算分析了不同温度下EO与CO2酯化加成为EC主副反应的热力学数据,结果表明,在该反应过程中,除EC水解为吸热反应外,其他反应均为强放热反应,反应过程需要采取有效的换热措施以保证反应过程的温度稳定;所有副反应均可以自发进行,而主反应受温度的影响较大,温度高于100 ℃时不能自发进行,需要采取提高反应压力等措施来促进主反应的进行。
在工业试验装置上建立了EO与CO2酯化加成为EC主反应宏观动力学模型,通过对试验数据回归得到了该反应的动力学参数,并用工业数据进行了验证。结果发现:宏观动力学模型计算值与试验值拟合的决定系数ρ2为0.999 9,说明所建模型的计算结果是可靠的;单反应器出口产物纯度难以满足要求;在进行等体积双反应器串联操作时,出口产物的EC纯度可满足要求,第二反应器出口产物中EC摩尔分数达98.91%,模型计算值与工业试验值误差小于0.12%。
