大肠杆菌多酚氧化酶的分子克隆及异源高效表达
2024-03-11邹成义范景胜倪青松郑钰嘉
邓 卉, 余 丹, 邹成义, 范景胜, 李 斌, 屈 东, 倪青松, 郑钰嘉, 陈 瑾
(四川省畜牧科学研究院,动物遗传育种四川省重点实验室,四川成都 610066)
优质饲料资源高度依赖进口, 使我国饲料产业发展极度受制于国外供应端的稳定性、 安全性和经济性。2022 年,国家发改委修订印发的《产业结构调整指导目录》 中将饼粕等粮油加工副产物综合利用关键技术开发应用列入鼓励类条目。 菜籽粕、 棉籽粕是我国常见的饼粕类粮油加工副产物,也是最常见的非粮饲料资源,但由于其富含多酚等抗营养因子,在商品饲料中的用量十分有限。目前利用微生物发酵产生的酶蛋白来降解酚类抗营养因子是最安全、最有效的技术手段。
本课题组前期筛选出的一株大肠杆菌SDB2已被证实能通过分泌多酚氧化酶来降解芥子碱等酚类物质,但由于野生菌产酶效率低,纯度不高,不能满足商业化应用。 通过基因工程技术克隆多酚氧化酶基因、 构建重组菌株可以实现多酚氧化酶的高效表达。据报道,目前除了在苹果、杏、杨树等植物中克隆出了多酚氧化酶基因 (吴瑜凡等,2008),还有研究者在双孢蘑菇、白腐菌等真菌中也克隆出了多酚氧化酶基因(Halalouili 等,2006;Wichers 等,2003),但关于细菌多酚氧化酶的克隆研究罕见报道。在基因重组表达体系中,诱导剂和温度是影响表达效果的两个重要因素。 本研究将SDB2 多酚氧化酶基因重组表达到大肠杆菌BL21中, 同时研究温度和IPTG 浓度两个因素对表达量的影响,确定最佳诱导表达条件,为SDB2 多酚氧化酶在饲料工业上的规模应用奠定基础, 为实现菜籽粕、 棉籽粕等非粮饲料资源的高效利用提供技术参考。
1 材料与方法
1.1 试验材料
1.1.1 菌种与质粒 本课题组前期筛选保藏的大肠杆菌SDB2,质粒pET28a,大肠杆菌(Escherichia coli)BL21 均购自生工生物工程公司。
1.1.2 试剂与工具酶 Taq DNA 聚合酶、dNTP、PCR 凝胶回收试剂盒、质粒提取试剂盒均购自生工生物工程公司,其他试剂均为国产AR 试剂。
1.1.3 LB 培养基 胰蛋白胨10 g/L、 酵母浸粉5 g/L、氯化钠10 g/L。
1.2 SDB2 基因组DNA 提取 SDB2 基因组DNA 提取按照FineMag 磁珠法通用型基因组DNA 提取试剂盒的说明书操作, 采用Purifier32全自动核酸提取仪提取,获得的DNA 样品用封口膜封存于-20 ℃。
1.3 SDB2 多酚氧化酶基因PCR 扩增 根据SDB2 多酚氧化酶基因设计引物, 开展两轮PCR反应,一轮反应体系(扩增模板DNA)为:双蒸水41 μL、 模板DNA 2 μL、DNA 聚合酶1 μL、Buffer10×5 μL、dNTP 1 μL;PCR 反应参数:96 ℃5 min;96 ℃22 s,60 ℃22 s,72 ℃25 s,22 个循环;72 ℃1 min。 二轮反应体系为: 双蒸水39 μL、首尾引物各1 μL、 一轮模板DNA 2 μL、DNA 聚合酶1 μL、Buffer10×5 μL、dNTP 1 μL;PCR 反应参数:96 ℃5 min;96 ℃22 s,62 ℃22 s,72 ℃25 s,23 个循环;72 ℃1 min。 PCR 产物采用0.8%的琼脂糖凝胶电泳检测,切胶纯化目的条带。
1.4 重组菌株构建 将纯化后的PCR 产物酶切后与表达载体pET28a 连接,转化至大肠杆菌BL21 感受态细胞,42 ℃热激后涂布在含有30 μg/mL 卡那霉素的LB 平板培养基上,37 ℃培养12 h。挑选出阳性重组菌株,提取重组菌株质粒进行单、双酶切验证。
1.5 克隆基因生物信息学分析 单、双酶切验证克隆基因后,委托生工生物工程公司测序,对测序结果采用ExPASy 在线服务器推导出表达氨基酸的序列、相对分子质量、理论等电点,并将重组氨基酸序列提交SWISS-MODEL 蛋白质建模服务器进行同源建模, 预测出SDB2 重组多酚氧化酶晶体三维结构。
1.6 SDB2 多酚氧化酶基因的高效表达
1.6.1 基因工程菌 选择1.4 中经PCR 鉴定为阳性、 质粒经酶切验证为SDB2 多酚氧化酶基因的重组基因工程菌株开展多酚氧化酶的高效诱导表达试验。
1.6.2 试剂 LB 肉汤琼脂培养基、 卡那霉素、诱导剂IPTG、TMB 显色试剂盒、Western Blot 一抗、Western Blot 二抗均购自生工生物工程公司;其他试剂均为国产AR 试剂。
1.6.3 SDB2 多酚氧化酶基因高效表达的诱导条件筛选 将重组菌株接种到含有30 μg/mL 卡那霉素的LB 液体培养基中培养, 当OD 值达到0.6时, 设置不同诱导条件诱导多酚氧化酶基因高效表达。 采用“2×2”交叉试验设计,以温度和诱导剂IPTG 浓度两个因素作为重组菌株多酚氧化酶基因表达的影响因素,温度和IPTG 浓度分别设计2个水平,详见表1。 未添加诱导剂为阴性对照组。

表1 诱导试验设计
诱导培养结束后,收集部分培养菌液制样。将剩余菌液4000 r/min 离心10 min, 收集上清液和部分菌体沉淀制样。 向剩余菌体沉淀添加Tris-NaCl buffer 悬浮,超声破碎,离心收集上清和沉淀分别制样。对前述制样(未诱导样品、诱导后菌液、破碎前上清、破碎前沉淀、破碎后原液、破碎后上清、破碎后沉淀)采用SDS-PAGE 和WB 双重验证目标酶蛋白,确立最佳诱导条件。
SDS-PAGE 检测: 对蛋白样品进行处理制样后,选用12%分离胶、5%浓缩胶来跑胶检测出目标蛋白分子质量。 WB 检测:将SDS-PAGE 分离的蛋白样品转移到硝酸纤维素薄膜上,与对应的WB 一抗(兔抗His 标签)起免疫反应,再与WB 二抗(羊抗兔)起反应,经过放射自显影检测出目标酶蛋白。1.6.4 高效表达并纯化多酚氧化酶蛋白 依据确立的最佳诱导条件诱导重组菌株大量表达多酚氧化酶蛋白后,采用镍柱纯化亲和层析法纯化目标酶蛋白, 纯化过程中添加内毒素去除缓冲液:50 mmol Tris-300 mmol NaCl,1%tritonX-114,pH 8.0; 平衡缓冲液:50 mmol Tris-300 mmol NaCl ,pH 8.0;清洗缓冲液:50 mmol Tris-300 mmol Na-Cl,pH 8.0 和20/50 mmol imidazole; 洗脱缓冲液:50 mmol Tris-300 mmol NaCl,pH 8.0 和500 mmol imidazole。制样,采用SDS-PAGE 和WB 双重验证经纯化的目标酶蛋白。
2 结果与分析
2.1 构建SDB2 多酚氧化酶基因重组菌株 SDB2多酚氧化酶基因经提取、扩增、纯化后连接质粒载体pET28a,转化至大肠杆菌BL21 构建重组菌株,提取重组菌株质粒进行酶切验证的结果如图1 所示,得到一条741 bp 和一条5400 bp 的基因条带,与预期结果相符,说明成功构建出重组菌株。

图1 重组质粒酶切验证图
2.2 克隆基因生物信息学分析 对克隆出的SDB2 重组多酚氧化酶基因进行生物信息学分析,发现该基因含目标核苷酸741 个,总编码氨基酸263 个(含标签氨基酸20 个),氨基酸组成的蛋白相对分子质量为28499.0, 理论等电点为6.94。进一步对SDB2 重组多酚氧化酶基因编码的氨基酸序列开展三维结构预测分析,进入Swiss-Model三维结构预测服务器, 提交该重组基因编码的氨基酸序列,结果如图2 所示。 SDB2 重组多酚氧化酶蛋白三维结构模型的建立是以1u05.1.A 为模板, 一致性达97.94%,GMQE 值为0.90,QMEAN值为(0.92±0.05)。

图2 SDB2 重组多酚氧化酶蛋白的三维预测结构
2.3 确立SDB2 多酚氧化酶基因高效表达的诱导条件
2.3.1 不同诱导条件下多酚氧化酶基因表达的SDS-PAGE 分析 采用SDS-PAGE 对4 种不同诱导条件下的7 种性状样品进行验证, 结果显示(图3 ~ 图6): 未经IPTG 诱导的样品(A1、B1、C1、D1)无特异条带出现,不同诱导条件下的破碎前上清样品(A3、B3、C3、D3)均无蛋白表达,而4种不同诱导条件下的诱导后菌液、破碎前沉淀、破碎后原液、破碎后上清、破碎后沉淀均在蛋白标准分子质量25 ~35 KD 产生1 条特异的蛋白条带,与预期蛋白大小(28KD)一致,初步判断重组菌株成功在胞内表达出多酚氧化酶蛋白。 进一步分析可知,“37 ℃,1 mmol IPTG” 诱导条件下的B2、B4、B5、B6、B7 多酚氧化酶表达量均高于其他3个诱导条件下对应性状样品的表达量, 而载体为上清液的可溶性多酚氧化酶蛋白B6 对后续的纯化提取工艺要求更简单、易操作,成本更低,因此选择样品B6 的生产方法作为重组菌株高效表达SDB2 多酚氧化酶的诱导条件, 有利于实现规模化应用生产。

图3 “37 ℃,0.2 mmol IPTG”诱导表达SDS-PAGE 结果

图4 “37 ℃,1 mmol IPTG ”诱导表达SDS-PAGE 结果
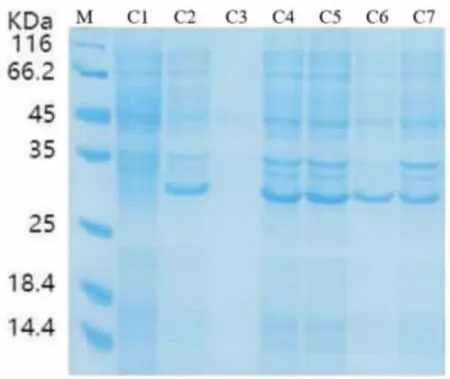
图5 “15 ℃,0.2 mmol IPTG”诱导表达SDS-PAGE 结果

图6 “15 ℃,1 mmol IPTG ”诱导表达SDS-PAGE 结果
2.3.2 不同诱导条件下多酚氧化酶基因表达的WB 分析 继SDS-PAGE 分析后, 再采用WB 对4 种不同诱导条件下的7 种性状样品进行二次验证,结果显示(图7 ~ 图10),未经IPTG 诱导的样品无特异条带出现, 不同诱导条件下的破碎前上清样品均无蛋白表达, 而4 种不同诱导条件下的诱导后菌液、破碎前沉淀、破碎后原液、破碎后上清、 破碎后沉淀均在蛋白标准分子质量25 ~35 KD 产生1 条特异的蛋白条带, 与预期蛋白大小(28KD)一致,二次验证充分说明重组菌株成功在胞内表达出多酚氧化酶蛋白。 进一步分析可知,“37 ℃,1 mmol IPTG” 诱导条件下的B2、B4、B5、B6、B7 多酚氧化酶表达量均高于其他3 个诱导条件下对应性状样品的表达量, 而载体为上清液的可溶性多酚氧化酶蛋白B6 对后续的纯化提取工艺要求更简单、易操作,成本更低,因此选择样品B6 的生产方法作为重组菌株高效表达多酚氧化酶的诱导条件,有利于实现规模化应用生产。由此可见,WB 二次验证结果与上述SDS-PAGE 分析结果一致,充分证实选择“37 ℃,1 mmol IPTG”获得菌体破碎后上清液的生产方法可作为多酚氧化酶高效表达的最佳诱导条件。
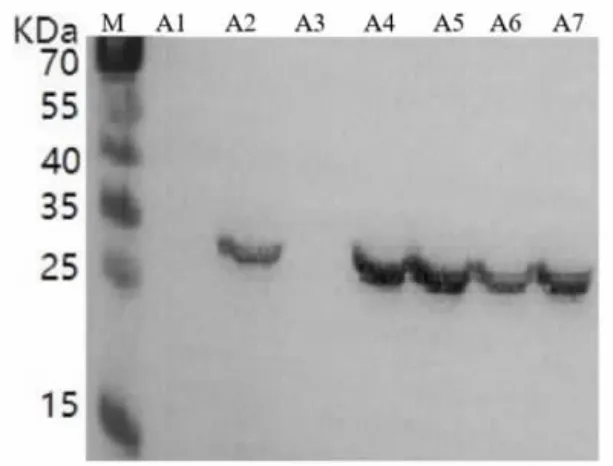
图7 “37 ℃,0.2 mmol IPTG”诱导表达WB 结果
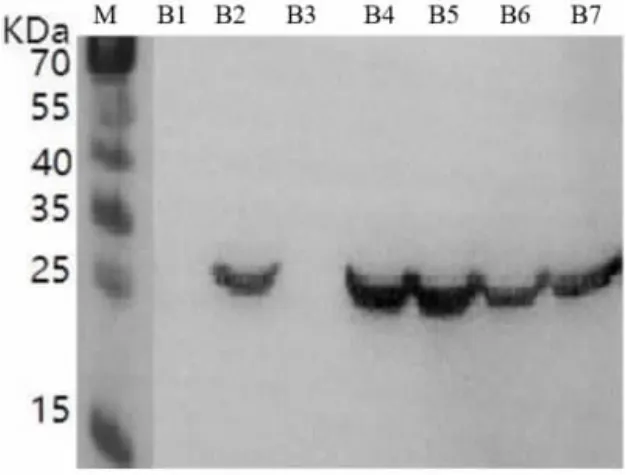
图8 “37 ℃,1 mmol IPTG ”诱导表达WB 结果
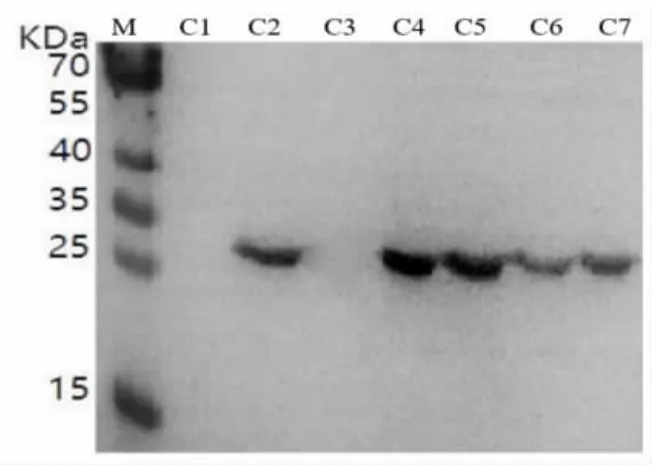
图9 “15 ℃,0.2 mmol IPTG”诱导表达WB 结果

图10 “15 ℃,1 mmol IPTG ”诱导表达WB 结果
2.4 高效表达并纯化多酚氧化酶蛋白 依据2.3中确立的最佳诱导条件“37 ℃,1 mmol IPTG”诱导SDB2 多酚氧化酶蛋白大量表达后, 对重组菌株破碎后上清液采用镍柱纯化亲和层析法纯化目标酶蛋白,结果如图11 所示,样品S 在SDS-PAGE 和Western 分析图中均在蛋白标准分子质量25 ~35 KD 产生1 条特异的蛋白条带,与预期蛋白大小(28 KD)一致,说明重组菌株采用前述诱导和纯化工艺,最终成功获得目标多酚氧化酶蛋白。

图11 最终纯化蛋白SDS-PAGE和Western 分析图
3 结论与讨论
本研究将课题组前期筛选出的大肠杆菌SDB2 的多酚氧化酶基因克隆到表达质粒pET28a,转化至宿主E.coli BL21 中,成功构建出SDB2 多酚氧化酶基因重组菌株。 以温度和IPTG浓度作为影响因素设置不同诱导条件诱导多酚氧化酶基因在重组菌株中高效表达,对表达蛋白采用SDS-PAGE 和WB 进行双重验证,确立SDB2 多酚氧化酶高效表达的最佳诱导条件为“37 ℃,1 mmol IPTG”,最终在该诱导条件下成功纯化出SDB2 多酚氧化酶蛋白。
陈卫等(2002)将嗜热脂肪芽孢杆菌IAM11001的半乳糖苷酶基因克隆到表达质粒pET-28 (b)并转化至宿主E.coli BL21 后,采用单因素试验设计来探寻该重组菌表达半乳糖苷酶基因的最适IPTG 浓度,结果表明IPTG 浓度为0.8 mmol 时,基因的蛋白表达量最大。 张强(2010)研究表明,耐热淀粉酶重组大肠杆菌BL21-amylase 高效表达酶蛋白的最佳诱导温度为37 ℃、IPTG 浓度为0.6 mmol。Kamna等(2012) 采用表达质粒pGEX-2T 和宿主E.coli BL21 高效表达木聚糖酶基因的研究结果显示,1 mmol IPTG 诱导的酶蛋白表达量为1.6%, 远低于0.01 mmol IPTG 的诱导表达量12.7%, 该试验条件下的IPTG 添加量在极低浓度下能达到更好的效果。 Cui 等(2011)将嗜冷单胞菌的脂肪酶基因克隆到质粒pColdI 并转化至宿主E.coli BL21 后, 摸索出脂肪酶基因在重组菌中高效表达的最佳温度为35 ℃。 本研究以课题组筛选的一株大肠杆菌SDB2的多酚氧化酶基因为研究对象,采用BL21/pET28a作为表达载体, 以温度和IPTG 浓度两个因素设计“2×2”交叉试验,研究该重组基因高效表达酶蛋白的最佳条件, 结果表明该基因在BL21 中实现了胞内分泌酶蛋白,在“37 ℃,1 mmol IPTG”条件下表达出大量可溶性酶蛋白,避免了包涵体酶蛋白的复杂提纯工艺,有利于应用生产。
综上所述, 本研究运用基因工程技术成功将能有效降解芥子碱、 棉酚的SDB2 多酚氧化酶基因克隆、异源高效表达,为多酚氧化酶实现规模化生产打下坚实的基础, 为提高我国非粮饲料资源利用率、 缓解饲料原料高度依赖进口的现状提供了技术解决方法。
