一株新发现虾源高致病性拟态弧菌全基因组特性的比较分析
2024-03-09杨倩贺扬王均古从伟吕沐瀚余泽辉
杨倩,贺扬,王均,古从伟,吕沐瀚,余泽辉,4*
(1.西南医科大学模式动物与人类疾病研究泸州市重点实验室,四川 泸州 646000;2.内江师范学院长江上游鱼类资源保护与利用四川省重点实验室,四川 内江 641000;3.西南医科大学附属医院,四川 泸州 646000;4.浙江大学基础医学院,杭州 310012)
拟态弧菌(Vibrio mimicus,V.mimicus)是一种重要的人和水生动物共患病原菌,与霍乱弧菌的亲缘关系极近,该菌广泛分布于水环境中[1]。拟态弧菌是重要的水生动物病原菌,可感染华绒螯蟹[2],黄颡鱼[3],罗非鱼[4]等;同时人类误食被拟态弧菌污染的水产品会导致严重的食物中毒,临床症状主要表现为腹泻、腹痛、恶心、呕吐、发热等[5-8]。由于水产养殖规模的扩大,以及人类活动的影响,水生动物感染拟态弧菌所导致的发病率和死亡率也逐年上升,这不仅给水产养殖业造成了巨大的经济损失,也严重威胁到了公共卫生安全。因此,加强对拟态弧菌的认识与研究,进一步了解其生物学特性和致病机制等,对拟态弧菌的临床诊断和防控具有重要意义。
红体病(red body disease)是虾类养殖过程中最常见多发的疾病之一。近年来,随着养虾规模的不断扩大,集约化程度的不断提高,发病率也在逐年上升。虾类红体病及红体症状的病因至今尚未明确,病毒、细菌和环境等因素均可能致病[9]。研究表明,多种弧菌可能引起虾类红体病[10-11],拟态弧菌也是日本沼虾红体病的病原之一[12]。2020年扬州大学从红体病发病的日本沼虾体内分离鉴定到一株拟态弧菌,确定为高致病性菌株,命名为拟态弧菌Y4菌株,并对其进行了全基因组测序[13]。为了更好地了解虾源拟态弧菌 Y4菌株的生物学特性和致病机制,本研究对Y4菌株和NCBI(National Center for Biotechnology Information)上已公布的其他6株拟态弧菌(分别来自人源、鱼源和环境)菌株的全基因组序列,进行了初步的比较基因组学研究。
1 材料和方法
1.1 研究对象
本研究的研究对象为NCBI公布的所有拟态弧菌菌株的全基因组序列,各个菌株的详细信息见表1。
1.2 基因组统计分析
使用seqkit v2.3.0软件[14]对V.mimicus全基因组的GC含量,基因组长度,编码序列数量,编码序列平均长度进行统计分析。统计结果使用R语言中的ggpubr包绘制箱线图[15]。
1.3 tRNA分析
使用tRNAscan-SE v2.0.11(http://lowelab.ucsc.edu/tRNAscan-SE/)软件[16]对拟态弧菌基因组序列中的tRNA序列进行预测(tRNAscan-SE -B -I -o output.txt -f structure.txt -m summary.txt input.fasta)。使用R语言中的pheatmap包对各个菌株的tRNA数量进行可视化分析。
1.4 可移动基因元件分析
使用IntegronFinder 2.0 软件(https://github.com/caozhichongchong/I-VIP)[17]对各个菌株的整合子(integrons)基因进行分析。细菌基因组的整合子结合元件(integrative and conjugative elements,ICE)的分布使用ICEfinder在线分析软件进行注释[18](https://bioinfo-mml.sjtu.edu.cn/ICEfinder/ICEfinder.html)。使用ISfinder (https://www-is.biotoul.fr/index.php)在线分析工具的默认参数对细菌基因组的插入序列(insertion sequences,IS)进行分析,分析结果以Evalue<0.000 1进行过滤,最后通过R语言对各个菌株基因组的IS的数量进行统计,使用ggplot2包进行可视化分析。
1.5 耐药基因注释
使用RGI v6.0.2(https://card.mcmaster.ca/analyze/rgi,resistance gene identifier)分析软件对综合抗生素抗性数据库(Comprehensive Antibiotic Resistance Database,CARD)的非冗余基因进行比对来鉴定抗生素基因(antibiotic resistance gene,ARG)[19]。
1.6 毒力因子注释和网络分析
毒力因子注释:下载细菌毒力因子数据库[20](virulence factor database,VFDB)中蛋白序列全库文件(http://www.mgc.ac.cn/VFs/,VFDB_setB_pro.fas)。使用Diamond v2.0.15[21]软件对下载的VFDB蛋白序列进行建库,然后将细菌的蛋白序列与VFDB进行比对,比对结果以P-ident>70进行过滤。最后使用过R语言的ggplot2包对各个菌株毒力因子的数量进行统计绘图。
毒力因子网络分析:使用seqkit v2.3.0提取VFDB数据进行比对的蛋白序列,然后使用Diamond软件对提取的蛋白序列进行比对和过滤(P-ident>70),最后使用Cytoscape软件[22]对比对结果进行网络绘图。
1.7 前噬菌体和CRISPR预测
使用前噬菌体在线预测工具 Phage Search Tool[23](http://phast.wishartlab.com/),对各个菌株前噬菌体进行预测。获取完整的前噬菌体序列进行BLAST比对,将比对结果以P-ident>70,Alignment length>500 bp进行过滤,最后将比对过滤的结果使用Cytoscape软件进行网络分析。使用CRT工具对(http://www.room220.com/crt/)重复序列和间隔序列进行预测分析[24]。
1.8 重复序列预测
使用TRF(Tandem Repeat Finder)v4.09软件[25]对各个菌株的串联重复序列进行预测分析。
2 结果与分析
2.1 基因组结构分析
通过对7株拟态弧菌菌株的基因组长度、GC含量、编码序列(CDS)数量和编码序列(CDS)平均长度进行分析(图1)。我们发现7株拟态弧菌的GC含量差异不大,且离散度不高,尤其是Ⅰ号染色体的GC含量。Y4菌株Ⅰ&Ⅱ号染色体的GC含量分别为46.58和45.67。然而7株拟态弧菌的基因组长度、CDS数量和CDS平均长度个体差异却相对较大,且离散度高。Y4菌株的Ⅰ号染色体(Chromosome Ⅰ)长度是7株拟态弧菌中最长的,为3 256 425 bp,且编码序列也是最多的,为3 067个。相反,Y4 菌株Ⅱ号染色体(Chromosome Ⅱ)长度最短,为1 082 652 bp,编码序列最少,为1 003个。

图1 致病弧菌的基因组统计分析Figure1 Genomic statistical analysis of pathogenic Vibrio
2.2 转运RNA分析
转运RNA(transfer ribonucleic acid,tRNA)是一种小的RNA分子,在蛋白质的合成中起着关键作用。分析结果显示,在Ⅰ号染色体上,7株拟态弧菌都含有22种氨基酸的转运RNA,但不同菌株在不同tRNA的数量上存在细微差异,如Y4菌株Leu(亮氨酸),Arg(精氨酸)和Gly(甘氨酸)的tRNA数量与其他6株拟态弧菌菌株略有不同(图2A)。在Ⅱ号染色体上,7株拟态弧菌都只存在3种类型的转运RNA,且数量完全一致,均含有2个Cys(半胱氨酸),1个Gly(甘氨酸)和1个Leu(亮氨酸)的tRNA(图2B)。

图2 拟态弧菌菌株的tRNA分析Figure 2 tRNA analysis of V.mimicus strains
2.3 可移动基因元件分析
本研究对7株拟态弧菌菌株的整合子、整合性接合元件和插入序列进行了分析。结果显示,所有菌株的整合子和整合性接合元件没有明显差异(此处结果没有展示)。不同菌株在不同插入序列上数量都不相同(图3)。在Ⅰ号染色体上,7株拟态弧菌都具有数量相对较多的IS5家族插入序列,数量均在10左右,除了SCCF01菌株。在Ⅰ号和Ⅱ号染色体上,7株拟态弧菌的IS66、IS1182、IS630、IS30、IS110、IS21、ISAs1家族插入序列的数量都偏少或是没有,数量在0~4范围内。

图3 拟态弧菌菌株插入序列(IS)统计热图Figure 3 Insertion sequence (IS) heatmap of V.mimicus strains
值得注意的是,与其他6株拟态弧菌菌株相比,Y4菌株IS3家族的插入序列在两条染色体上都明显增多,数量分别为26和21。其余菌株虽然也会存在数量相对较多的插入序列家族,但一般数量都在10左右,甚至没有达到20的。由此可见Y4菌株IS3家族插入序列的数量,与其余6株拟态弧菌存在明显差异。
2.4 耐药基因注释
使用RGI v6.0.2软件和CARD数据库对各个菌株的基因组进行耐药基因注释(表2)。结果显示7株拟态弧菌菌株的基因组中都存在6种耐药基因(表2),涉及糖肽类(glycopeptide)、氟喹诺酮类(fluoroquinolone)、二氨基嘧啶类(diaminopyrimidine)、氯霉素类(phenicol)、大环内酯类(macrolide)和碳青霉烯类(carbapenem),且全部位于I号染色体。

表2 拟态弧菌耐药基因注释Table 2 Annotations on drug resistance genes of V.mimicus strain
2.5 毒力因子注释
细菌的毒力因子分为黏附素(adherence)、生物被膜(biofilm)、效应物递送系统(effector delivery system)、外毒素(exotoxin)等。研究结果显示Y4菌株在毒力基因的种类和数量上与其他拟态弧菌菌株相比没有明显差异(图4)。为此我们进一步对各个菌株毒力因子的氨基酸序列进行了Diamond比对,将比对结果进行网络分析,筛选出各个菌株的唯一毒力因子。Y4菌株的唯一毒力因子共有11个(图5红色方框,单独点表示没有蛋白序列与其比对的P-ident值大于70,即不与其他菌株的毒力因子同源),包括5个外毒素(RtxA、RtxB、RtxC、RtxD、RtxH),3个运动能力相关(cheV3),2个黏附素(flp1和flpF)和一个被膜形成相关基因。与此同时,Y4菌株也丧失了部分其他6个菌株都拥有的基因,分别是Ⅲ型分泌系统分泌素、甲基化趋化受体蛋白McpU、染色体分配蛋白Smc、唾液酸酶、胞内血红素转运蛋白HutX、血红素转运系统渗透酶蛋白HmuU、血红素转运ATP结合蛋白HmuV,以及两个假定蛋白。

图4 拟态弧菌菌株的毒力因子统计分析Figure 4 Statistical analysis of virulence factors for V.mimicus strains

图5 拟态弧菌菌株毒力因子蛋白序列的网络分析Figure 5 Network analysis of virulence factor protein sequences of V.mimicus strains
2.6 前噬菌体和CRISPR预测
使用Phage Search Tool软件对7株拟态弧菌菌株的全基因组序列进行前噬菌体预测。结果显示所有拟态弧菌菌株基因组中均含有前噬菌体。Y4菌株的Ⅰ号染色体含有4个前噬菌体(2个完整和2个不完整),Ⅱ号染色体含有1个前噬菌体(不完整)。提取拟态弧菌菌株的完整前噬菌体序列进行BLASTn比对,将比对结果按照P-ident>70和Alignment length>500的阈值进行过滤(该阈值设置为是否同源),然后使用cytoscape进行网络分析。结果显示Y4菌株基因组上存在一个基因长度较大的前噬菌体,且与其他6株拟态弧菌的前噬菌体没有同源关系(图6箭头所示)。

图6 拟态弧菌菌株完整前噬菌体的BLASTn比对分析Figure 6 BLASTn analysis of complete prophages of V.mimicus strains
CRISPR序列预测结果显示,7株拟态弧菌中,仅Y4菌株基因组上存在CRISPR序列,其余6株基因组上均不存在CRISPR序列。为了进一步了解拟态弧菌中CRISPR序列的分布情况,我们扩大分析范围,对已公布的29株拟态弧菌(包括基因草图)进行CRISPR序列预测,发现有3株拟态弧菌基因组上存在CRISPR序列。分别是VM603菌株(268 bp,5 repeats),N2810菌株(1 049 bp,18 repeats),和Y4菌株(2 368 bp, 40 repeats)。
2.7 重复序列分析
使用TRF软件对7株拟态弧菌菌株的重复序列进行了分析(表3)。结果显示,在Ⅰ号染色体上,拟态弧菌重复序列的数量、总长度和基因组占比均差异较大,Y4菌株重复序列的数量最高,为107条,但总长度和基因组占比却没有因此成为最高。推测Y4菌株中Ⅰ号染色体重复序列增多可能与CRISPR序列的存在有关。在Ⅱ号染色体上,7株拟态弧菌重复序列的数量差异不大,但总长度和基因组占比差异较大,Y4菌株重复序列的总长度是所有菌株中最低的,为8 075 bp。
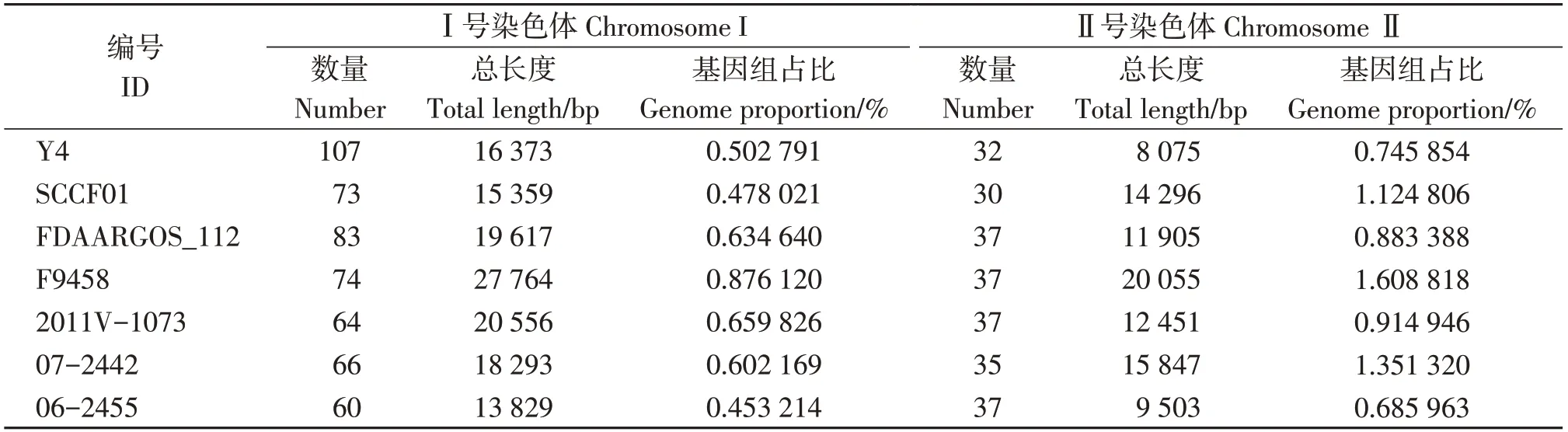
表3 拟态弧菌菌株的重复序列分析Table 3 Repetitive sequence analysis of V.mimicus strains
3 讨论
拟态弧菌是一种能引起人类肠胃炎的致病菌,已被报道为虾的病原菌[26]。为了更好地了解拟态弧菌的生物多样性,以及不同菌株之间的表型特征。本研究通过比较基因组学的方法对虾源Y4菌株进行了初步研究,旨在进一步了解该菌株的生物学特性。
通过对7株具有全基因组序列的拟态弧菌进行比较发现,所有菌株基因组在耐药基因注释和转运RNA分析上,没有表现出明显差异。细菌耐药性是人类在使用抗微生物药的长期过程中细菌对人类的反抗[27]。我们的分析结果表明,Y4菌株在抗生素环境胁迫下产生的耐药基因与其余拟态弧菌差异不大。转运RNA(tRNA)是生物体内含量最为丰富的短链非编码RNA分子。尽管tRNA广泛存在于生物体内,但不同机体基因组对于特定密码子的偏好性不同,从而会导致tRNA谱的差异[28]。本研究中tRNA分析差异不大,表明7株拟态弧菌之间具有相似的生理过程。
在毒力因子注释分析中,我们对Y4菌株的唯一毒力因子进行了筛选。结果显示RtxA、RtxB、RtxC、RtxD、RtxH是Y4菌株注释出的部分唯一毒力因子。多项研究报告称,Rtx是一个蛋白质家族,大多数革兰氏阴性菌都会产生,是一种重要的毒力因子[29-31]。整个家族由6个基因组成,分别是RtxA/C/H/B/D/E,其中RtxA编码外毒素,RtxC编码RtxA激活剂,RtxH编码保守的假定蛋白,RtxB/D/E基因编码ABC(ATP Binding Cassette, ABC)转运蛋白[29]。Rtx最早在霍乱弧菌中检测到[32]。霍乱弧菌的RtxA含有肌动蛋白交联结构域(ACD),该结构域在生物体的发病机制中起着至关重要的作用[33]。RtxA可以通过逃避吞噬作用增强病原体在感染期间的存活率[34],最后协助细菌的入侵过程,将细菌从肠道转移到血液中[35]。早期的一项研究报告称,创伤弧菌的RtxA突变体在小鼠感染模型中与亲代菌株相比毒性降低。体外数据还表明,在不同宿主细胞上测试时,与亲代细菌相比,RtxA突变株具有较低的细胞毒性[30]。由此可见Y4菌株在进化过程中获得了较强的毒力,Rtx毒力蛋白也可能是虾类红体病的致病基因。与此同时,Y4菌株也丧失了部分其他6个菌株都拥有的基因,如甲基化趋化受体蛋白McpU和Ⅲ型分泌系统分泌素。分泌素是革兰氏阴性菌几种分泌系统的外膜成分。McpU与细菌生物膜形成相关[36],但是Y4菌株存在额外的与被膜形成相关的基因。Y4菌株还缺失了3种与血红素转运相关的蛋白HutX、HmuU和HmuV。血红素可被一些病原菌用作铁源,这些病原菌具有摄取血红素的系统,典型的血红素获取系统包括几种血红素结合蛋白和ABC血红素转运蛋白。ABC血红素转运蛋白HmuT-HmuUV在革兰氏阳/阴性菌中是保守的。在这个血红素转运蛋白系统中,HmuT、HmuU和HmuV分别作为底物(血红素)结合蛋白、血红素渗透酶和ATP结合蛋白[37]。相应血红素转运蛋白的缺失,表明Y4菌株对血红素的利用和铁的获取不多。
7株拟态弧菌在基因组结构上同样存在一定差异,尤其在基因组大小和编码序列的数量以及长度上。过去的研究已证明同种细菌的不同菌株之间,基因或基因拷贝数会出现很大的差异。而这种变异能显著改变菌株的多种能力,包括耐药性、毒力、从环境摄取生化分子、能量获取、移动方式等等。这些因素也决定着菌株的生活方式,并且能对宿主的健康产生影响[38]。2015年,墨西哥索诺拉州瓜伊马斯的一家虾加工厂分离出3株拟态弧菌,通过聚类分析,发现其相似性在51.3%到71.6%之间。对其中两株拟态弧菌进行了全基因组测序,发现二者蛋白质组含量(BLAST matrix)存在12.7%的差异[39],该研究进一步证实了拟态弧菌的种内多样性,即使来自同一来源。菌株水平的多样性体现了拟态弧菌对宿主、环境变化的快速适应。
基因水平转移(horizontal gene transfer,HGT)是微生物进化的一个重要机制,允许快速获得新的表型和代谢能力,通常由可移动的遗传元件驱动,这些可移动的遗传元件包括插入序列(IS)、转座子、整合子、广宿主自转移质粒、噬菌体等[40]。Y4菌株与其他6株拟态弧菌菌株相比,整合子和整合性接合元件没有明显差异,但是IS3家族的插入序列却明显增多。IS是一种广泛存在于细菌基因组中的最简单的转座元件,通过不同的转座机制在基因组内或基因组之间进行水平移动[41]。IS通过插入到编码序列中使该基因失活或是插入到编码基因的上游对该基因的表达产生影响,从而诱导耐药[42],改变毒力[43]和增强环境适应性[44]等。例如插入序列ISEcp1和ISAba1可能与β-内酰胺类抗生素耐药相关[45-47]。增多的IS3序列在一定程度上增加了Y4菌株基因组的可塑性和遗传多样性。基因水平转移可使细菌获得外源基因,而细菌的CRISPR/Cas系统可以抵御外源基因的入侵,维持自身基因结构的稳定[48]。不过有研究发现,当细菌中转入的外源基因有益时,CRISPR/Cas系统功能会缺失,使细菌通过HGT获得某些新性状;而当转入的外源基因对细菌不利时,细菌会上调CRISPR/Cas系统功能,抵制不利基因的摄入[49]。T.R.Sampson等发现CRISPR/Cas系统可调节弗朗西斯菌的胞膜渗透性使其产生相应耐药性[50]。T.Nozawa等研究还发现CRISPR-Cas系统可以使噬菌体毒力基因转入,从而使化脓性链球菌具有相应的致病性[51]。在CRISPR序列预测中,Y4菌株是拟态弧菌中为数不多的拥有CRISPR序列的菌株,预示着其对自身耐药、毒力、代谢等生理功能具有一定调控作用,CRISPR/Cas系统的出现很可能增强了Y4菌株的致病性。细菌基因组中CRISPR序列的出现通常与噬菌体感染有关[52]。在前噬菌体预测中,我们发现Y4菌株基因组上存在一种特殊的前噬菌体,与其他菌株的前噬菌体没有同源相关性。因此,推测Y4菌株中CRISPR序列的出现可能与该噬菌体的感染相关。
不同拟态弧菌菌株经过长期进化,其基因组在结构与功能上可能存在着明显的分化,通过比较不同拟态弧菌菌株基因组间的差异性与相似性,可从基因组水平深入了解拟态弧菌的环境适应、毒力进化、耐药性产生等表型进化过程,挖掘其潜在的致病机制。因此,加深对虾源拟态弧菌生物学特性及其致病机理等方面的研究,对于寻找切实有效的虾类红体病防治措施,促进水产养殖业的发展具有深远的意义。
