翘嘴鲌及翘嘴鲌“全雌1号”氨氮胁迫下的生理应答反应及耐受性分析
2024-03-09蒋文枰程顺刘士力郑建波迟美丽杭小英彭苗李飞
蒋文枰,程顺,刘士力,郑建波,迟美丽,杭小英,彭苗,李飞
(浙江省淡水水产研究所/农业农村部淡水渔业健康养殖重点实验室/浙江省淡水水产遗传育种重点实验室,浙江 湖州 313001)
翘嘴鲌(Culter alburnusBasilewsky)俗称白鱼、白条,隶属于鲤科,鲌亚科,鲌属,是我国重要的淡水名优经济鱼类之一,以太湖产翘嘴鲌最负盛名,位列太湖三白之首[1]。具有生长快、肉质鲜嫩的特点,广泛分布于我国诸多水系[2-3]。雌鱼生长速度明显快于雄鱼,培育翘嘴鲌全雌鱼可提高单产水平[4]。采用群体选育、异源雌核发育诱导和伪雄鱼诱导等育种技术,以太湖湖州段捕捞后经以生长速度为目标性状的2代群体选育和2代异源雌核发育的翘嘴鲌子代为母本(XX),以利用性别控制技术诱导雌核发育翘嘴鲌子代获得的生理性雄鱼(XX′)为父本,经交配繁殖获得的F1,即为翘嘴鲌“全雌1号”,其生长速度较未经选育的翘嘴鲌平均提高17.0%,雌性率为99.8%[4-6]。
水生动物在水体中氨氮浓度低于耐受限度时,可进行自行调节以适应外界环境变化[7];但当受到的氨氮浓度过高或胁迫时间过长,超过机体调节阈值时,机体的抗氧化系统会受到破坏,抗氧化酶活性将下降,机体器官受损[8-9]。因此有必要对不同氨氮浓度和不同胁迫时间条件下鱼类组织器官以及抗氧化酶活性变化开展研究,以探讨在氨氮胁迫过程中鱼类的氧化应激机制,从而指导生产实际。目前,在西伯利亚鲟(Acipenser baerii)[10]、青鱼(Mylopharyngodon piceus)[11]、尼罗罗非鱼(Oreochromis niloticus)[12]及黄颡鱼(Pelteobagrus fulvidraco)[13]等淡水养殖鱼类中,已开展氨氮胁迫下免疫毒性机制等相关研究,但在鲌亚科鱼类中则未见报道。同时,肝脏在鱼体生命活动过程中发挥着重要作用,可以反映出高氨氮等不利条件下机体器官的损伤程度[14-15]。超氧化物歧化酶(SOD)作为重要的抗氧化酶,可以清除生物体内多余的自由基,SOD活性的提高有助于保护肝脏免受低氧胁迫的损伤[16-17]。养殖水体中的氨氮损害幼鱼抗氧化系统[18],高浓度氨氮急性胁迫引起仔鱼生长迟缓和氧化应激[19],超过了机体的调节能力,机体清除氧自由基的能力减弱,活性氧大量积累,造成机体氧化损伤[20],降低了其抗氧化性能,削弱了其非特异免疫防御机能[19],长期处于氨氮胁迫下将不利于幼鱼健康生长[21]。同时,持续炎症反应及抗氧化系统功能受抑制是氨氮中毒死亡的主要原因[22]。肝胰脏SOD活性能够准确反映氧化损伤的程度,可作为有效的生物标志物,对氨氮的毒性做出评价[18]。
本研究采用组织学和生理生化学方法,在不同氨氮浓度和胁迫时间条件下,氧化应激相关酶活性的测定以及肝脏组织损伤的观察,深入分析翘嘴鲌和翘嘴鲌“全雌1号”在氨氮胁迫下的生理应答反应及耐受性,有利于深入了解翘嘴鲌“全雌1号”的氨氮抗逆性,为翘嘴鲌“全雌1号”的持续选育与健康养殖提供依据,并为全雌鱼的研究提供基础生物学资料。
1 材料和方法
1.1 试验材料
试验于2022年在浙江省淡水水产研究所德清试验基地进行。试验对象为翘嘴鲌及翘嘴“全雌1号”,试验鱼鱼体规格为(4.87±0.36)g,其中翘嘴鲌“全雌1号”为浙江省淡水水产研究所牵头的水产育种协作组培育,是2020年度全国水产原种和良种审定委员会审定通过的14个国家水产新品种之一。
1.2 试验方法
试验前,将试验鱼在试验水槽中暂养72 h。试验用水为经超滤系统超滤的淡水,用分析纯氯化铵试剂(天津市恒兴化学试剂制造有限公司)调节试验组总氨氮浓度。随机挑选体色正常、健康活泼、规格相近的试验鱼移入试验水槽中,每个水槽30尾。试验前停食48 h,整个试验期间停止投饵。试验水温(21±1)℃,pH为7.5±0.5,24 h连续微充气以保证溶解氧含量7.0 mg/L以上。为保证试验用水氨氮浓度稳定,每隔4 h监测并调节总氨氮浓度,每次换水量不超过20%,并及时剔除死亡个体。试验过程中,连续观察各组试验鱼的活动及存活死亡情况,并记录各时期的死亡数。预试验结束后,采用直线内插法[23]计算得出翘嘴鲌和翘嘴鲌“全雌1号”的半致死浓度(96 h LC50)和安全浓度(SC=0.1 × 96 h LC50),分别设置对照组(0 mg/L)和低浓度组(8 mg/L)、高浓度组(16 mg/L)2个试验组,每组3个平行。
1.3 测定项目与方法
氨氮胁迫试验期间,分别于0、6、12、24、48和96 h采集试验鱼肝脏,立即放入液氮中,后将样品转移至-80 ℃超低温冰箱保存。按每克待测样组织加入9 mL生理盐水的比例配制组织匀浆液,研磨后转移至2 mL离心管中,4 ℃下3 000 r/min离心10 min,取上清液分装后放入4 ℃冰箱暂存,用于测定SOD活性。SOD均采用南京建成生物工程研究所试剂盒测定。同时,取高、低浓度氨氮胁迫0、48和96 h试验鱼肝脏,保存于波恩氏液(福州飞净生物科技有限公司)中,后经常规石蜡包埋,连续横切,切片厚度为6 μm,HE染色,显微镜观察并拍照。
2 结果与分析
2.1 急性毒性试验
采用常规生物急性毒性试验方法,研究确定氨氮对翘嘴鲌及翘嘴鲌“全雌1号”的96 h LC50。结果显示,随着氨氮浓度的增加,毒性作用增强,翘嘴鲌及翘嘴鲌“全雌1号”的死亡率随氨氮浓度的增加而增加,详见表1。同时,通过直线内插法计算得到氨氮对翘嘴鲌96 h的 LC50和SC分别为23.90 和2.39 mg/L,对翘嘴鲌“全雌1号”96 h的 LC50和SC为25.73和2.57 mg/L。
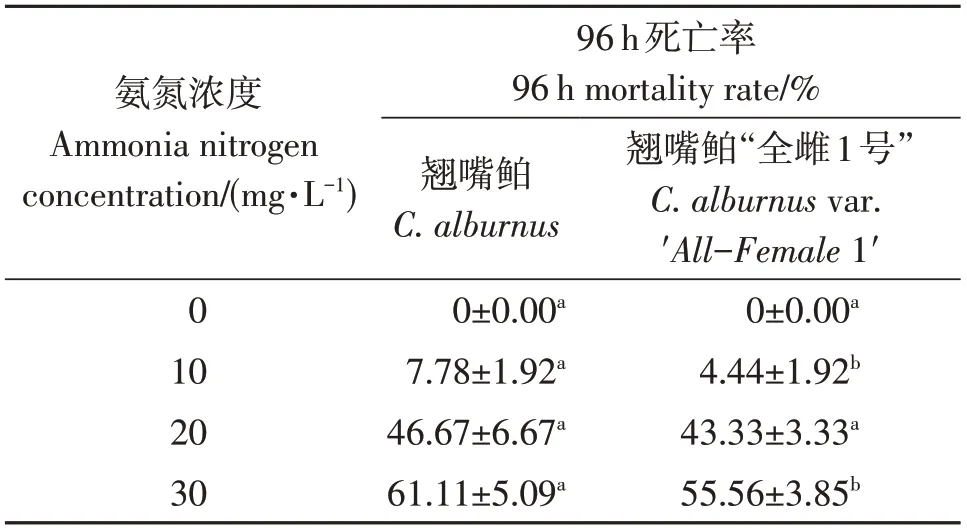
表1 0~30 mg/L氨氮胁迫96 h翘嘴鲌及翘嘴鲌“全雌1号”死亡率Table 1 0-30 mg/L ammonia nitrogen stress 96 h mortality rate of C.alburnus and C.alburnus var.′All-Female 1′
2.2 氨氮胁迫对翘嘴鲌及翘嘴鲌“全雌1号”死亡率的影响
翘嘴鲌及翘嘴鲌“全雌1号”的死亡率随氨氮浓度与氨氮胁迫时间的增加而提高。其中翘嘴鲌8和16 mg/L浓度组的96 h死亡率均显著高于胁迫24和48 h的死亡率(P<0.05);翘嘴鲌“全雌1号”16 mg/L浓度组的96 h死亡率均显著高于胁迫24和48 h的死亡率(P<0.05)。在氨氮浓度为8 mg/L时,翘嘴鲌“全雌1号”均无死亡,但翘嘴鲌在96 h时有少量死亡;在氨氮浓度为16 mg/L时,翘嘴鲌“全雌1号”24 h与96 h的死亡率均显著低于翘嘴鲌(P<0.05)。因此,在氨氮浓度为8和16 mg/L时,翘嘴鲌“全雌1号”相对翘嘴鲌死亡率更低,详见表2。

表2 不同氨氮浓度和胁迫时间翘嘴鲌及翘嘴鲌“全雌1号”24~96 h的死亡率Table 2 The mortality rate of C.alburnus and C.alburnus var.′All-Female 1′ subjected to different ammonia nitrogen concentrations and stress time for 24-96 h %
2.3 氨氮胁迫对肝脏组织结构的影响
组织学观察结果显示:翘嘴鲌及翘嘴鲌“全雌1号”肝脏病理组织损伤类似。由图1可见,氨氮胁迫前,肝细胞排列整齐,细胞轮廓清晰。低浓度氨氮胁迫48 h时,肝细胞肿胀,并出现空泡化,细胞核肿大或偏移。低浓度氨氮胁迫96 h时,肝细胞肿胀更加明显,空泡化更严重,血窦略微扩张。高浓度氨氮胁迫48 h时,细胞核肿大、偏移或溶解,肝细胞部分溶解、轮廓模糊,血窦扩张。而高浓度氨氮胁迫96 h时,出现大面积细胞核肿大,细胞溶解、轮廓模糊,血窦扩张严重。总之,氨氮胁迫使肝脏出现病理学组织损伤,且损伤随氨氮浓度及胁迫时间的增加而逐步增强。
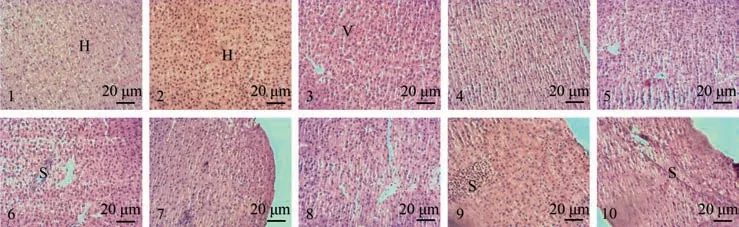
图1 不同氨氮浓度和胁迫时间对肝组织学的影响Figure 1 Effect of ammonia nitrogen stress on liver histology under different ammonia nitrogen concentration and stress time
2.4 氨氮胁迫对体内SOD酶活力的影响
翘嘴鲌及翘嘴鲌“全雌1号”SOD酶活性的变化曲线表明,两种鱼对照组的变化均稳定在一定值,而高、低浓度组则呈先升高后降低再升高的趋势,在6 h时达最大值后快速下降,至12 h时下降至最低值,之后缓慢上升,并于96 h时恢复至对照组水平,且高浓度组的SOD指标均高于低浓度组。同时,翘嘴鲌“全雌1号”SOD酶活指标升高时幅度更大,活性下降时幅度更小,在相同氨氮浓度与胁迫时间下比翘嘴鲌活性更高,详见图2和图3。

图2 翘嘴鲌各组SOD值变化曲线Figure 2 Change curve of SOD value in each group of C.alburnus
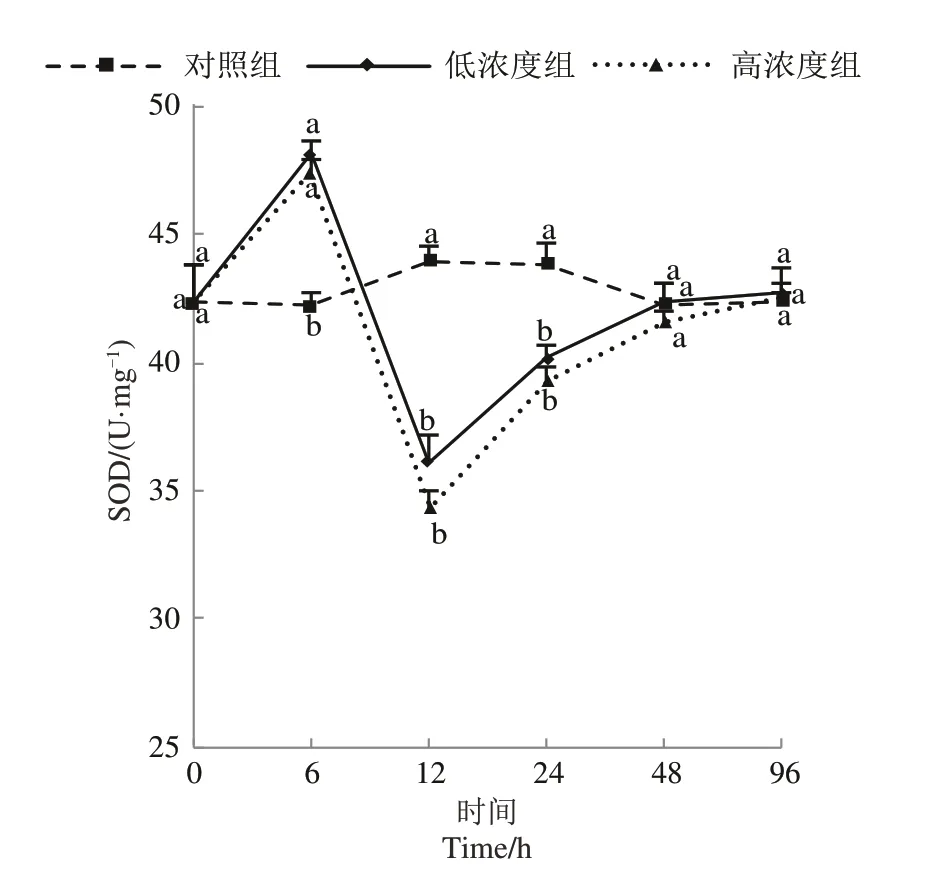
图3 翘嘴鲌“全雌1号”各组SOD值变化曲线Figure 3 Change curve of SOD value in each group of C.alburnus var.′All-Female 1′
3 讨论与结论
氨氮是影响水产养殖的重要环境因子,高水平氨氮可引起鱼类氧化应激,造成组织氧化损伤[24-26],严重时会抑制鱼类的生长、危害健康,甚至导致死亡[27-28]。肝脏是鱼类重要的解毒和代谢器官,是受水体污染物影响最大的器官之一[29]。氨氮可通过肝门静脉到达肝脏,参与肝的代谢反应[30]。本试验中,翘嘴鲌及翘嘴鲌“全雌1号”肝脏的组织切片结果表明,氨氮对肝脏组织结构影响的表现一致,均为从初始的肝细胞肿胀及出现空泡化至后期的细胞空泡化严重、细胞变形、核仁消失、血窦扩张。这在其他鱼类的氨氮胁迫中也出现类似的结果,如张武肖等[31]对团头鲂(Megalobrama amblycephala)进行氨氮胁迫研究时发现,在氨氮胁迫初期主要表现为肝细胞肿大,此后细胞空泡化逐渐严重,直至出现大批肝细胞坏死,这与本次实验的结果相一致,说明肝细胞随着氨氮胁迫时间的延长损伤也会增加。同时,张武肖还推测肝脏抗氧化酶的活性与肝脏的组织学变化具有相关性。另外,由于细胞空泡化严重,说明肝功能可能受到影响,而细胞坏死的先兆往往是细胞变形、核仁消失、细胞核空泡化等[32-33],而这些现象在本次试验的高氨氮胁迫后期明显增加。这表明长时间或者高浓度的氨氮胁迫下,可能由于肝细胞损伤数量的增加导致肝脏病理组织损伤更加明显。
鱼类可通过提高抗氧酶活性或抗氧化物水平以增强机体抗应激能力,维持应激下机体正常生理功能[24,27,34-36]。在本次氨氮胁迫试验中,我们发现高、低氨氮浓度组的抗氧化酶活性变化均呈现先升高后降低再升高的变化趋势。而强俊等[12]认为一定氨氮浓度下,机体通过增加代谢以应对环境胁迫,而氧自由基的量也随之增加,抗氧化酶活力的增加可以减轻脂质过氧化的损伤,是一种生物体对新陈代谢的适应。刘洋等[37]认为造成抗氧化酶活性首先升高的原因可能是氨氮在胁迫初期对抗氧化酶活性有诱导作用,这种诱导作用是由活性氧自由基的增加所引起的机体代偿性增多所致。而本次试验抗氧化酶SOD活性在氨氮胁迫后期有所回升,这是否说明氨氮胁迫对肝脏产生的毒害作用可逆,需要今后进一步探索。同时,我们比较高、低浓度氨氮对抗氧化酶活性的影响,认为低浓度组比高浓度组更有助于抑制氧化自由基的产生,这提示我们在日常养殖生产中,必须密切关注水体中的氨氮浓度,以免氨氮浓度过高造成鱼类的抗氧化系统失调,影响养殖成活率。另一方面,由于抗逆性强的品种在逆境中抗氧化酶活性升高时幅度更大,活性下降时幅度更小或抗逆性强的品种活性升高而抗逆性弱的品种则活性降低[38]。综上所述,对比了翘嘴鲌及翘嘴鲌“全雌1号”在氨氮胁迫试验中抗氧化酶的活性变化,发现翘嘴鲌“全雌1号”在高、低氨氮环境中抗氧化酶活性高于普通翘嘴鲌,推测翘嘴鲌“全雌1号”相比普通翘嘴鲌,在一定程度上具有更强的氨氮抗逆性,其是不是由新品种选育过程中持续多代的群体选育、异源雌核发育和性逆转的伪雄鱼诱导等育种方法起了作用,还有待对其氨氮胁迫应答的分子机制进行进一步的解析。随着高密度集约化养殖发展,氨氮成为限制渔业发展的重要因素,然而国内尚无针对氨氮耐受培育出的鱼类新品种[39],因此,本研究结果能为翘嘴鲌新品种的持续选育与健康养殖提供依据。
