青花椒雄蕊调控基因ZaPI的克隆、鉴定与表达模式分析
2024-03-09张秋月马乐洵郑皓吴涵王凯龚伟王景燕惠文凯
张秋月,马乐洵,郑皓,吴涵,王凯,龚伟,王景燕,惠文凯
(四川农业大学林学院/四川省长江上游林业生态工程重点实验室,成都 610000)
青花椒(Zanthoxylum armatumDC.),又名竹叶花椒,为芸香科(Rutaceae)多年生小乔木或灌木。常见的青花椒主要为纯雌株,聚伞状圆锥花序,单性不完全花中缺少花瓣,以无融合生殖为主要繁殖方式,因其特殊的清香麻味而受到消费者青睐[1],是一种重要香料、油料、制药兼用型经济树种,亦是我国西部地区乡村振兴的支柱产业之一,具有较高的研究和经济价值[2-3]。然而,近年来的野外观察发现青花椒中出现大量雄花,且具有逐年增多趋势,导致以孤雌生殖繁殖的青花椒结实产量显著降低,严重影响其产业化推广应用[4]。因此,探究青花椒花芽性别分化的关键调控基因,是揭示青花椒花芽性别分化的遗传调控机制,解析青花椒雄花形成内在原因的重要前提,对于研发雄花防控的性别调控技术和培育优质高产青花椒种质资源具有重要意义。
已有研究表明,被子植物花的结构大致保守,由外向内依次由萼片、花瓣、雄蕊和心皮四轮花器官组成[5],并受到A、B和C这3类功能基因的联合控制[6]。同时,花器官分化ABC模型的大多数基因都属于MADS家族成员[7],其编码的蛋白主要由MADS-box、I间隔区、K-box和C末端4个保守程度不同的结构域组成[8],故又称为MIKC型转录因子。其中,B类基因为APETALA3(AP3)/PISTILLATA(PI)亚家族成员,主要涉及雄蕊的分化过程,并能够和A类基因协同调控花瓣的发育[9-10]。截至目前,已有多项研究分别报道了B类基因在花卉[11]、蔬菜[12-13]、水果[14]、木本植物[15]等不同类型植物中均具有调控雄蕊分化的重要作用。然而,尽管PI同源基因在部分物种中已研究得十分透彻,但不同物种的PI基因数量和调控效果存在差异。研究表明,拟南芥中共鉴定到3个PI/AP3家族成员,其中pi-1的调控作用最为明显[16]。与此类似,雪香兰的7个PI/AP3家族成员中,HoPI_3能够显著调控雄花序的分化形成[17]。目前,有关青花椒花芽性别分化过程中的关键调控基因和遗传调控机制未见报道。因此,探究青花椒PI/AP3家族的重要调控基因及其遗传学信息,对于揭示青花椒雄蕊形成分子机制具有重要意义。
本研究结合课题组前期已有的青花椒雌雄花分化过程的转录组数据库,筛选并获取了调控青花椒雄蕊分化的重要PI基因,并结合基因组数据成功克隆了该基因的编码序列全长,开展了青花椒ZaPI的核酸和蛋白序列特征分析,解析了响应青花椒ZaPI的转录因子和顺式作用元件。同时,结合转录组数据和qRT-PCR技术,综合性明确了ZaPI基因在青花椒根、茎、叶和刺等11种不同组织器官以及雌雄花分化10个时间点的表达模式。所获研究结果为探索青花椒雄蕊形成的分子机制,研发雄花防控的性别调控技术提供了丰富的理论基础和数据支撑。
1 材料和方法
1.1 植物材料与仪器设备
本研究所用青花椒种植于四川省成都市崇州花椒试验基地(103.66°E,30.566°N)。选取纯雌株和纯雄株青花椒各9株,在9月上旬当花芽长度达到3~5 mm时开始采样,每隔10 d采集一次花芽,采集至次年3月,花芽开放后结束。每次采集时间为上午9:00-10:00。选择粗细、长度、长势相近的春梢作为取材对象,每枝选取6~10节位,每次至少1.5 g花芽,采集时选择大小、长度基本一致的花芽。采样使用无水乙醇消毒过的解剖刀直接取芽。每3株青花椒混合为一个样品,共采集3次独立来源的多个样本生物重复。所有样品采集后立即放入液氮保存后带回实验室放入-80 ℃冰箱保存。
本研究所用实验耗材和仪器包括:植物RNA提取试剂盒(诺唯赞生物公司)、逆转录试剂盒(莫纳生物科技公司)、荧光定量PCR试剂盒(莫纳生物科技公司)、常规PCRMix预混液、ZaPI基因引物、LB培养基、大肠杆菌DH5α(北京擎科生物科技公司)、无菌 ddH2O、核酸染料(北京擎科生物科技公司)、TAE溶液、琼脂糖、台式高速冷冻离心机、-80 ℃冰箱、凝胶电泳图像分析系统、常规PCR仪和荧光定量PCR仪等。
1.2 试验方法
1.2.1 青花椒ZaPI基因的筛选与克隆
本研究结合课题组已公布的青花椒雌雄花分化过程的转录组数据(GEO编号:GSE195749),从青花椒花芽性别分化差异基因数据集中提取AP3/PI基因家族成员[18],分析所选基因在青花椒雌雄花分化过程的表达模式,初步确定青花椒AP3/PI家族中调控雄蕊分化的重要成员。
经过上述分析,本研究最终确定Zardc17043为雄蕊分化显著相关的候选基因,拟南芥注释结果为B类基因PI。为确认ZaPI编码序列的准确性,本研究从青花椒基因组数据库中提取Zardc17043的编码序列全长,并与克莱门柚(Citrus clementina)、烟草(Nicotiana tabacum)、白杨(Populus alba)和拟南芥的PI基因序列进行比对分析。同时,从本课题组前期构建的青花椒不同组织转录组数据(GEO编号:GSE142491),再次筛选同源基因序列,并利用Bioedit软件将两次所获序列进行比对分析,综合获取完整的青花椒ZaPI基因编码序列,并利用在线分析软件ORF Finder(http://www.detaibio.com/sms2/orf_find.html),明确该基因的开放阅读框(open reading flame, ORF)和对应的氨基酸序列。
1.2.2 青花椒ZaPI基因的克隆与蛋白结构域分析
依据上述所得ZaPI基因编码序列,利用Primer Premier 5.0软件,设计特异性引物(表1)。取青花椒雄花样品,使用RNA-easy Isolation Reagent提取RNA,并参照说明书的具体方法利用逆转录试剂盒获取cDNA,通过PCR技术克隆目的基因。PCR扩增总体系为25 μL,包含2×Flash PCR MasterMix(Dye)12.5 μL,前后引物各1 μL,cDNA模板2 μL,ddH2O 8.5 μL。PCR扩增程序设置为:94 ℃预变性 5 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s,共进行35个循环;72 ℃再延伸5 min,最后16 ℃保存。回收PCR产物,将其与T载体连接,转入大肠杆菌DH5α感受态细胞,经LB培养基过夜培养后,挑取单克隆进行菌落PCR检测,取含有目的基因片段的阳性克隆进行测序。引物合成及测序操作均由生工生物工程(上海)股份有限公司完成。
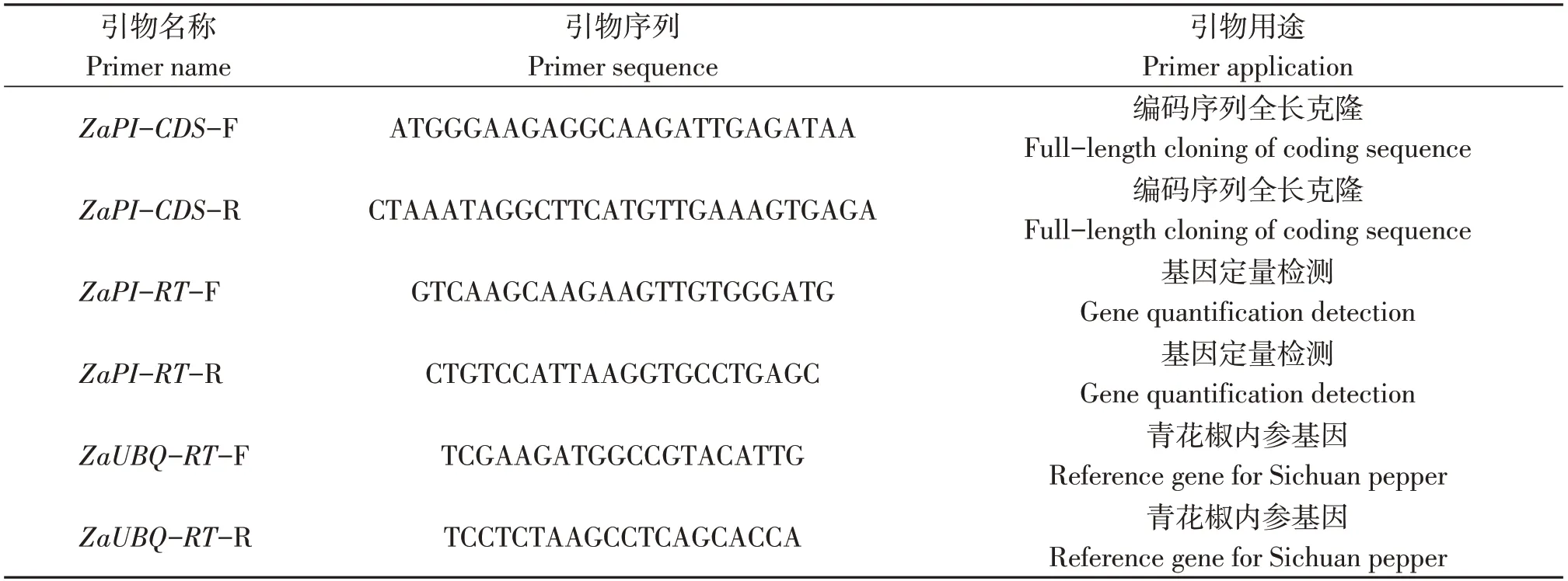
表1 本研究所用引物序列信息表Table 1 Primer sequence information table used in this study
使用DNAMAN软件,将测序结果与上述拼接所得序列进行比对,进一步确认青花椒ZaPI基因序列。随后,再次与克莱门柚、烟草、白杨和拟南芥的PI蛋白序列进行比对分析,获取ZaPI的蛋白结构域信息。
1.2.3 青花椒ZaPI基因的系统进化分析
在NCBI数据库中提取包括杨柳科(Salicaceae)、大戟科(Euphorbiaceae)、芸香科(Rutaceae)等在内的7科29种植物的CDS 序列。利用MEGA6.0软件的邻接法(neighbor joining,NJ)构建不同植物PI基因的系统进化树,分析ZaPI蛋白的系统进化信息。
1.2.4 青花椒ZaPI染色体定位与基因结构分析
从青花椒基因组数据中提取ZaPI基因的染色体定位信息,并利用TBtools软件绘制青花椒ZaPI基因的染色体物理定位图。通过GSDS 2.0(http://gsds.gao-lab.org/index.php)实现青花椒ZaPI基因结构的可视化。
1.2.5 青花椒ZaPI基因的生物信息学分析
为进一步了解青花椒ZaPI基因的遗传学信息,分别利用3种不同的专业在线生物信息学工具对其进行核酸和蛋白序列分析,具体包括:Protparam(http://web.expasy.org/protparam/)、EMBOSS(https://www.ebi.ac.uk/Tools/services/web/toolresult.ebi?jobId=emboss_pepstats-I20230925-035905-0066-8271135-p1m)以及TBtools软件[19]获取ZaPI编码的蛋白理化性质;利用ExPASy(http://web.expasy.org/protscale/)、NetPhos-3.1(https://services.healthtech.dtu.dk/service.php?NetPhos-3.1)以及NovoPro(https://www.novopro.cn/tools/tmhmm.html)进行ZaPI蛋白的疏水性、磷酸化位点和跨膜区预测;分别利用SOPMA(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)和SWISS-MODEL(https://swissmodel.expasy.org/)分析ZaPI的蛋白二级和三级结构,并利用拉氏图检测ZaPI蛋白三级构象的合理性。
1.2.6 青花椒ZaPI的转录因子和顺式作用元件分析
基于本研究克隆的青花椒ZaPI序列,通过PlantRegMap(http://plantregmap.gao-lab.org/index.php)软件分析其转录因子结合位点。随后,从青花椒基因组数据库中提取ZaPI基因转录起始位点上游2 000 bp序列,提交至PlantCARE(https://bioinformatics.psb.ugent.be/webtools/plantcare/html/)进行顺式作用元件预测。将得到的数据结果分别进行统计分析和整理绘图。
1.2.7 青花椒ZaPI基因表达模式分析
为了综合揭示ZaPI基因在青花椒中的组织特异性表达模式,本研究从课题组前期已有的转录组数据集中提取ZaPI在根(Ro)、茎(St)、成熟叶(ML)、果实(Fr)和叶芽(LB)共计5个样品中的表达丰度(GEO编号:GSE195749)。同时,从NCBI已公开的青花椒转录组数据中,分析获取了ZaPI在幼花(YF)、幼叶(YL)、果皮(Hu)、种子(Se)、顶芽(Bu)和皮刺(Pt)共计6个样品的表达丰度(BioProject: PRJNA721257)。所有样品的RNA-seq数据均有3次生物学重复。
同时,分别采集青花椒雌雄花分化10个分化时间点样品,利用RNA快速提取试剂盒(诺唯赞,南京)提取各样品的RNA,并反转录获得cDNA。根据本研究所获ZaPI编码序列,利用Primer Premier 5设计特异性定量检测引物(表1),利用qRT-PCR检测ZaPI基因在各样品中的表达模式。本研究以青花椒ZaUBQ作为内参基因[20],所有样品的定量检测设置3次生物学重复。以雌花分化第一个样品为对照,利用2-ΔΔCt法计算不同样品中ZaPI基因的相对表达水平,采用Duncan多重比较进行不同样品间ZaPI相对表达量的差异分析,显著性水平为P<0.05,利用GraphPad Prism 5绘制柱形图。
2 结果与分析
2.1 青花椒花芽性别分化基因的筛选
本研究从青花椒雌雄花分化的差异表达基因集中共获得11个AP3/PI家族成员,其中包括3个ZaPI基因和8个ZaAP3基因(表2)。基因表达模式分析表明,所获差异基因均在雄蕊成熟期(M4)显著上调,而在雌花分化过程中表达量较低。同时,Zardc17043(ZaPI)在雄花M4时期的表达量是其他差异基因的15~90倍,且在雄花分化过程中呈现极显著上调的高表达。上述结果表明,Zardc17043可能是参与青花椒雄花调控的AP3/PI家族重要成员。因此,本研究选取该基因作为青花椒雄蕊分化的关键调控基因进行后续分析和研究。

表2 青花椒雌雄花分化差异基因集AP3/PI基因家族成员的表达模式Table 2 Expression patterns of AP3/PI gene family members in the differentiation of male and female flowers in Sichuan pepper
2.2 青花椒ZaPI基因的克隆与蛋白结构域分析
本研究通过与其他物种PI基因比对分析发现,从青花椒基因组数据库中所得Zardc17043编码序列长度仅426 bp,缺失C-端蛋白结构域(图1a)。然而,青花椒不同组织的无参转录组数据库中所得同源基因Cluster-12235.70400的预测编码序列长度为769 bp,与Zardc17043存在较高的同源性,但缺少蛋白翻译的起始密码子(图1b)。因此,本研究将两者拼接,成功获得了一条长度为624 bp的编码序列,起始密码子为ATG,终止密码子为TGA,共编码207个氨基酸,初步确定为青花椒Zardc17043的编码序列全长。

图1 青花椒ZaPI基因蛋白结构域分析Figure 1 Protein domain analysis of ZaPI gene in Sichuan pepper
为明确上述分析结果的准确性,本研究利用青花椒雄花的cDNA为模板进行了多次PCR扩增(图2a)。结果表明,除序列N端存在一个氨基酸突变外,其余PCR扩增序列与上述拼接所得序列完全一致(图2b, c)。此外,不同物种的PI蛋白序列比对结果表明,ZaPI蛋白含有典型的MADS-box(氨基酸序列第2~78位)和K-box (氨基酸序列第79~162位)结构域,并具有相对完整的C端转录激活区。上述结果表明,本研究已成功克隆了青花椒Zardc17043(ZaPI)的编码序列全长。
2.3 青花椒ZaPI蛋白序列系统进化分析
29种植物的PI蛋白序列与青花椒ZaPI蛋白序列的系统进化分析结果显示(图3),PI蛋白在同科内保守性较高,本研究所获青花椒ZaPI基因与同属于芸香科(Rutaceae)的克莱门柚(Citrus clementina)、甜橙(Citrus sinensis)、枳(Citrus trifoliata)和柑橘(Citrus reticulata)亲缘关系较近。
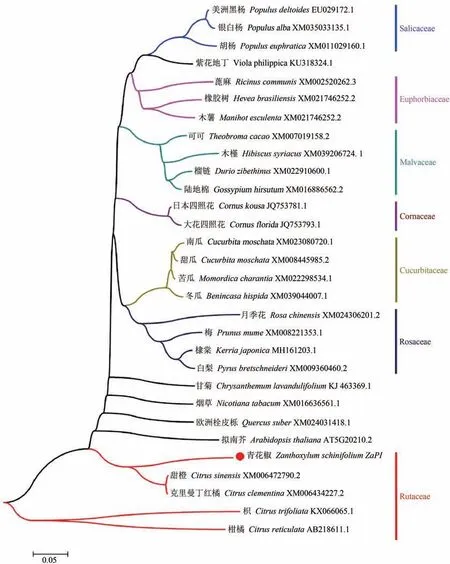
图3 青花椒ZaPI蛋白序列系统进化分析Figure 3 Systematic evolutionary analysis of ZaPI protein sequence in Sichuan pepper
2.4 青花椒ZaPI染色体定位与基因结构分析
染色体定位结果显示(图4),ZaPI基因位于青花椒ZaChr11染色体。进一步的基因结构分析表明,ZaPI基因包含4个外显子和3个内含子,其中2号内含子长度超过500 bp。

图4 青花椒ZaPI基因定位与基因结构分析Figure 4 Genomic localization and gene structure analysis of the ZaPI gene in Sichuan pepper
2.5 青花椒ZaPI基因的生物信息学分析
为了进一步了解青花椒ZaPI基因的相关信息,本研究对其进行了部分生物信息学分析。利用Protparam、Emboss和TBtools软件预测的ZaPI编码蛋白理化性质结果显示(表3),ZaPI蛋白分子量为24.29 kD,pI (等电点)为9.48,不稳定系数为53.73(稳定蛋白阈值为40),总体亲水性系数为-0.876 (小于0为亲水性,反之为疏水性),这说明ZaPI是一个不稳定的亲水性蛋白。通过ExPASy软件分析发现(图5a),ZaPI蛋白中第47位氨基酸的平均疏水指数最大(2.256),而第191位氨基酸的平均疏水指数最小(-3.333)。蛋白磷酸化位点预测结果显示(图5b),ZaPI蛋白中具有19个丝氨酸(Serine)位点、7个苏氨酸(Threonine)位点和5个酪氨酸(Tyrosine)位点,这31个蛋白磷酸化位点可能是调控ZaPI蛋白活性和功能的重要组成部分。此外,生信分析结果表明,ZaPI蛋白无跨膜螺旋区(图5c),主要由α螺旋,无规则卷曲和延伸链组成(图5d),能够形成蛋白二聚体(图5e)。拉氏图评估结果表明,上述分析所得蛋白三级模型的构象符合立体化学规则(图5f)。

图5 青花椒ZaPI蛋白序列的生物信息学分析Figure 5 Bioinformatic analysis of the ZaPI protein sequence in Sichuan pepper

表3 青花椒ZaPI蛋白理化性质分析Table 3 Physicochemical properties analysis of the ZaPI protein in Sichuan pepper
2.6 青花椒ZaPI的转录因子结合位点和顺式作用元件分析
为了更好地了解青花椒ZaPI基因的潜在功能和调控基因,利用PlantRegMap软件对其进行预测,共获得包括BBR-BPC、MIKC_MADS、C2H2和MYB等17类转录因子家族的54个结合位点(图6a),其中BBR-BPC的结合位点数量最多,共10个,占19%;其次是MIKC_MADS,共9个,占17%。这些转录因子与调控植物生殖生长、生理代谢、细胞分化等生长发育过程显著相关,暗示ZaPI可能与这些转录因子相互作用,调控青花椒雄蕊的分化过程。
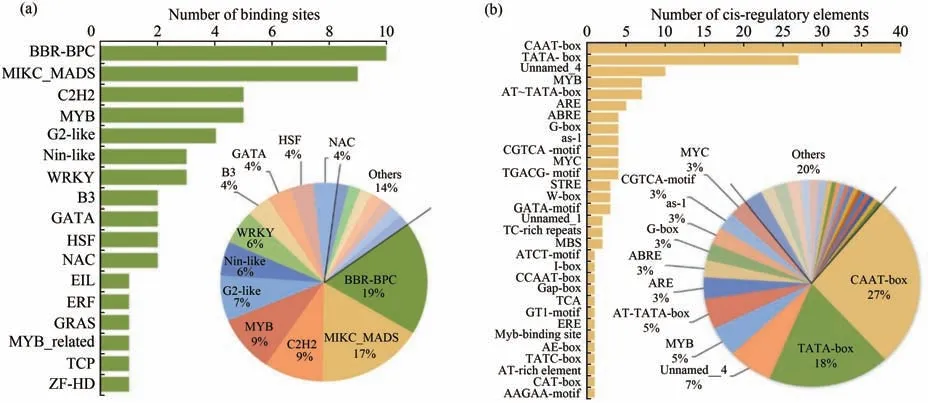
图6 青花椒ZaPI的转录因子和顺式作用元件分析Figure 6 Transcription factor and cis-acting element analysis of ZaPI in Sichuan pepper
顺式作用元件分析发现(图6b),ZaPI基因共含有31种顺式作用元件。除启动子本身具有的CAATbox和TATA-box等特征性元件外,还包括6类响应元件,分别是占比9%的激素响应元件(包括脱落酸ABRE、茉莉酸甲酯CGTCA-motif和TGACG-motif及赤霉素TATC-box)、8%的光反应元件(G-box、GATA-motif、ATCT-motif、I-box、Gap-box、GT1-motif及AE-box)、7%的MYB响应元件(包括MYB、MBS、CCAAT-box及Myb-binding site)、3%的厌氧诱导调节元件(ARE)以及2%的防御与应激反应元件(TCrich repeats)和分生组织表达响应元件(CAT-box)。该结果表明,ZaPI基因可能存在多种信号响应模式,参与了青花椒不同的生命活动过程,是潜在植物激素和光信号响应因子,可能受到MYB转录因子的互作调控,并在逆境条件下调控植物生殖生长过程中发挥着重要作用。
2.7 青花椒ZaPI基因的表达模式分析
组织特异性分析结果表明(图7a),青花椒ZaPI在根茎叶刺等11种不同组织器官中几乎不表达,仅在果实中表达量相对较高。此外,为进一步明确本研究所选ZaPI基因在青花椒性别分化过程的表达情况,本研究利用雌雄蕊分化的10个时间点样品进行了qRT-PCR检测分析。结果表明(图7b),青花椒ZaPI基因在雌雄花分化过程中存在极显著差异。ZaPI主要在雄花中表达,并随着雄蕊的分化表达量逐渐上调,在12月雄蕊形成期和2-3月份雄蕊成熟期表达量显著提高,尤其是后者的表达量呈指数级上调。然而,ZaPI在青花椒整个雌花分化过程的表达量持续处于相对较低水平。上述结果与B类基因的基本功能吻合,表明本研究所获ZaPI基因在青花椒雄花分化过程中具有重要的调控作用。

图7 青花椒ZaPI基因表达量及定量检测结果Figure 7 Transcription factor and cis-acting element analysis of ZaPI in Sichuan pepper
3 讨论
植物具有相对复杂的性别分化遗传机制[21],而现阶段有关青花椒性别分化的分子机制暂未可知。本课题组前期研究发现,青花椒花芽分化过程中雌雄蕊原基的选择性败育导致了单性花的形成[18]。本研究以青花椒组学数据为基础,克隆了参与雄蕊分化的ZaPI基因,该序列编码的蛋白与拟南芥、克莱门柚等多种植物的PI蛋白序列具有较高相似性,且拥有典型的MADS-box结构域和K-box结构域,是一个不稳定的亲水二聚体蛋白,大部分结构为α螺旋。据文献记载,B类基因高度保守的 MADS 结构域具有与DNA结合等功能;而含有亲水性α螺旋的K结构域对于形成AP3/PI异源二聚体在花发育过程中非常重要[16,22],本研究所获ZaPI基因序列存在上述完整的结构域特征,暗示该序列具有发挥PI基因活性的能力。此外,PI基因作为ABC模型的B类调控基因,与植物的雄蕊分化过程显著相关[23]。
已有研究表明,桂花过表达PI同源基因致使生育期缩短、开花时间提前[24]。木本植物阿甘树(Argania spinosa)的AsPI基因和克莱门柚的PI-like基因CcMADS20在雄蕊和花瓣中呈极显著表达,而在营养器官中表达量极少[25-26]。同时,楸树(Catalpa bungei)CabuPI基因和东方绿藻(Chloranthaceae)HoPI基因的表达也仅限于花瓣和雄蕊,这些PI的过表达均能够挽救pi突变体拟南芥花瓣和雄蕊异常发育的表型缺陷[17,27]。与此类似,本研究ZaPI基因主要在雄花分化的形成期和成熟期高表达,而在营养器官中表达量极低或未检测到表达。这些结果暗示本研究所获ZaPI基因可能参与了青花椒雄蕊的性别分化过程,并在调控雄花分化和雄蕊形成中起重要作用。后续研究可借助模式植物遗传转化等实验,进一步探究ZaPI基因的生物学功能,从而揭示其在青花椒雄蕊分化过程中的重要作用。
此外,本研究从青花椒ZaPI基因中检测到大量C2H2、MYB、WRKY、NAC和 MIKC_MADS等转录因子结合位点,这些转录因子广泛参与到植物生长发育过程中。已有研究表明,PI基因的过表达能够显著提高番茄的耐盐性,并促使MYB转录因子表达量显著上调[28]。同时,PI基因的高表达与高粱的抗病性显著相关[29],且可导致高粱开花时间显著提前。近期研究发现,三叶木通的AktWRKY19在雄花中极显著高表达,而雌花中表达量极低[30]。拟南芥中的WRKY2和WRKY34能够显著调控雄蕊花粉的发育过程[31]。这些结果表明ZaPI基因可能在开花时间调控、逆境胁迫信号转导、病虫害防御等方面发挥重要作用[32-35]。在后续研究中,可通过酵母单/双杂交、凝胶迁移等分子遗传学手段,探究ZaPI基因与上述转录因子的互作效应。
启动子是位于基因编码区上游,富含顺式作用元件,调控相关基因转录的DNA序列[36]。本研究ZaPI基因启动子区域预测到31种顺式作用元件,其中涉及大量的植物激素响应元件,尤其是茉莉酸甲酯、赤霉素和脱落酸信号转导通路。研究发现,玉米PI-like基因的顺式作用元件,特别是与茉莉酸甲酯(MeJA)和赤霉酸(GA)这两种激素相关的元件,在MeJA和GA的外源处理下,影响了PI基因的表达,减少了玉米雄蕊的数量[37]。同时,已有研究证明外源水杨酸(SA)处理后郁金香PI基因表达量上调,并促进了郁金香花瓣的衰老[38]。此外,番茄SlPI基因的厌氧诱导调节元件ARE数量较多,在厌氧条件下转录因子可与ARE结合诱导PI基因的表达[28]。综上所述,PI基因可能通过响应植物激素信号传导通路以及花芽分化相关转录因子调控雄蕊分化过程。因此,在后续研究中可以观察外源茉莉酸甲酯、赤霉素和脱落酸处理后的青花椒ZaPI基因表达活性变化,确定青花椒ZaPI是否能够响应植物激素信号,调控雄花的分化过程,从而为青花椒雄花调控技术研发提供丰富的理论支撑和技术参考。
4 结论
本研究结合青花椒转录组和基因组数据,成功克隆了一条长度为624 bp的ZaPI基因完整编码序列,并利用蛋白结构域分析、系统进化树构建、染色体定位、转录因子结合位点及顺式作用元件预测等方法对其进行了综合的生物信息学分析,发现ZaPI基因可能响应植物激素、光照以及逆境胁迫等信号通路,调节青花椒的花器官分化过程。此外,转录组学和实时荧光定量PCR分析结果表明,该基因在青花椒营养器官中几乎不表达,雌花分化过程的表达量也相对较低,但在雄花分化过程中表达量极显著上调,暗示其可能显著参与了青花椒雄蕊分化的遗传调控过程。本研究所获结果,对于进一步探究青花椒雄蕊形成的分子机制,培育高产青花椒种质资源提供了丰富的理论支撑。
