一种可用于OBI 检测的高灵敏度核酸提取方法的建立与验证
2024-03-09高文博何博杜荣松廖芬芳谢君谋王敏王淏
高文博 何博 杜荣松 廖芬芳 谢君谋 王敏 王淏
(广州血液中心广州市医学重点实验室血液安全重点实验室,广东 广州 510095)
隐匿性HBV 感染(occult hepatits B virus infection,OBI)是HBV 感染的1 种特殊形式,其以HBsAg 持续阴性,血液或肝脏中HBV DNA 病毒载量低为特征[1-2]。 因OBI 患者体内HBV DNA 往往处于极低水平,甚至可能低于HBV DNA 核酸检测(nucleic acid test, NAT)的检测下限,所以常常导致NAT 检测假阴性和序列扩增失败[1]。 如何提取足够浓度的HBV DNA 用于检测或序列扩增已成为影响输血安全以及OBI 分子生物研究的难题。
目前采供血机构用于NAT 的进口检测系统主要包括Roche 检测系统和Grifols 检测系统,无论是Roche 检测系统的混检模式(6 人份混检,每支标本167 μL 混合为1 mL)、拆分模式(单支标本1 mL),还是Grifols 检测系统的联检模式(单支标本500 μL),都是从≤1 mL 的标本中提取核酸进行检测。 这对于很多病毒载量低的标本,尤其是OBI 标本,可能无法有效提取出足够量的核酸。 另外,这2 种检测系统都只是定性检测,无法对标本的病毒浓度进行实际定量。
已有报道的针对低病毒载量标本的核酸提取方法有PEG 富集法[3]和超高速离心法[4-5]。 其中超高速离心法需要在4 ℃、250 000 g 条件下离心数小时,对设备要求高;而PEG 富集法需要4 ℃过夜,实验过程耗时相对较长。 因此本研究旨在建立1 种操作性强、耗时较短、易于普及的,可用于极低病毒载量OBI 核酸提取的方法,以此获得足够的HBV DNA,为提高NAT 检测下限和序列扩增效率提供方法学参考。
1 材料与方法
1.1 标本来源
对2019 年9 月—2020 年3 月本中心采集的无偿献血者标本,同时进行ELISA 双试剂HBsAg 和Panther 核酸检测系统NAT 检测,其中ELISA -/NAT+的标本共168 份,收集这些标本相对应的报废新鲜冰冻血浆(100 或200 mL,ACD 或CPD 抗凝),分装冻存备用。
1.2 试剂与仪器
ELISA 试剂:HBsAg ELISA 检测试剂(北京万泰公司,批号:B20190519;上海科华公司,批号:201904151)。 电化学发光试剂:HBsAg、抗-HBs、HBeAg、抗-HBe、抗-HBc 检测试剂(Roche 公司,批号: 47040801、 47336501、 43358203、 43862602、46343102)。 NAT 试剂: High Pure Viral Nucleic Acid Large Volume 试剂(Roche 公司, 批号:58726800),Procleix Ultrio Elite Assay 试剂(Grifols公司,批号:700516)。 HBV DNA 定量检测试剂(PCR-荧光探针法,适用于HBV B 型、C 型、D 型、B/C 型混合、C/D 型混合标本,广州达安公司,批号:2020001);阴性血浆(广州邦德盛公司);磁珠、蛋白酶K 试剂、EB、洗脱液(Roche 公司),异硫氰酸胍、DTT、柠檬酸钠二水合物(碧云天公司),Polydocanol(Sigma 公司),8420 低速离心机(久保田公司),5418 高速离心机(Eppendorf 公司),DHP-9012 恒温箱(上海一恒公司),DK-8D 水浴箱(上海精宏公司),7500 型荧光定量PCR 仪(ABI 公司),QBD-1 干浴器(Grant 公司),105004 旋转混匀器(NEST 公司),T203 分析天平(DENVER 公司),SI-0246 涡旋振荡器(SI 公司),纳米磁珠分离器(实验室自制),STAR 全自动加样仪、FAME 全自动酶免分析仪(Hamilton 公司),Panther 核酸检测系统(Grifols 公司),Cobas E601 全自动电化学发光免疫分析仪(Roche 公司)。
1.3 方法
1.3.1 裂解液配置
参照Roche Cobas Taq Screen MPX Test,version 2.0 核酸检测试剂盒裂解液配置(做部分调整),按照0.3%柠檬酸钠二水合物、42.5%异硫氰酸胍、5%Polydocanol 和0.9% DTT 的比例,加入蒸馏水充分溶解。
1.3.2 标准品配置
将达安HBV DNA 定量检测试剂盒中的阳性定量参考品(2×106IU/mL、2×105IU/mL、2×104IU/mL、2×103IU/mL,其量值可溯源为有证国家标准物质)加阴性血浆分别配置成10 000 IU/mL、1 000 IU/mL、100 IU/mL、10 IU/mL 和1 IU/mL 浓度的标准品。
1.3.3 大体积核酸提取
参照Roche Cobas Taq Screen MPX Test,version 2.0 核酸检测试剂盒核酸提取方法,在进行了多次实验条件摸索和不同参数的效果比对后,做了如下调整:在50 mL 的无菌离心管内分别加入不同浓度的10 mL 标准品,600 μL 的蛋白酶K 试剂,1 000 μL的磁珠和15 mL 的裂解液;盖紧管盖,漩涡振荡1 min,70 ℃温育15min 后振荡颠倒摇匀5 min;将离心管放入磁力架,吸磁1 min,弃上清;将约33 mL的磁珠洗涤液加入离心管,漩涡振荡30~60 s,共洗涤3 遍;将离心管放入磁力架,吸磁,弃上清,留约500 μL 磁珠混合液,转移至2 mL EP管;将EP 管1 801 g 离心1 min,平铺吸磁,用移液器吸取上清,弃去,尽量吸取干净;EP 管敞开盖,56℃烘干2 h;往离心管内加入65℃预热的洗脱液(EB)65 μL,移液器反复吹打,充分悬浮磁珠;盖紧管盖,70℃静置5 min 40 s,期间混匀数次使核酸从磁珠上洗脱下来;将离心管放在磁力架上,吸磁。上清即为核酸溶液,-20℃保存备用。
1.3.4 荧光定量PCR
按照达安HBV DNA 定量检测试剂盒说明书操作。 具体步骤为:将提取的不同浓度标准品核酸作为模板,每个浓度梯度进行平行双份检测。 每个PCR 反应管内加入HBV 反应液A 1 μL、HBV 反应液B 1.5 μL、HBV 反应液C 7.5 μL 和模板20 μL,盖紧管盖,瞬时离心15 s 转至扩增检测区。 使用荧光定量PCR 仪按如下循环进行反应:50℃2 min、1 cycle,95℃15 min、1 cycle,94℃15 s →55℃45 s、45 cycles。
1.3.5 方法验证
病毒浓度经过对数转换后,以病毒浓度的对数为X 轴,同浓度标准品2 次检测CT 值的平均值为Y 轴,构建荧光定量标准曲线和回归方程。 共进行3 次独立HBV 标准品提取和荧光定量,分别构建标准曲线和回归方程,取3 次HBV 标准品平均CT值构建平均标准曲线回归方程。
1.3.6 OBI 标本确认
采取Roche 电化学发光免疫分析法对ELISA-/NAT+献血者标本进行HBsAg、抗-HBs、HBeAg、抗-HBe、抗-HBc 检测,严格按照检测试剂说明书操作。 若HBsAg-、NAT+且抗-HBc+则判定为OBI[6]。
1.3.7 OBI 标本检测
依照说明书方法用High Pure Viral Nucleic Acid Large Volume 试剂盒提取2.5 mL OBI 标本DNA 并做荧光定量PCR,结果为阴性的标本再采用上述方法提取标本DNA 并和2 份阴性对照标本一起做荧光定量PCR。
1.4 统计学分析
使用Graphpad Prism 9.5 和Microsoft Excel 2019 软件进行数据统计分析和作图。 采用简单线性回归模型构建标准曲线。
2 结果
2.1 HBV DNA 标准品荧光定量PCR 结果与标准曲线
见表1、图1,CV 均<5%,说明本核酸提取方法有较高的稳定性。
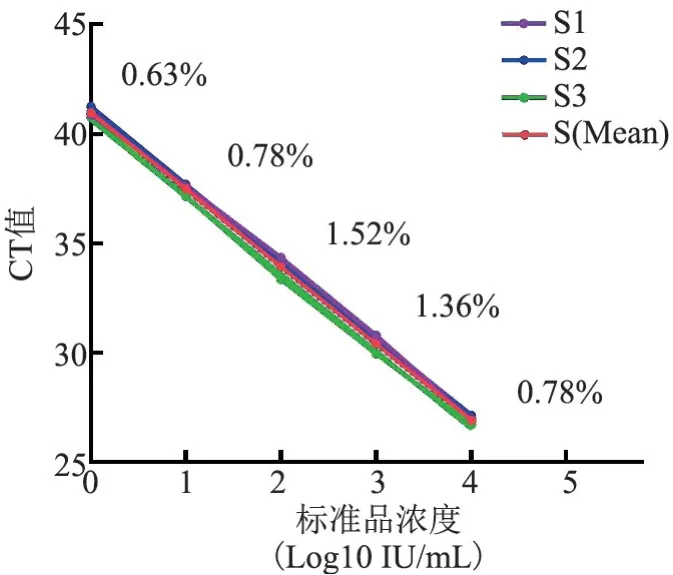
图1 3 次标准曲线及不同浓度标准品CT 值的变异系数Figure 1 Coefficient of variation of CT values of standards with different concentrations in triplicate standard curves

CT 值标准曲线1 标准曲线2 标准曲线3 均值CV(%HBV DNA 10 00026.9327.1426.7226.93 0.78标准品1 00030.7930.4929.9830.42 1.36(IU/mL) 10034.3634.1133.3733.94 1.52 1037.6337.7137.1737.50 0.78 140.8941.2640.7740.98 0.63
2.2 标准曲线回归方程
3 次标准曲线回归方程的E(扩增效率)均在90%~105%,扩增效率理想; R2均>0.99,表明CT值与病毒模板量的对数之间具有良好线性关系,见表2。
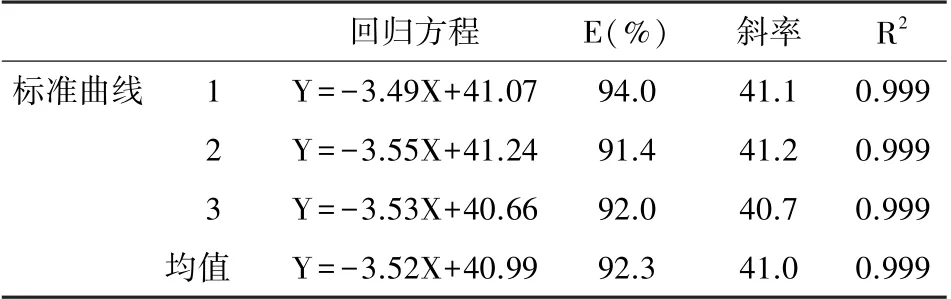
回归方程E(%)斜率R2标准曲线1Y=-3.49X+41.0794.041.10.999 2Y=-3.55X+41.2491.441.20.999 3Y=-3.53X+40.6692.040.70.999均值 Y=-3.52X+40.9992.341.00.999
2.3 OBI 标本荧光定量PCR 结果
经大体积方法提取的6 份低病毒载量OBI 标本(OBI-1—6)的荧光定量PCR 结果均为阳性。 通过回归方程计算出的对应HBV 病毒浓度均值为1.70 IU/mL,其中最低的OBI-4 病毒浓度为0.18 IU/mL(表3)。 阴性对照NC 均无扩增信号。
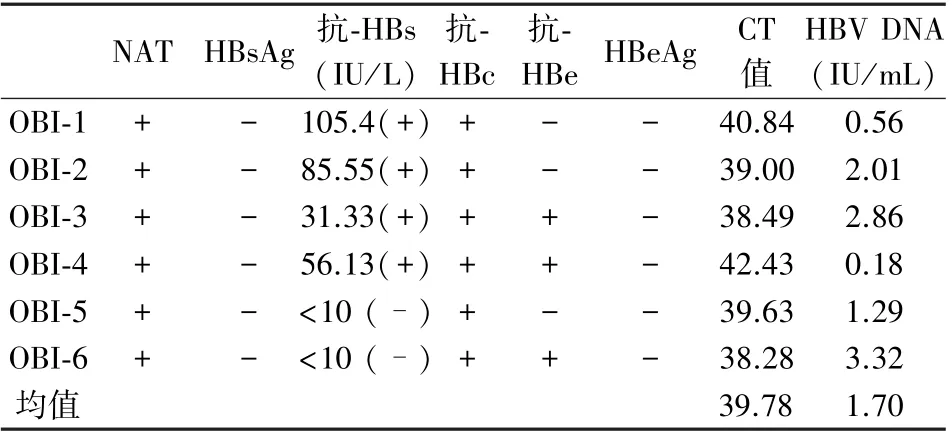
NAT HBsAg 抗-HBs(IU/L)抗-HBc HBe HBeAg CT值抗-HBV DNA(IU/mL)OBI-1 +- 105.4(+) +--40.840.56 OBI-2 +- 85.55(+) +--39.002.01 OBI-3 +- 31.33(+) ++-38.492.86 OBI-4 +- 56.13(+) ++-42.430.18 OBI-5 +- <10 (-) +--39.631.29 OBI-6 +- <10 (-) ++-38.283.32均值39.781.70
3 讨论
OBI 献血者体内的HBV 含量通常较低,病毒载量常常<5 IU/mL[7]。 Weusten 等[8]对于评估OBI 输血残余风险的数学模型显示,约有3.3%的OBI 献血者是单支标本核酸检测(ID-NAT)无法检测到的,并且20 mL 该OBI 献血者的血液制品即可造成感染。 2018 年Candotti 等[9]报道了3 名HBsAg-/HBV DNA-的OBI 献血者造成31 名受血者中的9 人感染,进一步证实了HBV DNA 的最小感染病毒载量为3 IU,如要尽可能的降低OBI 经血传播HBV 的残余风险,需要提高NAT 检测下限到0.15 IU。 这与目前高敏感NAT 3.4 IU/mL(Grifols核酸联检检测系统)和2.3 IU/mL(Roche 核酸检测系统)的检测下限相比,还有较大差距。 国内也有研究表明,低病毒载量OBI 标本与NAT 的非重复反应现象(可能造成假阴性)密切相关[10],从另一方面也印证了OBI 漏检可能性较大。 因此针对OBI 标本的检测和确认,我们亟需1 种更高灵敏度的核酸检测方法。 而本研究针对上述问题,通过提高提取核酸标本的体积到10 mL,建立了1 种可用于OBI 的大体积高灵敏度核酸提取方法。 在大体积核酸提取方法的建立过程中,我们进行了长时间的实验条件和体系的摸索,为了降低实验成本,采用不同浓度多聚正癸醇配比裂解液,在评估检测效果的基础上最终确认在不影响实验结果的情况下的最优配比;为了克服大体积标本核酸浓缩到小体积中的难点,我们首创性地增加了磁珠烘干步骤。经过烘干,可以使得原来与较大量磁珠相结合的标本DNA(10 mL 标本中提取)没有多余水分,在加入65 μL 洗脱液洗脱后,不会被稀释,有利于后续的DNA 检测与定量。
实验结果显示,本核酸提取方法具有较高的稳定性,同时标准品扩增效果理想, CT 值与病毒模板量的对数之间具有良好的线性关系,说明该方法均能将5 个浓度的标准品DNA 提取完全,并将HBV 定量检测下限提高到1 IU/mL,充分验证了本方法的提取效率和高灵敏度。 但同时我们也可以看到3 次标准曲线的回归方程均有差异,这可能是每1 次实验条件变化造成的影响。 因此当进行低病毒载量标本的定量分析时,应同时进行标准品的检测,以当次标准品所构建的标准曲线和回归方程为准。
对于经2.5 mL 核酸提取试剂盒提取核酸后扩增失败的低病毒载量OBI 标本,我们通过本大体积(10 mL)方法提取到核酸,然后通过荧光定量获得CT 值并计算出了对应HBV 的病毒浓度(表3)。这表明与2.5 mL 核酸提取方法相比,本方法能够提取出更多核酸,有利于后续实验。 目前,Roche试剂因其较高的灵敏度、精密度和重复性,被公认为是HBV DNA 定量检测的参比试剂[11],其检测下限为20 IU/mL。 近些年来,国内的HBV DNA 定量试剂逐渐优化,有研究表明国产试剂与Roche 试剂的定量结果有良好的相关性[12]。 本方法通过扩大体积,提高了检测灵敏度,检测下限达到1 IU/mL,能够有效减少NAT 假阴性,为荧光定量PCR 或巢式PCR 提供足够浓度的病毒DNA 模板。
本方法采用磁珠提取法,与PEG 富集法比,实验时间短,提取效率更高;与超高速离心法比,所需设备相对简单,可操作性更强。 最重要的是通过大体积核酸提取方法,可以大大提高提取的核酸量,将HBV 定量检测下限提高到1 IU/mL,可以对低病毒载量的OBI 标本进行核酸定量。 不过需要指出的是,针对目前的采供血机构筛查体系,常规留样10 mL 标本可能较为困难,因此本方法更适合科学研究中对疑似OBI 标本进行核酸富集及鉴定确认。 而针对目前采供血机构核酸检测系统基本为HBV、HCV 和HIV 的联检模式,本大体积核酸提取系统能否适用于HCV、HIV 甚至其他病毒核酸的提取,也有待下一步研究和确认。
