基于GEO基因芯片联合网络药理学及分子对接技术探讨参苓脾喜汤治疗慢性胃炎、胃黏膜上皮内瘤变、胃早期癌作用机制
2024-03-08张玉佩唐伟
张玉佩,唐伟,2
1.安徽中医药大学研究生院,安徽 合肥 230000;2.安徽中医药大学附属六安市中医院,安徽 六安 237000
胃黏膜上皮内瘤变(gastric intraepithelial neoplasia,GIN)是一种以细胞形态和组织结构与其起源的正常胃黏膜组织存在不同程度不典型性为特征的病理学改变,属于胃癌前病变,相当于胃黏膜异型增生[1-2]。研究表明,GIN 与胆汁逆流、幽门螺杆菌(Hp)感染、饮食因素、免疫紊乱及患者年龄等因素有关[3-4]。GIN作为胃癌的癌前病变,其诊断及治疗是防控胃癌的关键,也是胃癌二级预防的重点[1]。胃早期癌(early gastric cancer,EGC)指癌组织仅局限于黏膜层及黏膜下层,不论是否有区域性淋巴结转移。EGC患者手术(或内镜下切除)后5年生存率可达90%~95%[5]。但EGC多无典型临床症状,大多数患者就诊时已处于中晚期。Correa等[6-7]提出肠型胃癌的过程为“正常胃黏膜→慢性炎症→萎缩性胃炎→肠化生→GIN→EGC→进展期胃癌(Correa模式)”。GIN和EGC处于Correa模式的中间阶段,早期识别并尽早有效干预,可有效提高患者生存质量、改善预后。
参苓脾喜汤为唐伟教授在经典名方参苓白术散基础上化裁而成,其用于慢性胃炎(chronic gastritis,CG)、GIN及EGC的辅助治疗疗效较好。目前关于参苓脾喜汤防治CG、GIN、EGC的药效物质基础和分子机制尚不明确。本研究通过网络药理学及分子对接技术筛选CG、GIN、EGC转化的关键差异基因及靶点,从而阐明参苓脾喜汤防治CG、GIN、EGC炎癌转变的潜在作用机制,以更好地发挥中医药治疗GIN及EGC的作用,为后续相关研究提供理论依据。
1 资料与方法
1.1 疾病靶点获取
在GEO(http://www.ncbi.nlm.nih.gov/geo)数据库中检索“Early-stage gastric cancer”,筛选同时含有CG、GIN、EGC 患者的样本,转录组芯片数据集GSE130823符合要求,获取该芯片表达矩阵文件。其中,CG、GIN、EGC分别纳入47个、31个(胃低级别上皮瘤变17个、胃高级别上皮瘤变14个)、16个单样本数据。应用R4.1.1 limma包计算CG、GIN及EGC之间的差异表达基因,筛选标准为P<0.05、|log2FC|>1.0,P<0.05 的基因中,若log2FC>1.0,则为上调基因,log2FC<-1.0,则为下调基因,将处理后数据导入R4.1.1绘制火山图。
1.2 参苓脾喜汤活性成分及靶点获取
在TCMSP(http://tcmspw.com/tcmsp.php)数据库中检索党参、茯苓、白术、陈皮、莲子肉、山药、紫苏梗、砂仁、豆蔻、薏苡仁、麦芽的活性成分,以口服生物利用度(OB)≥30%、类药性(DL)≥0.18为条件进行筛选,通过以上数据库获取活性成分作用靶点。
1.3 交集靶点筛选及蛋白相互作用网络构建
使用R4.1.1 ggvenn 包将药物作用靶点、CG、GIN、EGC 疾病靶点和差异表达基因取交集,导入STRING(https://cn.string-db.org/)数据库进行分析,将蛋白种类设置为“Homo sapiens”,隐藏无关靶点,其他参数保持默认设置。利用Cytoscape3.9.1软件绘制交集靶点蛋白相互作用(PPI)网络,利用CytoNCA插件进行网络拓扑分析,以度中心性为2倍中位值,介度中心性、接近中心性、特征向量中心性、局部边连通性均大于中位值,筛选核心靶点。
1.4 GO功能和KEGG通路富集分析
利用R4.1.1的cluster profiler R包及Perl语言对所得基因进行GO分析,包括细胞组分(CC)、分子功能(MF)和生物过程(BP)。利用cluster profiler R包进行KEGG通路富集分析,选取P≤0.05的分析结果进行可视化,并选取GO中BP、CC、MF排名前10位条目及KEGG中排名前30位通路绘制柱状图。
1.5 分子对接验证
在PubChem(https://pubchem.ncbi.nlm.nih.gov/)数据库下载参苓脾喜汤中药活性成分结构式,在PDB(https://www.rcsb.org/)数据库下载核心蛋白结构。采用PyMOL1.8.0软件对蛋白质进行去水、去磷酸根等操作,利用AutoDock Tools 1.5.7软件将活性成分与核心蛋白基因文件转换为pdbqt格式并寻找活性口袋,通过Vina插件进行分子对接,将输出的分子对接结果导入PyMOL软件以显示分子对接结构。结合能<0 kcal/mol说明配体与受体可自发结合,结合能≤-5.0 kcal/mol及LibDockScore>100表明两者可稳定对接。
2 结果
2.1 差异表达基因筛选
在GSE130823数据集中筛选出1 115个差异表达基因,见图1,其中上调基因502个、下调基因613个。

图1 GSE130823数据集中CG、GIN、EGC差异表达基因火山图
2.2 参苓脾喜汤活性成分及靶点
筛选出参苓脾喜汤活性成分138种,其中、白术7种、陈皮5种、党参21种、豆蔻12种、茯苓15种、莲子肉11种、麦芽18种、山药16种、砂仁10种、薏苡仁9种、紫苏14种,去重后得到119种活性成分。经STRING数据库标准化后得到对应靶点247个。
2.3 中药-活性成分-靶点网络构建
利用Cytoscape3.9.1软件构建中药-活性成分-靶点网络,该网络共有60个节点、159条边,见图2。共得到参苓脾喜汤治疗CG、GIN、EGC潜在靶点22个,包括CHRM3、AR、ADRB2、DPP4、MTTP、NOS2、EPHB2、 ADRA2A、 SLC6A2、 XDH、 SLC2A4、MMP3、 FOS、 CYP3A4、 PTGER3、 DUOX2、NR1I2、CLDN4、GSTM2、DRD2、DRD5、ALB。网络拓扑分析显示,度值排名前3位的活性成分依次是槲皮素、豆甾醇、木犀草素。

图2 参苓脾喜汤治疗CG、GIN、EGC中药-活性成分-靶点网络
2.4 蛋白相互作用网络构建
利用Cytoscape3.9.1软件构建交集靶点PPI网络,包含19个节点、54条边。利用CytoNCA插件进行网络拓扑分析,得到节点平均度值为5.68,介度中心性为0.079 8。以关联蛋白线条目≥12为核心靶点。筛选后得到ALB、AR、DPP4、CYP3A4共4个核心靶点,见图3。
2.5 GO功能和KEGG富集分析结果
将22个交集靶点导入R4.1.1进行分析,得到269个GO 条目(见图4)和30 条KEGG 通路(见图5)。BP主要涉及腺苷酸环化酶激活肾上腺素能受体信号通路、对外源性刺激的反应、离子跨膜转运蛋白活性的调节、腺苷酸环化酶调节G蛋白偶联受体信号通路等;CC主要涉及肌浆网、肌浆、细胞基膜、细胞基部等;MF主要涉及儿茶酚胺结合、G蛋白偶联胺受体活性、突触后神经递质受体活性等。KEGG通路富集主要涉及化学致癌作用-受体激活、cAMP、神经活性配体-受体相互作用、钙信号通路、IL-17、TNF等信号通路。
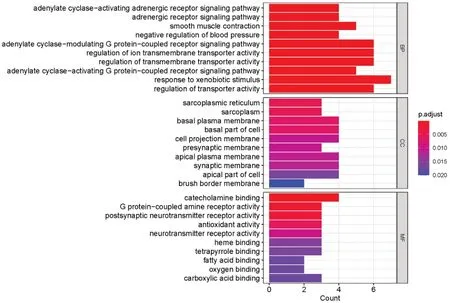
图4 参苓脾喜汤治疗CG、GIN、EGC靶点GO功能富集分析
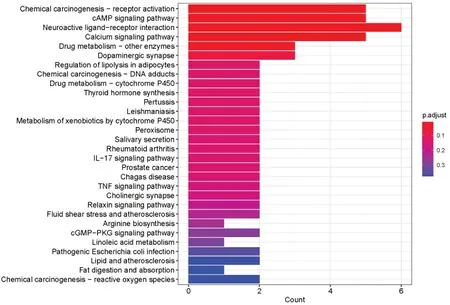
图5 参苓脾喜汤治疗CG、GIN、EGC靶点KEGG通路富集分析
2.6 分子对接验证
根据网络药理学联合生物信息分析结果,将参苓脾喜汤中核心活性成分槲皮素、木犀草素、豆甾醇与核心靶点蛋白ALB、AR、DPP4 进行分子对接验证(见表1、图6)。结合能≤-7 kcal/mol表明结合良好,可见木犀草素与ALB、AR、DPP4对接良好,槲皮素与ALB、DPP4对接良好,豆甾醇与AR对接良好。

表1 参苓脾喜汤核心活性成分与CG、GIN、EGC核心靶点分子对接结果
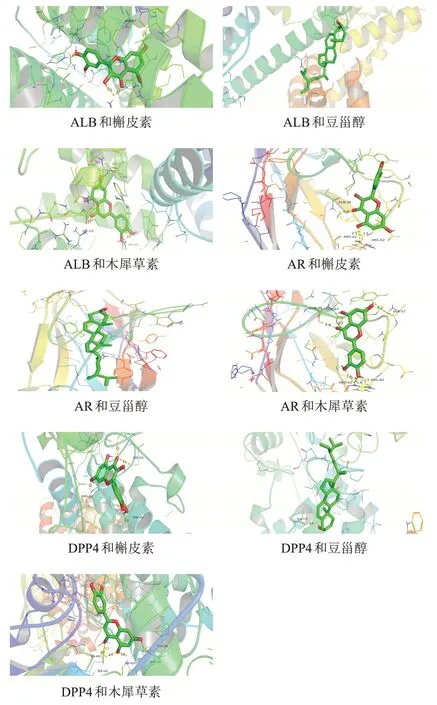
图6 参苓脾喜汤核心活性成分与CG、GIN、EGC核心靶点分子对接示意
3 讨论
目前对于EGC及GIN的治疗,西医主要使用根除Hp的三/四联疗法,运用叶酸与抗氧化剂、环氧化酶2抑制剂、抗胆汁反流等治疗药物及进行内镜下黏膜剥离术(内镜下黏膜切除术),容易引起机体耐药性[8]。中医对于CG、GIN、EGC的治疗注重未病先防和既病防变,而复方中药具有多成分、多靶点、多层次的作用特点,能有效调节CG、GIN、EGC病变微环境,改善临床症状,干预胃黏膜病理改变,在一定程度上改善CG的异型增生和癌变趋势[9]。参苓脾喜汤是在参苓白术散的基础上以党参代替人参,加大茯苓、白术的用量,去桔梗、白扁豆和甘草,加紫苏梗、陈皮、麦芽、豆蔻加减化裁而成。本方以健脾化湿为主,兼以理气醒脾和胃。中医学中无“胃上皮瘤变”病名,因其多伴胃脘胀满、疼痛、纳呆等症,故属“胃脘痛”“痞满”范畴。GIN和EGC以脾胃虚弱为本,气滞、湿热、血瘀、癌毒等病理因素为标,而气滞湿阻是GIN初期常见病机[10],参苓脾喜汤能有效截断CG、GIN、EGC病机变化,以阻断胃黏膜癌变趋势。
从分子对接结果来看,参苓脾喜汤排名前3位的活性成分与排名前3位的核心靶点均能有效对接。其中木犀草素与ALB、AR、DPP4对接良好,槲皮素与ALB、DPP4对接良好,豆甾醇与AR对接良好。槲皮素能抗癌、抗炎及抗氧化和清除自由基。祝珊珊等[11]研究表明,槲皮素能通过抑制人胃癌SGC-7901细胞增殖并诱导其凋亡,调节p-PI3K和Bcl-2蛋白表达,起到抗胃癌细胞活性的作用;喻春红等[12]研究表明,槲皮素通过抑制干扰素调节因子-8/人干扰素-γ轴,降低胃部炎症反应,增强其胃分泌功能,从而改善Hp感染诱导的慢性萎缩性胃炎。木犀草素具有抗氧化、抗炎、抗菌功效,研究表明,其可通过EGFR、STAT3等通路抑制癌细胞的增殖转化,诱导癌细胞凋亡,从而发挥抗肿瘤的作用,还可通过HIF-1α、JAK/STAT等通路抗胃癌细胞增殖和迁移、诱导胃癌细胞凋亡[13-14]。豆甾醇具有抗炎、抗肿瘤等生物活性[15-16],其可抑制炎症模型中炎症因子白细胞介素(IL)-1β 和肿瘤坏死因子(TNF)-α 的水平,可能通过调节MAPK3 和cAMP/PRKACA等信号通路调控炎症细胞因子水平,从而发挥抗炎作用[17],这与KEGG富集分析结果一致。
PPI网络结果显示,ALB、AR、DPP4、CYP3A4在炎癌转化过程中发挥了关键作用。ALB是编码白蛋白的基因,其可增强肿瘤特异性,降低药物诱导的细胞毒性,并在较长时间内保持治疗活性剂如药物浓度[18]。ALB与全身炎症反应和营养状况密切相关,参与清除自由基、维持胶体渗透压[19]。AR基因编码雄激素受体,是雄激素作用的关键基因,与多种癌症关系密切。研究表明,AR可通过刺激CCRK的表达,促进GSK3β和β-catenin磷酸化、EGFR表达及胃癌细胞的迁移、侵袭和增殖,从而促进胃癌的发生与发展,该基因在食管鳞癌上皮内瘤变中呈阳性表达,且表达随异性程度加重而增加[20-21]。DPP4是一种膜结构蛋白酶,可调节糖代谢、胰岛素分泌、胃肠动力学等。实验发现,DPP4抑制剂可减少肠道炎症并改善葡萄糖代谢,其可通过CXCR4 刺激诱导胃癌细胞恶化[22-23]。CYP3A4是人体内一种重要的细胞色素P450酶,主要在肝脏中表达,参与药物代谢和许多内源性化合物代谢。研究发现,CYP3A4的表达可能与慢性萎缩性胃炎向胃癌的潜在致癌转化有关[24]。
从KEGG 富集分析结果来看,参苓脾喜汤防治CG、GIN、EGC 病变主要涉及细胞增殖、分化与凋亡,炎症及免疫反应通路。较为显著的信号通路有cAMP、钙信号通路、IL-17、TNF等。cAMP信号通路是一种重要的细胞内信号传递机制,参与调控代谢、细胞增殖和凋亡、细胞信号转导、免疫应答等多种生物学过程。异常的cAMP/PKA信号传导与各种类型的人类肿瘤有关,可能同时具有肿瘤抑制和肿瘤促进作用。研究表明,cAMP升高和PKC下调可诱导胃癌细胞凋亡,抑制胃癌细胞增殖,从而抑制胃癌进展[25-26]。钙信号通路参与真核细胞跨膜信号转导途径,对细胞的生存与凋亡起着重要调控作用。研究发现,钙信号通路能介导胃癌细胞凋亡、促进损伤胃上皮细胞迁移和修复[27]。TNF是由单核巨噬细胞、淋巴细胞产生的细胞毒因子,可介导炎性反应、免疫、细胞凋亡或存活等生物过程,包括TNF-α、TNF-β 等。研究发现,TNF-α在慢性炎性反应介导胃癌发生的过程中发挥重要作用,且可参与胃癌发生,癌细胞增殖、侵袭和转移,及新生血管形成、上皮间质转化等多个病理过程[28]。IL-17是一类主要由活化CD4+淋巴细胞产生的具有促炎作用的细胞因子,可分泌炎性和造血性细胞因子,也与自身免疫和肿瘤发生发展密切相关,胃癌患者血清IL-17明显升高,且随着病情进展持续升高[29]。
综上所述,参苓脾喜汤可通过槲皮素、豆甾醇、木犀草素等成分作用于ALB、AR、DPP4、CYP3A4等基因,调控cAMP、IL-17、TNF、钙信号通路等抑制胃癌细胞的增殖与迁移、诱导胃癌细胞凋亡、抑制炎症反应,以防治CG、GIN、EGC 病变。研究显示,CG、GIN、EGC的发病、转归受多个靶点、通路共同影响,且参苓脾喜汤阻断CG、GIN、EGC病变优势显著。本研究可为中药复方防治EGC提供参考依据,但仍存在不足之处,需要动物实验和临床研究予以验证。
