牛支原体NM001株单克隆抗体的制备与鉴定
2024-03-08王静文陈小云杨承槐
刘 莹,王静文,张 敏,陈小云,王 磊,杨承槐
(中国兽医药品监察所(农业农村部兽药评审中心),北京 100081)
牛支原体(Mycoplasmabovis,M.bovis)是一种能引起牛的肺炎、关节炎、结膜炎以及乳腺炎等多种疾病的微生物[1]。由于其没有细胞壁,对常规的抗菌药物青霉素不敏感,且对其他的抗菌药物易产生耐药性,导致感染后很难治疗[2-3],严重危害养牛业的健康发展[4]。我国自2008年分离到牛支原体证实该病原存在以来[5-6],全国多个地区均有报道,且已给我国的养牛业造成了重大的经济损失[7]。近期我国牛支原体血清流行病学调查结果显示,我国云南省内牛血清样本的牛支原体抗体阳性率可达到36.32%[8],说明我国牛支原体的诊断和防控急需加强。
目前,分离培养仍然是支原体最传统的鉴定和诊断方法,但该方法耗时长且敏感度很低。梁月梅等人的研究结果表明,支原体分离培养的敏感度仅为PCR检测方法的1/9.5,说明聚合酶链式反应的诊断更高效,特异性和敏感性更强[9]。荧光PCR(探针法)方法的应用使牛支原体检测的敏感度进一步提高,但是上述检测方法需要特殊的仪器设备,不易在基层的养殖场使用[10]。可视化环介导等温扩增法可在一定的程度上克服上述检测方法的难题,但该方法容易因环境污染出现假阳性[11-12],急需建立快速和准确的诊断方法来预防和控制牛支原体,而基于特异性高的单克隆抗体的抗原检测方法的建立是一种重要的解决方案。本研究利用前期分离获得的牛支原体内蒙分离株NM001[13]作为免疫原并结合无乳支原体等病原来筛选和制备牛支原体单克隆抗体,从而为后期牛支原体快速、准确诊断方法的建立提供物质基础。
1 材料与方法
1.1 试验材料 SP2/0骨髓瘤细胞株、牛支原体NM001株均为本实验室保存;支原体EZH液体培养基为本实验室制备;SPF级雌性6周龄BALB/c小鼠、经产BALB/c雌鼠购自北京维通利华实验动物技术有限公司;蛋白Marker、Western Blot Marker,均购自南京金斯瑞生物科技有限公司;MEM培养液购自Gibco公司;马血清购自Gibco公司;胎牛血清购自PAN公司;聚乙二醇(PEG 1450)、弗氏佐剂、HAT和HT选择性培养基均购自Sigma公司;Mab亚类鉴定试剂盒均购自于北京博奥龙公司;HRP 标记的羊抗鼠IgG购自宝生物工程(大连)有限公司;细胞培养板、细胞培养瓶均购自Corstar公司。
1.2 免疫原的制备 牛支原体NM001株在1000 mL EZH培养基37 ℃培养72 h后,取适量作计数用,剩余用终浓度为0.4%的甲醛灭活48 h,9000 r/min离心45 min收集菌体,再用灭菌PBS洗涤5次,用BCA试剂盒测定总蛋白浓度,于-80 ℃冻存。
1.3 动物免疫 以牛支原体NM001株灭活菌体用等体积弗氏佐剂乳化,皮下多点注射免疫5只雌性BALB/c小鼠,每只小鼠每次免疫抗原剂量为100 μg。每隔14 d免疫1次,三免后7~10 d,眼眶采血适量,用间接ELISA 法测定血清效价,若血清效价达到融合要求(效价高于12800),则在融合前三天加强免疫,直接用菌体蛋白腹腔注射,剂量为50 μg/只。免疫程序如表1。

表1 小鼠的免疫程序Tab 1 The vaccination strategy of mice
1.4 细胞融合 取免疫小鼠脾细胞与SP2/0细胞(10∶1)在PEG1450的作用下融合。具体方法:取50 mL离心管将细胞混合离心,弃上清,加入1 mL 37 ℃预热的PEG1450,轻轻旋动离心管,缓慢加入10 mL无血清DMEM培养基,离心后弃上清;用含20%胎牛血清的HAT培养基重悬细胞,铺布在含有饲养细胞的96孔细胞培养板中,细胞培养板放入培养箱中培养。
1.5 杂交瘤细胞的筛选 筛选用间接ELISA,所用包被抗原的制备方法是:分别收集牛支原体培养物、无乳支原体培养物、山羊支原体山羊肺炎亚种培养物,反复冻融8次后超声波破碎,用BCA试剂盒测定蛋白浓度,分装保存于-20 ℃,包被浓度经滴定确定为2 μg/mL。采用间接ELISA法筛选与牛支原体反应阳性、与无乳支原体反应阴性、与山羊支原体山羊肺炎亚种反应阴性的杂交瘤细胞,有限稀释法分别亚克隆、建株、扩大培养,并置于液氮中长期保存。
1.6 杂交瘤细胞分泌抗体的亚型鉴定 按照北京博奥龙公司单抗亚型鉴定试剂盒所附带的说明书操作流程,用2株杂交瘤细胞培养上清分别检测单抗亚型。
1.7 牛支原体单抗腹水的制备与纯化 选取经产的健康BALB/c小鼠,腹腔注入0.5 mL弗氏不完全佐剂。10 d后再向小鼠腹腔内注射杂交瘤细胞,每只小鼠注射约106个细胞。当小鼠腹围明显膨大,行动不便时,无菌抽取腹水。选用Protein A (GE Healthcare 17-5079-01)亲和柱纯化方法进行纯化。
1.8 单抗特异性分析
1.8.1 单抗间接ELISA效价的测定 用PBS做稀释液,杂交瘤细胞培养上清、纯化后的腹水从1∶10开始做倍比稀释,按上述建立的牛支原体间接ELISA方法测定效价,测定OD450 nm后以阳性值/阴性值>2.1的最大稀释度为样品抗体效价。
1.8.2 ELISA检测单抗特异性 将无乳支原体、山羊支原体山羊肺炎亚种、丝状支原体山羊亚种、绵羊肺炎支原体、牛巴氏杆菌的全菌蛋白以及马血清按照1.5项方法处理,包被ELISA板,2 μg/mL,以间接ELISA方法测定各株单抗的特异性。
1.8.3 Western Blot鉴定单克隆抗体反应性 将牛支原体和马血清进行SDS-PAGE电泳并转印(50 V,2 h)至PVDF膜上,5%脱脂奶封闭90 min。用不同种类的纯化后单克隆抗体(1∶1000稀释)与不同的牛支原体泳道分别孵育(37 ℃,1 h), 用单克隆抗体的等量混合物(最终稀释度为1∶1000)与马血清泳道在相同条件下反应,PBST洗涤后,与 HRP-羊抗鼠IgG(1∶5000稀释)室温作用0.5 h,洗涤后,化学发光检测仪检测。
2 结 果
2.1 免疫原的制备 通过培养、灭活、洗涤,获得浓度为1.2 mg/mL的牛支原体NM001株,SDS-PAGE鉴定结果如图1所示。

M: 蛋白Marker; NM001: 牛支原体分离株NM001M: protein Marker; NM001: The strain of Mycoplasma bovis NM001图1 牛支原体分离株NM001的SDS-PAGE鉴定Fig 1 The identification of the strain of Mycoplasma bovis NM001 by SDS-PAGE
2.2 杂交瘤细胞的筛选和分泌抗体的亚型鉴定 细胞融合后,经间接ELISA筛选出与牛支原体反应阳性、与无乳支原体和山羊支原体山羊肺炎亚种反应阴性的杂交瘤细胞阳性克隆,经过3次亚克隆后,得到两株能稳定分泌抗牛支原体单克隆抗体的杂交瘤细胞株,分别为2C5和7G3,杂交瘤细胞上清的间接ELISA效价可达6.4×103和1.2×104。如表2所示,抗体亚型鉴定结果表明,2株分泌的单克隆抗体均属于IgG1亚型,轻链均是λ型。

表2 单克隆抗体亚型的鉴定Tab 2 Identification of antibody isotyping to monoclonal antibodies
2.3 单克隆抗体2C5和7G3的制备与纯化 利用经产小鼠制备杂交瘤细胞株2C5和7G3的腹水,将收集到的腹水用Protein A(GE Healthcare 17-5079-01)亲和柱纯化方法进行纯化,结果如图2所示,获得纯度较高的单克隆抗体2C5和7G3,其浓度可达2.1 mg/mL和3.2 mg/mL。

M: 蛋白Marker; 1: 单克隆抗体2C5;2: 单克隆抗体7G3M: protein Marker; 1: Monoclonal antibody 2C5; 2: Monoclonal antibody 7G3图2 单克隆抗体的纯化Fig 2 Purification of 2C5 and 7G3
2.4 单克隆抗体2C5和7G3的鉴定
2.4.1 单克隆抗体2C5和7G3的间接ELISA效价测定 选用牛支原体作为包被抗原建立的间接ELISA方法对单克隆抗体2C5和7G3进行效价测定,结果显示单克隆抗体2C5和7G3的效价可达1.02×105和4.09×105,工作浓度分别为2.06×10-5mg/mL和7.82×10-6mg/mL。
2.4.2 单克隆抗体2C5和7G3的特异性检测 如表3所示,间接ELISA结果表明,2C5和7G3与无乳支原体、山羊支原体山羊肺炎亚种、丝状支原体山羊亚种、绵羊肺炎支原体、牛巴氏杆菌以及马血清均不反应。

表3 单克隆抗体特异性鉴定Tab 3 Specific identification of monoclonal antibodies
2.4.3 单克隆抗体2C5和7G3与牛支原体反应的Western Blot鉴定 Western Blot结果表明,单克隆抗体2C5和7G3均能与牛支原体全菌蛋白发生反应,且两株单抗识别的蛋白大小相近,均在60 kD左右,而两株单抗均不与马血清发生反应。
3 讨 论
单克隆抗体的制备是建立优良抗原检测方法的基础,而免疫原的选择是单克隆抗体制备的关键。虽然研究者通过基因组学以及蛋白组学分析技术已经鉴定出了许多相对保守的抗原蛋白(如P26、P48、P81、HSP60、α-烯醇化酶、GAPDH、EF-Ts、MilA以及TrmFO等)[14],但很多蛋白的免疫保护作用(如Vsps、PMB67以及GAPDH)[15-16]未得到确认,导致单一的蛋白很难作为免疫原来制备牛支原体的单克隆抗体。为了制备出优良的抗牛支原体单克隆抗体,选择以牛支原体全菌体作为免疫原。为了保证灭活彻底且免疫原性不被破坏,选择终浓度为0.4%的甲醛灭活48 h。
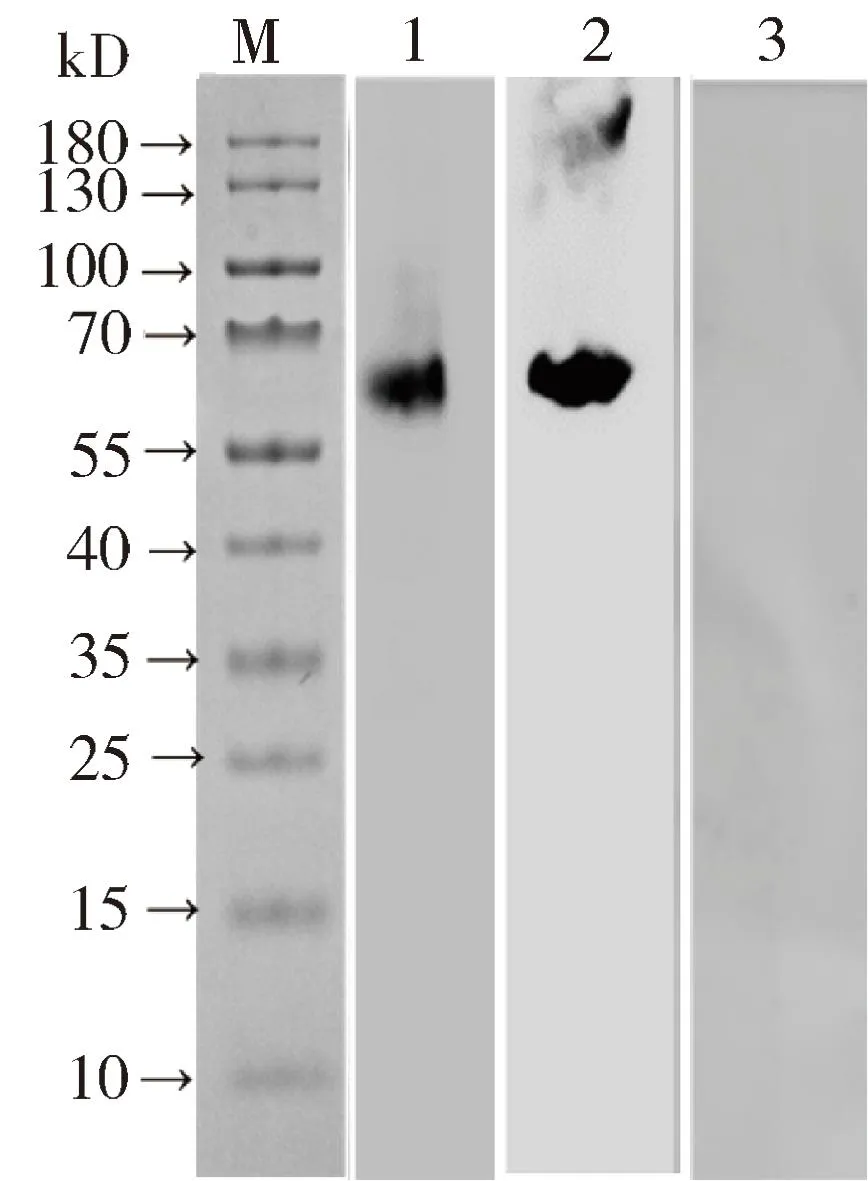
M. 蛋白Marker;1. 2C5与牛支原体的反应;2. 7G3与牛支原体的反应;3. 2C5和7G3等量混合物与马血清的反应M: Protein Marker; 1: The interaction of Mycoplasma bovis with 2C5; 2: The interaction of Mycoplasma bovis with 7G3; 3: The interaction of horse serum with mixture of 2C5 and 7G3图3 2C5和7G3与牛支原体反应的Western Blot 鉴定Fig 3 The identification of Mycoplasma bovis with 2C5 and 7G3 by Western Blot
已有的研究表明牛支原体和无乳支原体PG2同源性很高[17-18],以牛支原体为免疫原制备的单抗,易产生与无乳支原体发生交叉反应的克隆株。任泽民等以牛支原体全菌体制备的6株单克隆均能够与无乳支原体发生交叉反应[19]。为此,本研究在杂交瘤细胞株的筛选阶段,用牛支原体包被ELISA板做阳性筛选,用无乳支原体、山羊支原体山羊肺炎亚种包被ELISA板做阴性筛选,从源头淘汰发生交叉反应的克隆株,从而保证筛到特异性高的牛支原体单抗。此外,为了排除马血清对单克隆抗体筛选的干扰,本研究采用灭菌PBS将灭活后的牛支原体洗涤了5次,同时通过ELISA和Western Blot方法证实了单克隆抗体与马血清无反应性。
ELISA和Western Blot结果均表明本研究制备的两株单克隆抗体与牛支原体能够发生很好的特异性结合,但两株单抗针对的抗原表位还未知。本研究前期分别通过原核表达系统获得了3种常见的重组牛支原体蛋白,但均未能与获得的两株单抗发生特异性的反应,这可能是由于牛支原体抗原复杂,未获得单克隆抗体的靶标蛋白,或者是由于原核表达的重组蛋白丧失了单克隆抗体针对的天然表位。上述获得的牛支原体单克隆抗体一方面可与灭活的支原体结合,建立牛支原体抗体阻断ELISA方法;另一方面可将获得的单克隆抗体作为包被抗原建立用于双抗夹心检测牛支原体病原。为了将抗牛支原体单克隆抗体更好地运用到牛支原体的抗原/抗体血清学检测以及牛支原体NM001株的致病性研究,后期需要投入更多的研究来分析获得这两株特异性单克隆抗体针对的抗原表位信息。
