羊链球菌CVCC55001、CVCC55002株对昆明小鼠的致病性研究
2024-03-08张一帜任小侠辛凌翔朱良全王秀丽刘元杰
张一帜,任小侠,辛凌翔,朱良全,孙 淼,李 建,张 媛,冯 妍,王秀丽,刘元杰,刘 燕
(中国兽医药品监察所(农业农村部兽药评审中心),北京 100081)
羊链球菌病是由溶血性链球菌所引起的一种急性热性传染病,属链球菌马链球菌兽疫亚种(Streptococcusequisubspecieszooepidemicus)[1]。该病原为革兰氏阳性球菌,多呈链条状。羊通常于气候寒冷时出现发病,幼龄羊及母羊的发病率较高。发病多为急性型,发病羊出现体温升高(大于41 ℃)、精神萎靡、行动不便、眼结膜充血、咽喉肿胀,剖检可见胆囊肿大以及纤维素性肺炎[2]。
我国目前发现的羊链球菌由国家兽医微生物菌(毒)种保藏中心保藏并编号为CVCC55001、CVCC55002。此两种菌为羊链球菌灭活疫苗效力检验用的强毒菌种,也是羊链球菌病疫苗的生产用菌种,最早由青海牧医所于青海省贵南县分离所得。CVCC55001、CVCC55002血清型均为兰氏C型,能水解淀粉,不发酵水杨苷[3]。红霉素、四环素、青霉素、金霉素等抗生素类以及磺胺类药物都能够对该菌起到良好的杀伤作用[4]。目前对于该菌的感染及致病机理方面的研究较为欠缺,建立一种稳定可靠的感染动物模型对于羊链球菌病的研究至关重要。
1 材料与方法
1.1 材料
1.1.1 菌种 羊链球菌CVCC55001、CVCC55002 株,2016年3月22日,由国家兽医微生物菌(毒)种保藏中心提供。链球菌马兽疫亚种CVCC55138,2014年2月25日,由国家兽医微生物菌(毒)种保藏中心提供。
1.1.2 培养基及试剂 马丁琼脂培养基、胰蛋白胨大豆琼脂(TSA)培养基、缓冲肉汤培养基、生理盐水、均购自北京中海生物技术有限公司;荚膜染色试剂盒购自Solarbio公司、ATB 链球菌快速鉴定试剂盒、哥伦比亚血琼脂平板购自Bio Mérieux公司;新生牛血清购自四季青生物;革兰氏染色液购自海博生物;荚膜染色液购自源叶生物;链球菌分型试剂盒购自Oxoid公司。
1.1.3 实验动物 18~22 g SPF级昆明小鼠,购自北京维通利华实验动物技术有限公司。
1.2 方法
1.2.1 菌液培养 开启冻干羊链球菌CVCC55001、CVCC55002株各一支,用0.5 mL马丁肉汤溶解后,分别接种含10%绵羊脱纤血马丁琼脂平板(以下简称血平板)2付,37 ℃培养18 h。之后挑取该平板上的典型菌落,分别接种含10%绵羊脱纤血琼脂斜面2支,37 ℃培养24 h,血斜培养物呈灰色、半透明、湿润、粘稠。将血斜培养物划取少量接种含10%新生牛血清的马丁肉汤,37 ℃静置培养24 h后,肉汤培养物一致混浊,无菌膜。

1.2.3 菌液冻存与定量 将培养好的羊链球菌缓冲肉汤培养物加入灭菌甘油(终浓度为20%),3 mL/支分装于15 mL离心管中,置于冰箱(-70 ℃以下)冻存。冻存3 d后进行活菌计数,分别取出CVCC55001、CVCC55002株各一支,使用缓冲肉汤进行105倍稀释后,再进行3倍稀释,之后吸取0.1 mL加至含10%新生牛血清的TSA培养基中,37 ℃培养24 h计数。之后分别于冻存后7 d、21 d、49 d、63 d进行活菌计数,评价羊链球菌的冻存保存期。
1.2.4 小鼠测毒 购买18~22 g SPF级昆明小鼠于ABSL-2级负压动物舍独立通气笼具内饲养,按照活菌计数预数结果分别将CVCC55001、CVCC55002菌液稀释至5、15、25、35、45、55 CFU/mL。0.2 mL/只腹腔注射昆明小鼠,每组10只。每日观察统计小鼠状态,无菌状态下剖检死亡小鼠,采集心血,收集心、肝、脾、肺、淋巴组织固定后进行H&E染色,对比各组小鼠病变情况。
1.2.5 细菌形态和生化鉴定 无菌环境采集死亡小鼠心血,划线接种哥伦比亚血琼脂平板,37 ℃培养24 h,挑取典型单菌落进行荚膜染色,使用ATB链球菌快速鉴定试剂盒参照使用说明书对于心血培养菌进行生化特性鉴定。
1.2.6 PCR鉴定 根据GenBank中马链球菌兽疫亚种16S rDNA基因序列(定位号:EU784820.1)设计引物(上游引物:TATCTGTGAGTCGCGAACGG;下游引物:GCCGTCCCTTTCTGGTTAGT),目的片段大小为424 bp,引物由华大基因合成。反应体系为25 μL(详见表1)。反应条件为预变性94 ℃ 5 min;变性94 ℃ 30 s,退火55 ℃ 30 s,延伸72 ℃ 30 s,循环35次;终延伸72 ℃ 10 min。结束后将扩增产物进行核酸电泳检测。

表1 PCR反应体系Tab 1 PCR reaction system
1.2.7 ANI检测 将菌种液体培养物加入甘油(20%终体积),委托南京派森诺基因科技有限公司进行ANI检测分析,选用参考基因组为Streptococcusequisubsp.zooepidemicus(NCBI编号:ASM1568945v1),使用OAT软件分析结果。
2 结果与分析
2.1 羊链球菌CVCC55001、CVCC55002的冻存保存期评价 由于活菌计数需要培养一定时间,其结果的延后性导致无法实时明确攻毒菌液的活菌含量。目前一般采用培养及保存条件相同的菌液,以预实验活菌计数结果确定正式实验的菌液浓度,本研究通过对羊链球菌CVCC55001、CVCC55002的冻存菌液的活菌数进行评测,确定其活菌数相对稳定的期限。将新鲜羊链球菌CVCC55001、CVCC 55002缓冲肉汤培养物加入灭菌甘油至甘油终浓度为20%(W/V),使用15 mL离心管进行分装,3 mL/支,标记后放入-70 ℃以下冰柜进行冻存。分别于冻存后3 d、7 d、21 d、35 d、49 d、63 d、77 d各取出一支羊链球菌CVCC55001、CVCC 55002冻存菌液,进行活菌计数,结果如表2所示,说明本方法保存的菌液在35 d内细菌浓度相对稳定,以预数浓度作为实际浓度进行使用偏差小于10%,保存超过5周后菌数下降较快,保存77 d后分别下降了45.9%、51.2%。

表2 CVCC55001、CVCC55002菌液冻存保存期评价结果Tab 2 Evaluation results of freezing storage period of strain CVCC55001 and CVCC55002 bacterial liquid
2.2 羊链球菌CVCC55001、CVCC55002平均核苷酸一致性分析检测(ANI) 之前的研究已经利用经典生化反应鉴定及16S rDNA测序鉴定CVCC55001、CVCC55002均属链球菌马链球菌兽疫亚种(Streptococcusequisubspecieszooepidemicus)[1]。本研究使用平均核苷酸一致性分析(ANI)对于CVCC55001、CVCC55002与链球菌马链球菌兽疫亚种进行验证性比对。ANI是基于物种全基因组序列,通过分析比较同源基因序列来判定物种间的遗传关联性的重要参数,可以直观表示物种间的亲缘关系远近。ANI与16S rDNA相比,其亲缘关系计算中并不受单个基因或者少数基因变化的遗传速率和基因水平转移影响。属间、种间及亚种间两两菌株间ANI与其分类地位相关,具有明显的属种特异性,一般属间的ANI 值分布于50%~65%,种间的ANI 值分布65%~90%,亚种间的ANI 值分布于90%~96%。将CVCC55001与CVCC55002菌种制备为甘油菌后送至公司测序,使用参考基因组Streptococcusequisubsp.zooepidemicus进行比对,使用直系同源修正得到OrthoANI值[5](表3),结果显示,CVCC55001、CVCC55002与链球菌马链球菌兽疫亚种应属同一亚种,且CVCC55001与CVCC55002之间相似度非常高。
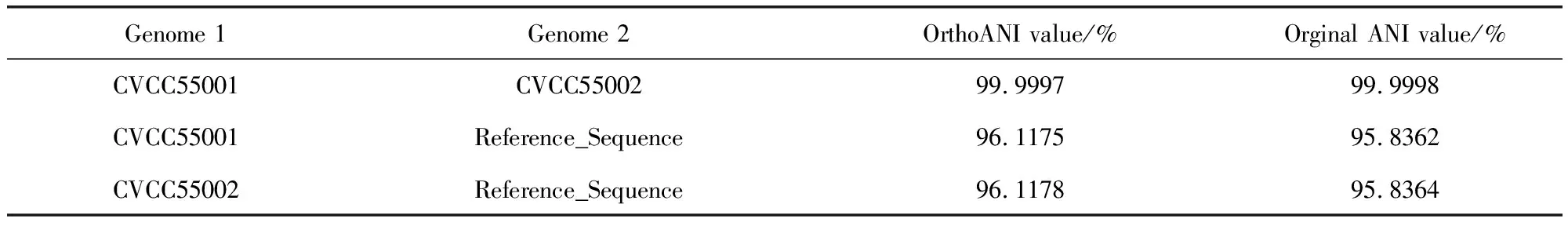
表3 CVCC55001、CVCC55002平均核苷酸一致性分析结果Tab 3 Average Nucleotide Identity Test Results of Strain CVCC55001 and CVCC55002
2.3 两株羊链球菌对昆明小鼠毒力测定 将稀释好的CVCC55001、CVCC55002腹腔注射18~22 g昆明小鼠,记录小鼠死亡情况(表4)。结果显示CVCC55001对于昆明小鼠的最小致死剂量为9 CFU;CVCC55002对于昆明小鼠的最小致死剂量为11 CFU。
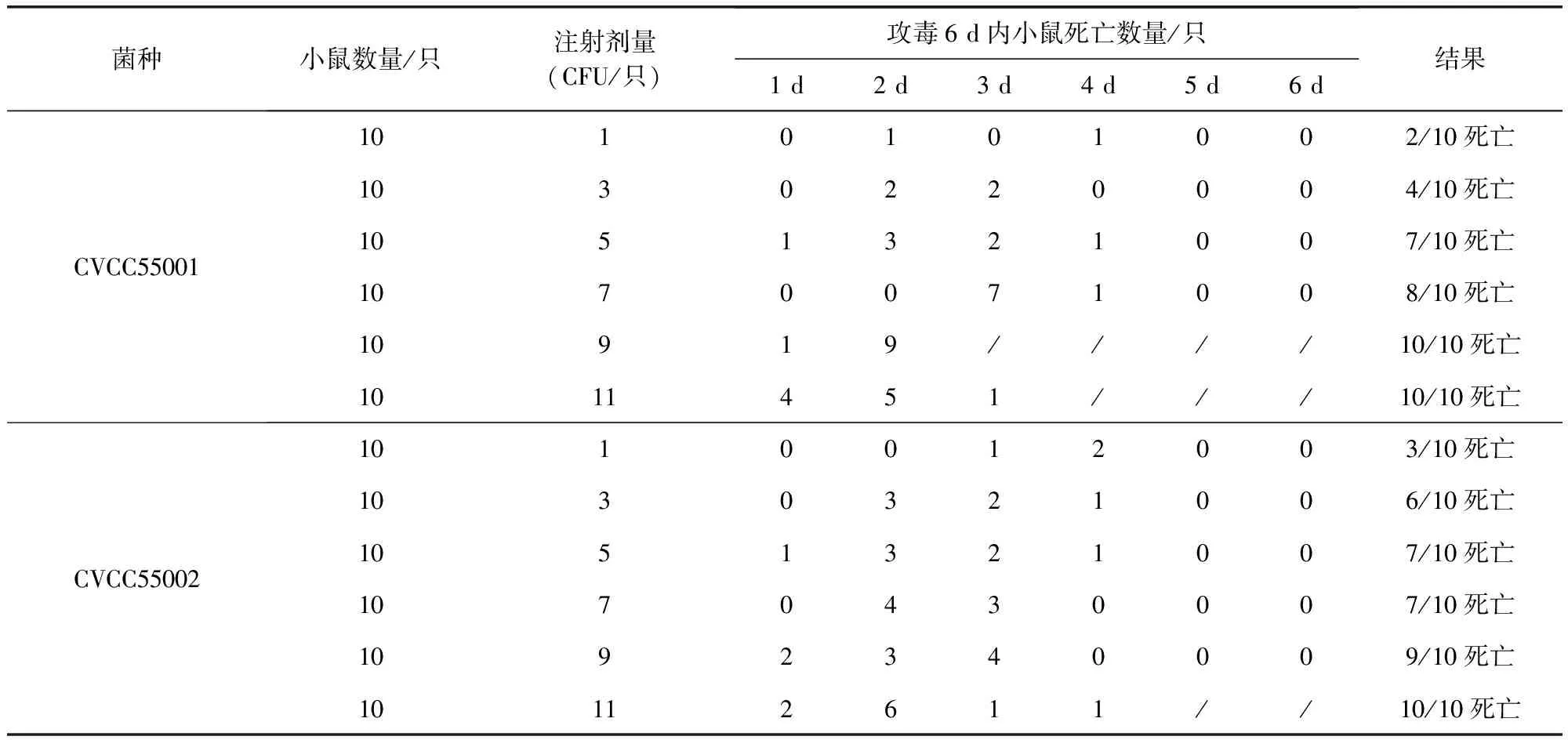
表4 CVCC55001、CVCC55002菌种毒力测定结果Tab 4 Toxicity test results of strain CVCC55001 and CVCC55002
2.4 羊链球菌对昆明小鼠攻毒后临床及剖检症状攻毒后每日观察小鼠临床表现,攻毒12 h后部分小鼠开始出现萎靡厌食、呼吸急促的状况,部分组(5 CFU~11 CFU组)小鼠开始出现死亡,1 CFU组小鼠基本正常。攻毒24 h至72 h为死亡高峰期,大部分小鼠在出现颤抖、站立困难、背毛凌乱等情况后的12 h内死亡,至攻毒96 h后不再出现新增死亡小鼠。空白对照组小鼠均表现正常。
对于两株菌攻毒死亡小鼠进行剖检时发现,CVCC55001株及CVCC55002株攻毒死亡小鼠均出现胸腔积液,肝脏出血,边缘泛白,肠道液化性坏死,脾脏肿大、出血(图1、图2)。

图1 CVCC55001株(左上)、CVCC55002株(左下)攻毒后小鼠剖检情况Fig 1 Autopsy of mice after strain CVCC55001(top left)and CVCC55002(bottom left)challenge
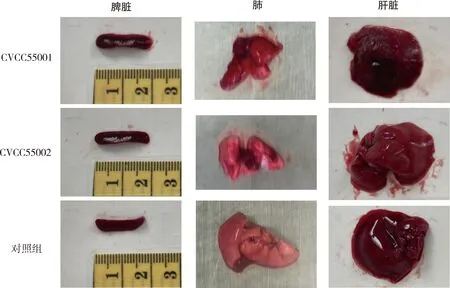
图2 CVCC55001株、CVCC55002株攻毒后小鼠脾脏、肺、肝脏病变情况Fig 2 Pathological changes of spleen, lung and liver in mice after strain CVCC55001 and CVCC55002 challenge
2.5 羊链球菌攻毒昆明小鼠的病理变化 对于小鼠进行剖检,分别取下攻毒组和空白组小鼠的心、肝、脾、肺、肠道组织放入4%多聚甲醛溶液中固定,之后进行H&E染色,结果如图3所示,羊链球菌感染后肠道黏膜层广泛自溶,呈无结构的嗜酸性物,肠绒毛及肠腺结构消失,而对照组黏膜层上皮完整,肠绒毛丰富均匀,固有层肠腺排列紧密,肌层肌细胞形态正常;羊链球菌感染小鼠肺脏肺泡壁轻度增厚,肺泡间距增宽,并伴有少量的粒细胞浸润,多见血管淤血,部分支气管腔内及周围肺泡腔内见少量红细胞;对照组小鼠肝细胞排列规则、整齐,肝窦无明显扩张或挤压,未见明显坏死、增生及炎性改变,羊链球菌感染组与对照相比,肝窦轻度淤血、扩张,肝细胞出现大量坏死,胞核固缩深染、碎裂或溶解,多见血管结构消失,与周围组织融合呈无结构的嗜酸性物质;对照组视野内心肌纤维着色均匀,细胞分界清楚,走形一致,间质未见异常,羊链球菌感染组间质轻度水肿,结缔组织排列疏松,同时伴有少量的淋巴细胞浸润,心肌细胞间距增宽;对照组脾脏视野内白髓与红髓分布分界清晰,细胞数量丰富,排列紧密。羊链球菌感染组小鼠脾脏组织广泛坏死、出血,组织原有结构消失,广泛可见坏死的细胞碎片、大量的红细胞,可见大量的粒细胞呈弥散性浸润。
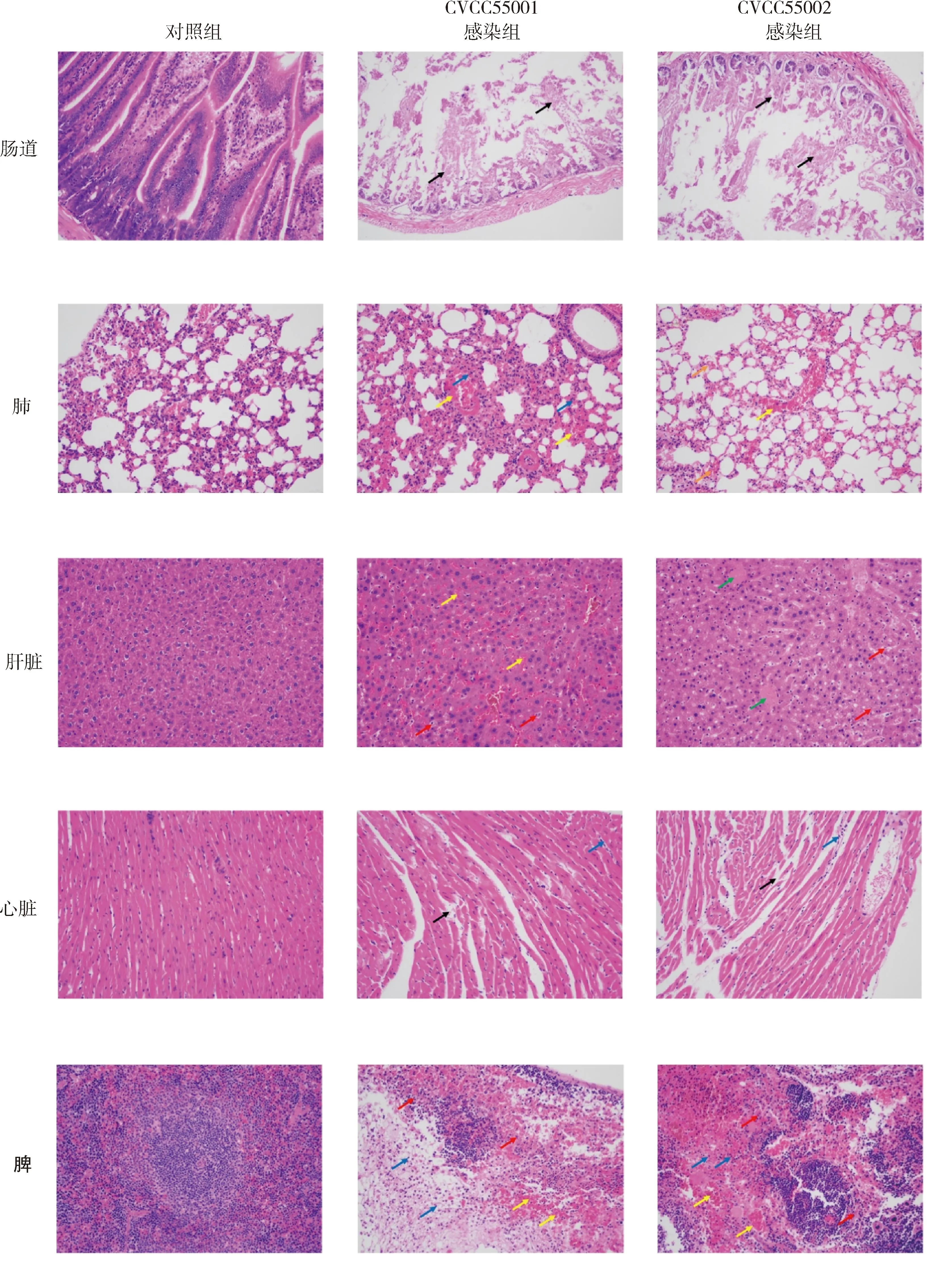
图3 羊链球菌CVCC55001株、CVCC55002株攻毒昆明小鼠的病理变化(200×)Fig 3 Pathological changes in KM mice after strain CVCC55001 and CVCC55002 challenge(200×)
2.6 羊链球菌形态和生化特性鉴定 将攻毒小鼠进行剖检,分别取感染小鼠心血进行划线,37 ℃培养24 h后,挑取典型单菌落进行荚膜染色,结果中围绕着色菌体(蓝紫色)外的一层透明物质即为荚膜(图4红色箭头),结果显示CVCC55001和CVCC55002株羊链球菌均具有荚膜。将羊链球菌哥伦比亚血琼脂平板培养物收集后,按照ATB链球菌快速鉴定试剂盒说明书制备菌悬液后进行生化特性鉴定,CVCC55001和CVCC55002株羊链球菌结果均符合马链球菌兽疫亚种生化特性(表5)。

图4 羊链球菌CVCC55001株、CVCC55002株攻毒昆明小鼠分离菌荚膜染色(100×)Fig 4 Capsule staining of bacteria isolated from infected mice after strain CVCC55001 and CVCC55002 challenge(100×)
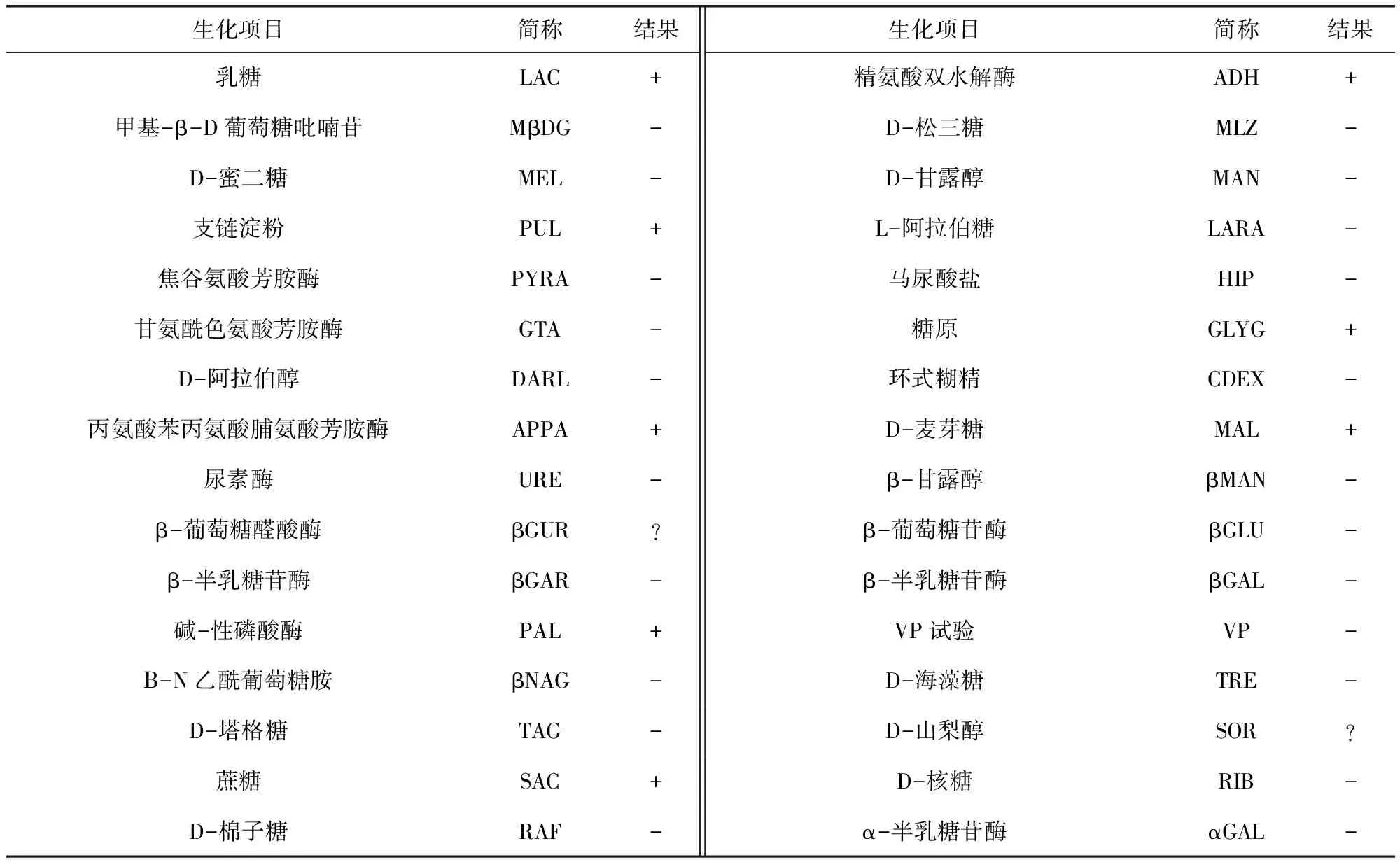
表5 CVCC55001、CVCC55002菌种生化特性检定结果Tab 5 Biochemical characteristics results of strain CVCC55001 and CVCC55002
2.7 羊链球菌PCR鉴定 选取攻毒小鼠分离菌平板上的典型单菌落加入TSB(含5%血清)中,静置过夜培养后进行PCR鉴定,同时分别取CVCC55001标准菌、大肠杆菌BL21的新鲜菌液作为阳性对照和阴性对照,结果显示扩增到长度约424 bp 的目的条带(图5),与阳性对照片段大小一致。
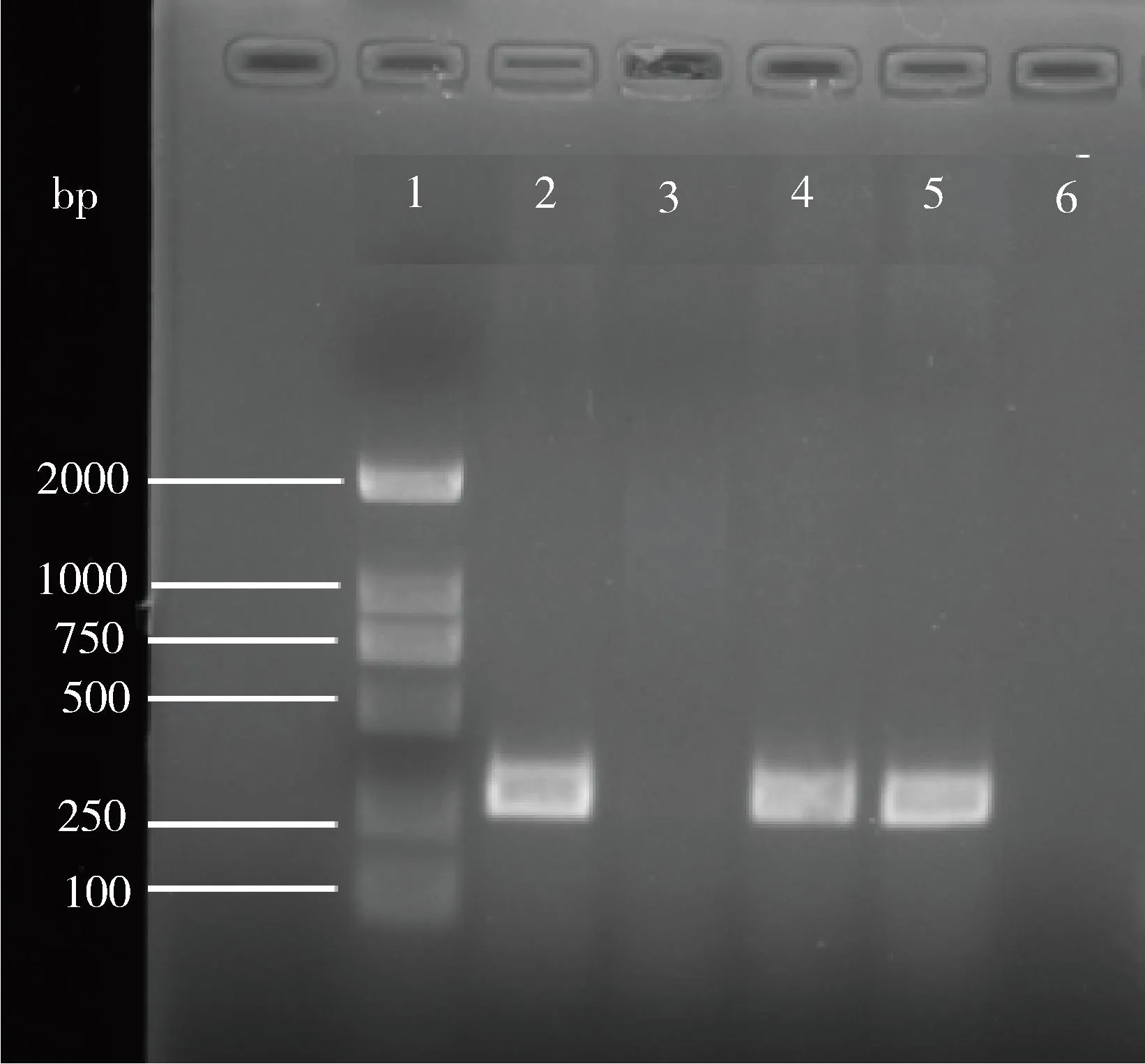
1: BM2000分子量标准;2: 链球菌马兽疫亚种CVCC55138;3: 大肠杆菌BL21株;4: CVCC55001株攻毒小鼠分离菌; 5: CVCC55002株攻毒小鼠分离菌;6:空白对照1: BM2000 Marker;2: CVCC55001 Standard Strain;3: E. coli BL21 Strain;4: CVCC55001 strain isolated from mice;5: CVCC55002 strain isolated from mice;6:Blank control图5 羊链球菌CVCC55001株、CVCC55002株攻毒昆明小鼠分离菌PCR鉴定结果Fig 5 PCR identification of bacteria isolated from infectedmice after strain CVCC55001 and CVCC55002 challenge
3 讨 论
羊链球菌CVCC55001和CVCC55002株经鉴定为兰氏C群,属于链球菌马链球菌兽疫亚种[1]。它作为机会病原体在一定条件下引起马呼吸道及生殖道感染。人感染该病原体会导致严重或潜在的致命疾病,包括菌血症、心内膜炎、关节炎、肾小球肾炎、坏死性肌炎和脑膜炎[6]。该菌宿主广泛,经报道证实能够感染人、马、牛、羊、猪、驴、狐狸、兔、豚鼠、狗、猫和猴等并引起严重病症[7-8]。
本研究以昆明小鼠为实验动物模型,测定CVCC55001和CVCC55002对于昆明小鼠的最小致死量,并将死亡小鼠的临床症状、剖检症状及病理变化进行全面梳理。值得注意的是从不同宿主体内分离得到的菌种对于不同物种的感染能力也存在差异,Hau等使用两株链球菌马链球菌兽疫亚种感染5月龄猪,结果证实由猪体内分离强毒株能够引起猪严重的败血症,而从豚鼠中分离得到的链球菌马链球菌兽疫亚种对于猪毒性显著降低,只引起部分系统性症状,未导致猪死亡[9]。Bin T等使用猪源马兽疫亚种链球菌CVCC55138攻毒BALB/c小鼠,测得BALB/c小鼠对该菌的致死剂量为2×105CFU[10]。本研究中小鼠对于羊源CVCC55001和CVCC55002的致死剂量分别为9 CFU和11 CFU,可见不同小鼠品系、不同菌株以及菌株来源等对于小鼠模型及毒力均有一定程度的影响。
关于马链球菌兽疫亚种表面蛋白的研究显示多种细菌表面蛋白在宿主和病原体的互作中发挥着重要作用,这些蛋白作为猪源血清学验证的生物标记抑或亚单位疫苗组分[11]。其中C5a肽酶作为链球菌入侵宿主上皮细胞的重要分子,经验证能够有效保护小鼠免于马链球菌兽疫亚种致死剂量攻毒导致的死亡[12]。马链球菌兽疫亚种表面典型LPxTG基序细胞膜锚定结构域MAP具备良好的免疫原性,是亚单位疫苗的潜力候选抗原。此外,Wei等证实马链球菌兽疫亚种的荚膜多糖对于其致病性至关重要,而缺失株在降低了对于小鼠的毒力之外提供了对于马链球菌兽疫亚种强毒株的有效保护作用,为该菌减毒活疫苗的研制提供了思路和方向[13]。
目前我国市场可售的羊链球菌疫苗包括羊败血性链球菌灭活疫苗和羊败血性链球菌活疫苗两种。这两种疫苗的检验强毒菌种为CVCC55001和CVCC55002,根据质量标准规定,羊败血性链球菌灭活疫苗和羊败血性链球菌活疫苗在进行效力检验时,需要使用本动物进行强毒攻毒[14]。目前该产品在实际检验中存在新鲜菌液菌数差异大、试验重复性差和生物安全风险高等问题,且使用本动物进行检验存在健康状态不可控、筛选困难、操作繁琐、人力物力耗费高等问题。因此,针对上述疫苗产品开展效力检验替代方法研究尤为必要,本研究建立了羊链球菌检验用强毒株CVCC55001、CVCC55002株的昆明小鼠攻毒感染模型,确定了最小致死剂量,并对其感染和致病性研究展开初步探索,为该菌种毒力、致病机制及疫苗研究评价提供了平台支撑。
猜你喜欢
——和田盘羊
