荷花PIN 基因家族的鉴定及非生物胁迫表达分析
2024-03-08程志鹏汪仲毅匡健华赵晗茜陈龙清胡慧贞
程志鹏,汪仲毅,匡健华,赵晗茜,陈龙清,胡慧贞
(西南林业大学 园林园艺学院,云南省功能性花卉资源及产业化技术工程研究中心,昆明 650224)
生长素是最重要的信号分子之一,不仅在植物生长和发育过程中发挥着重要作用[1],还能调节植物对不同生物和非生物胁迫做出反应[2],而生长素的调控功能主要取决于生长素极性运输建立起的时空不对称分布[3]。生长素的极性运输是由生长素转运载体介导的,包括输入载体AUX/LAX(Auxin 1/like AUX 1)、输出载体PIN(PIN-formed)和兼具输入输出功能载体ABCB/PGP(ATP binding cassette B subfamily/P-glycoprotein)[4]。其中,PIN家族蛋白在生长素定向极性运输和局部生长素梯度的形成中起着关键作用[5]。PIN 家族蛋白包含保守的N 端和C端跨膜结构域和可变的中央亲水环,可分为具有长中央亲水环的经典型PIN 蛋白和具有短亲水环的非经典型PIN 蛋白[6-7]。
PIN 家族成员在胚胎发育、根系生长、维管束分化、向光性、向重力性等植物发育过程的各个方面起着至关重要的作用[8]。在拟南芥中,At PIN1调节茎尖分生组织、根伸长和木质部的发育[9];At PIN2影响根系向重力性[10];At PIN3、4、7参与侧根生长和根系重力响应[11-13];At PIN5介导生长素从细胞质向内质网的转运并调节生长素稳态和代谢[14];At PIN6调节侧根形成[7];At PIN8介导生长素从内质网运输到细胞质[15]。玉米中At PIN1的直系同源基因Zm PIN1a和Zm PIN1b调控胚乳和胚胎发育[16],水稻中OsPIN1b在不定根的形成和分蘖中起重要作用[17],在苔藓植物地钱中,Mp PIN1调控分生组织的再生、芽向光性和根的向重力性[18]。此外,PIN 也响应生物和非生物胁迫。在大豆中,15个Gm PIN基因响应干旱胁迫[19];在小麦中,多个Ta PIN基因在生物胁迫(真叶虫和白粉病)和非生物胁迫下(干旱和高温)被显著诱导[20];在甜瓜中,Cm PIN13和Cm PIN18参与了对高温胁迫的调控[21];在水稻中,过表达OsPIN3可提高植株的耐旱性[22],且OsPIN9基因可通过调节ROS稳态来调节植株的耐寒性[23];在拟南芥中,At PIN2可以在铁胁迫下的早期阶段保护其侧根的形成[24]。
荷花(Nelunmbo nucifera)是中国十大传统名花中唯一的多年生水生花卉,兼具观赏、食用、药用和生态价值,在园林景观、家庭园艺、环境改善和生态治理等方面备受青睐[25]。但荷花在生长过程中会遭受各种胁迫,例如春季倒春寒、秋季低温、持续性水淹、水体污染等,这些非生物逆境直接影响其生长发育及观赏价值,制约荷花产业的发展[25-27]。目前,荷花Nn PIN基因家族成员尚未确定,其在荷花非生物胁迫中的潜在作用尚不清楚。该研究从荷花基因组鉴定了Nn PIN基因家族成员,并通过生物信息学方法分析了Nn PIN基因的理化性质、进化关系、基因结构、顺式作用元件等,同时还探究了该基因家族成员在脱落酸(ABA)、低温、水淹胁迫下的表达特性,旨在为深入研究荷花Nn PIN基因家族响应逆境胁迫提供理论基础,也为抗逆新品种的选育提供新的基因资源。
1 材料和方法
1.1 植物材料和处理
以西南林业大学国家荷花种质资源库保存的荷花品种‘太空莲36号’幼苗作为试验材料。挑选大小一致、健壮饱满的‘太空莲36号’莲子在破壳后浸泡于纯水中,每天换水1~2次,并于25~30℃的全光下浸泡约15 d直至第1枚钱叶(浮叶)完全展开,挑选生长良好、整齐一致的幼苗用于后续实验。激素处理:将‘太空莲36号’幼苗置于3 mmol/L的脱落酸(ABA)溶液中,水位约5 cm,使浮叶完全浮于水面;水淹处理:将‘太空莲36号’幼苗置于水淹水位约40 cm 的纯水中,将浮叶完全淹没;低温处理:将‘太空莲36号’幼苗置于4℃低温培养箱(光照/黑暗为16/8 h)中,水位约5 cm,使浮叶完全浮于水面。并用在25~30℃的全光照条件下正常水位(水位3~5 cm)、正常生长的幼苗作为对照(CK)。每个处理设3个重复,在处理6 h后分别取其叶柄(第1枚浮叶基部以下3~5 cm)用液氮冷冻,并置于-80℃保存。
1.2 方 法
1.2.1 荷花PIN基因鉴定
从荷花基因组中(http://nelumbo.biocloud.net/nelumbo/download/download)下 载genome、GFF、protein等文件,从TAIR 数据库(https://www.arabidopsis.org/)下载AtPIN 蛋白序列,并从水稻基因组注释数据库(https://rice.plantbiology.msu.edu/index.shtml)下载OsPIN 蛋白序列。以AtPIN(At-PIN1~8)和OsPIN(OsPIN1a~d、OstPIN2、OstPIN5a~c、OstPIN8、OstPIN9、OstPIN10a~b)作为种子序列,利用TBtools的双向Blast初步筛选荷花PIN 蛋白。从Pfam 数据库(http://pfam.xfam.org/)下载隐马尔可夫模型(HMM)配置文件Pfam 03547,将初步筛选出的荷花PIN 蛋白以PF03547模型(膜转运蛋白)进行验证,手动去除结构域不完整的序列,剩余的序列即为荷花PIN家族成员。
1.2.2 荷花PIN 蛋白的生物信息学分析
NnPIN蛋白的分子量、等电点(pI)、不稳定性指数、脂溶性指数和总平均疏水指数从ExPASy Prot-Param(https://web.expasy.org/protparam)程序获得,利用TMHMM 2.0(https://services.healthech.dtu.dk/services/TMHMM-2.0)预测跨膜结构域的数量。分别使用WoLF PSORT(https://wolfpsort.hgc.jp)、Cell-PLoc(http://www.csbio.sjtu.edu.cn/bioinf/Cell-PLoc-2/)、CELLO(http://cello.life.nctu.edu.tw/)和Loc Tree3(https://rostlab.org/services/loctree3/)进行亚细胞定位。利用DNAMAN软件完成荷花、拟南芥的PIN 蛋白序列多重比对,并用Clustalx和MEGA7.0 构建拟南芥、水稻和荷花的PIN蛋白系统发育树,进化树采用邻接法(neighborjoining,NJ)构建,自展值设为1 000,缺口设为“Complete deletion”。使用TBtools中Gene structure view和Gene Location功能获得荷花PIN基因家族结构图及染色体定位。利用MEME工具(https://memesuite.org/meme/tools/meme)分析蛋白质保守基序(motif),motif设置为12个,其余参数为默认条件,并通过TBtools进行可视化。使用TBtools中One Step MCScanX功能将NnPIN基因家族的基因复制可视化;并通过其Dual systeny Plot for MC scan X功能分别将荷花与拟南芥及水稻PIN基因家族的共线性可视化。NnPIN基因上游2 000 bp序列的顺式作用元件通过PlantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)获得,并使用TBtools进行绘制。
1.2.3 RNA提取和qRT-PCR分析
分别取低温(4℃)、水淹和3 mmol/L 的脱落酸(ABA)溶液处理6 h后的‘太空莲36号’叶柄约200 mg,使用艾德莱生物公司的ESAYspain 植物RNA 快速提取试剂盒(货号:RN09)按照其说明提取总RNA。将1μg 纯化后的总RNA 用All-In-One 5×RT Master Mix 逆转录成第一链cDNA,cDNA 置于-20℃保存。q RT-PCR 分析引物在NCBI引物预测网站上设计,使用Nn ACT(基因登录号:XM_010267616.1)作为内参基因。Nn PIN和Nn ACT引物由上海生工生物技术服务有限公司合成(表1)。

表1 实时荧光定量引物序列Table 1 Primers used in qRT-PCR
qRT-PCR 通过Reche Light Cycler 480实时荧光定量PCR 系统和Blas TaqTM2X qPCR Masteer-Mix 试剂盒进行测定。反应体系及程序参照Blas TaqTM2X qPCR Masteer Mix试剂盒操作说明书,qRT-PCR分析至少重复3次,该家族在不同处理下的相对基因表达值用方法计算。
2 结果与分析
2.1 荷花PIN 基因家族的筛选及蛋白理化性质分析
用来自拟南芥和水稻的PIN 蛋白质序列作为BLAST 查询搜索荷花基因组数据库,并以隐马尔可夫模型文件(Pfam 03547)用于识别NnPIN 蛋白,共鉴定出12个Nn PIN基因,根据它们在荷花染色体上的位置对Nn PIN进行命名(表2)。对鉴定到的12个荷花NnPIN 蛋白家族成员进行理化性质分析发现,12个NnPIN 蛋白家族基因编码357~644个氨基酸,NnPIN 蛋白分子量为38.96~69.52 k D,等电点介于8.02~9.40间,为碱性氨基酸。12个NnPIN 蛋白的不稳定指数在25.45~43.36 之间,其中3 个成员(NnPIN2、Nn PIN11、NnPIN12)为不稳定蛋白,其余9个为稳定蛋白。

表2 荷花NnPIN 基因家族信息及编码蛋白理化性质Table 2 Physical and chemical properties of proteins encoded by the Nn PIN gene family in N.nucifera
Nn PIN 蛋白的总平均疏水指数均为正值,表明为疏水蛋白。跨膜结构及亚细胞定位预测结果显示,NnPIN 蛋白具有8~9个跨膜结构域,并主要定位于质膜和内质网,其中,NnPIN2、NnPIN3 和NnPIN7定位在内质网,其余9个NnPIN 均定位在细胞质膜。
2.2 荷花PIN 基因家族的染色体定位
为明确Nn PIN基因在染色体上的位置,使用TBtools对其进行染色体定位(图1)分析,发现Nn PIN基因不均匀分布在6条荷花染色体上,而在5号和6号染色体上则无Nn PIN基因分布。
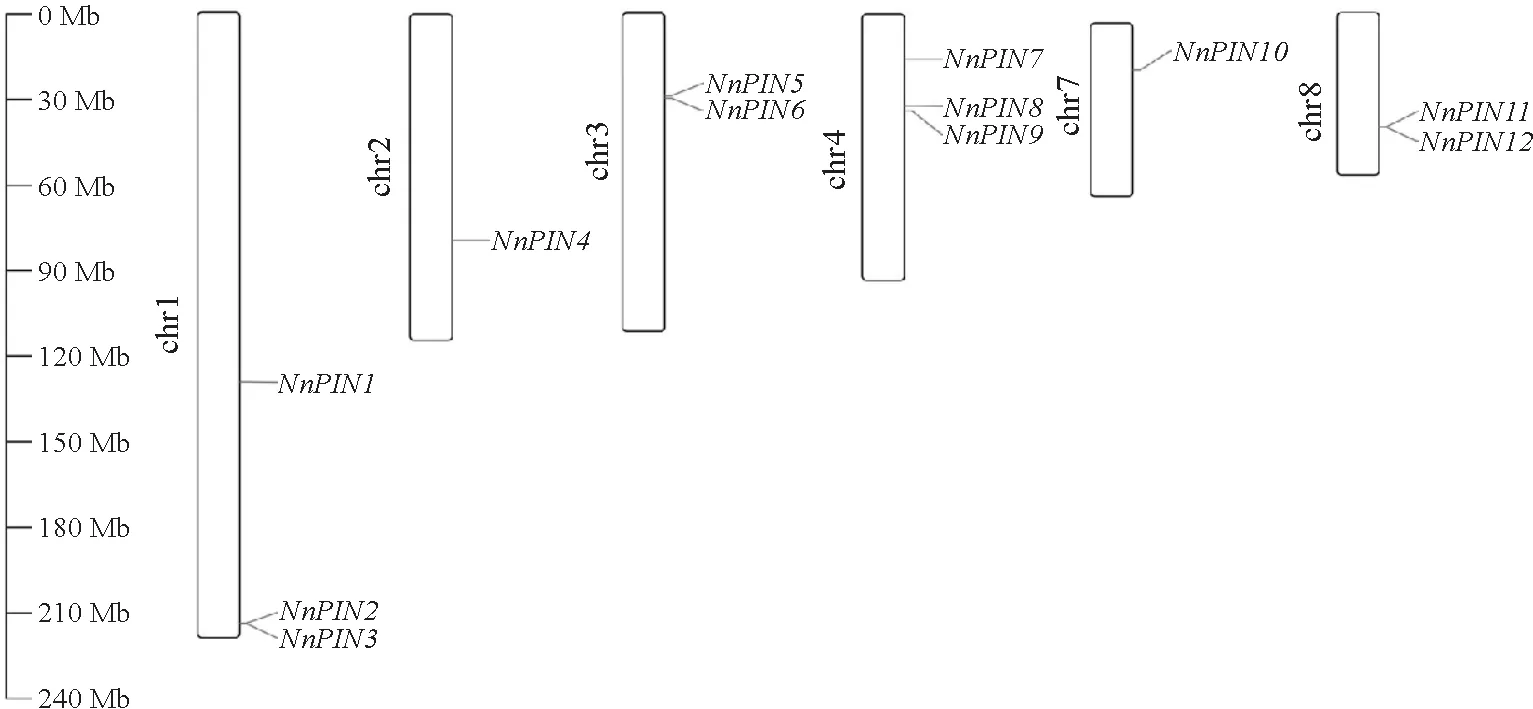
chr.染色体;Nn PIN.荷花PIN 基因。图1 荷花NnPIN 家族基因的染色体定位chr,chromosome.Nn PIN,PIN gene in Nelunmbo nucifera.Fig.1 Chromosomal mapping of the Nn PIN gene family in N.nucifera
其中Nn PIN1~3分布在1 号染色体上,Nn PIN7~9分布在4 号染色体上,Nn PIN4和Nn PIN5分布在3 号染色体上,Nn PIN11和Nn PIN12分布在12 号染色体上,而Nn PIN4和Nn PIN10分别定位于2 号和7 号染色体上,未发现明显的可识别的基因簇。
2.3 荷花PIN 家族的多序列比对及系统发育分析
为进一步了解NnPIN 的序列特征,对荷花和拟南芥2个物种进行PIN 蛋白序列多重比对(图2)。结果显示PIN 蛋白的N 端和C 端区域在荷花和拟南芥中高度保守,NnPIN2、NnPIN3、NnPIN7 与AtPIN5、AtPIN8有短中央亲水环,其他NnPIN 和AtPIN 则具长中央亲水环。

At.拟南芥;Nn.荷花。图2 荷花NnPIN 和拟南芥AtPIN 蛋白的氨基酸多序列比对At,Arabidopsis thaliana.Nn,Nelunmbo nucifera.Fig.2 Multiple sequence alignment of amino acids of NnPIN and AtPIN proteins
此外,还在C 端发现1 个保守的“NPNTY”结构基序。为了更好地了解荷花与其他代表性物种PIN 基因家族之间的进化关系,利用拟南芥、水稻共32 个PIN 蛋白序列构建了系统发育树(图3)。

At.拟南芥;Os.水稻;Nn.荷花。进化树分支中的数值为Bootstrap值,用来检验计算的进化树分支可信度。图3 荷花、拟南芥和水稻PIN 蛋白系统发育树At,Arabidopsis thaliana.Os,Oryza sativa.Nn,Nelunmbo nucifera.The numerical value in the evolutionary tree branch is the Bootstrap value,which is used to verify the credibility of the evolutionary tree branch.Fig.3 Phylogenetic tree of the PIN proteins in N.nucifera,A.thaliana and O.sativa
结果表明,PIN 蛋白家族可分为经典型和非经典型2种类型,荷花NnPIN 蛋白在2种类型中均有分布。在经典型中NnPIN 成员分布最多,有9 个NnPIN 成员(NnPIN6、NnPIN9、NnPIN4、NnPIN10、NnPIN5、NnPIN8、NnPIN11、NnPIN12、NnPIN1),而在非经典型中有则3 个Nn PIN 成员(NnPIN7、NnPIN2、NnPIN3)。
2.4 荷花PIN 家族的保守基序及基因结构分析
为进一步探索荷花NnPIN 蛋白中的保守结构,使用MEME 基序搜索工具进行了保守基序的识别。如图4所示,在NnPIN 蛋白家族中鉴定出12个保守基序,N 端的保守结构域由motif 1、motif 3、motif 10、motif 11组成,而motif 2、motif 4、motif 5、motif 7则组成了C 端的保守结构域,且这8 个motif 在12个荷花NnPINs中均有分布。其中,中央亲水环由motif 6、motif 8、motif 9、motif 12 构成,且这4个motif在NnPIN 的2种类型中具显著差异:在经典型中,除NnPIN1外,均具有motif 6、motif 8、motif 9、motif 12;而在非经典型中,除NnPIN2外,均无这4个motif,预示着不同类型的NnPIN 蛋白在植物生长发育中具有不同的功能。

图4 荷花NnPIN家族的保守基序和基因结构Fig.4 Conserved motifs and genetic structures of the NnPIN family in N.nucifera
基因结构分析(图4)表明,12个Nn PIN基因包含5~7个外显子,并在各个小分支内具有相似的外显子数量和基因长度,而在两大类型中则存在显著分化。其中经典型Nn PIN(除Nn PIN1和Nn PIN5外)中均具有6 个外显子,而非经典型Nn PIN中各成员的外显子数目和基因长度都具有显著差异,从而预测两大类型的Nn PIN基因之间以及非经典型Nn PIN基因内部可能存在功能上的分化。
2.5 荷花PIN 基因家族的组内与种间共线性分析
为了明确荷花Nn PIN基因的进化关系,对其进行了基因组内及其与拟南芥、水稻基因组间的共线性分析。荷花基因组内共线性分析(图5)表明,Nn PIN基因家族在chr3及chr4上共鉴定出2个共线性基因对(Nn PIN6/Nn PIN9和Nn PIN5/Nn PIN8),且这2个基因对在进化关系上共属同一分支,预示着荷花Nn PIN基因可能存在基因复制事件。

chr.染色体;Nn PIN.荷花PIN 基因。红线表示Nn PIN 基因的组内及种间共线性基因对。图5 Nn PIN 家族的基因复制(A)和种间共线性分析(B)chr,chromosome.NnPIN,PIN gene in N.nucifera.The red line represents the genomic and interspecific collinearity gene pairs of NnPIN.Fig.5 Gene duplication(A)and interspecies collinearity analysis(B)of the Nn PIN family in N.nucifera
种间共线性分析发现,荷花同拟南芥具有8个共线性基因对,Nn PIN1、Nn PIN6、Nn PIN7、Nn PIN8、Nn PIN9分别同At PIN6、At PIN1、At-PIN8、At PIN4、At PIN2具有共线性关系,而Nn PIN5又分别与At PIN3、At PIN4、At PIN7具有同源性;但并未发现荷花同水稻OsPIN存在共线关系,这也进一步表明Nn PIN和At PIN的亲缘关系更为密切,在基因功能上可能与双子叶植物更相似。
2.6 荷花PIN 基因家族启动子元件分析
为了更好地预测Nn PIN的生物学功能,使用PlantCare对起始密码子(ATG)上游2 000 bp的部分进行顺式作用元件检测。结果(图6)表明,NnPIN基因主要包含光、激素、非生物胁迫和生长发育相关响应元件。其中,激素反应元件包括脱落酸(ABA)、茉莉酸甲酯(MeJA)、水杨酸(SA)和生长素相关元件,非生物胁迫元件主要包括缺氧调节、低温、防御和应激反应及干旱等元件。每个NnPIN基因的顺式作用元件数量从12个(NnPIN2)~31个(NnPIN4)不等。其中在激素响应和非生物胁迫元件中,ABA 和缺氧响应元件最多,且12个Nn PIN基因的启动子均具有脱落酸和缺氧响应元件;并且多数NnPIN成员中都具有低温、防御及胁迫和生长素等相关响应元件,预示着NnPIN基因可能介导着荷花对缺氧和低温等多种非生物逆境的抗性。

图6 荷花Nn PIN 基因家族的顺式作用元件分析Fig.6 Analysis of cis-acting elements of the NnPIN genes in N.nucifera
2.7 荷花PIN 基因在多种非生物胁迫下的表达模式
2.7.1NnPIN基因正向响应低温胁迫
为了探究NnPIN基因是否会响应低温,对荷花幼苗进行了低温(4℃)处理,并分析了其表达模式(图7)。与对照(CK)相比,在低温处理6 h 后,Nn PIN1~12基因(除NnPIN8外)的表达量均显著上升,其中NnPIN11对低温响应最为显著,提高了近9倍;而NnPIN1、NnPIN2、NnPIN3、NnPIN5、Nn PIN6、Nn PIN7和Nn PIN10基因的表达量也显著提高了5倍以上,说明NnPIN基因可正向响应低温胁迫,推测其在抗寒机制中具有正向调控作用。
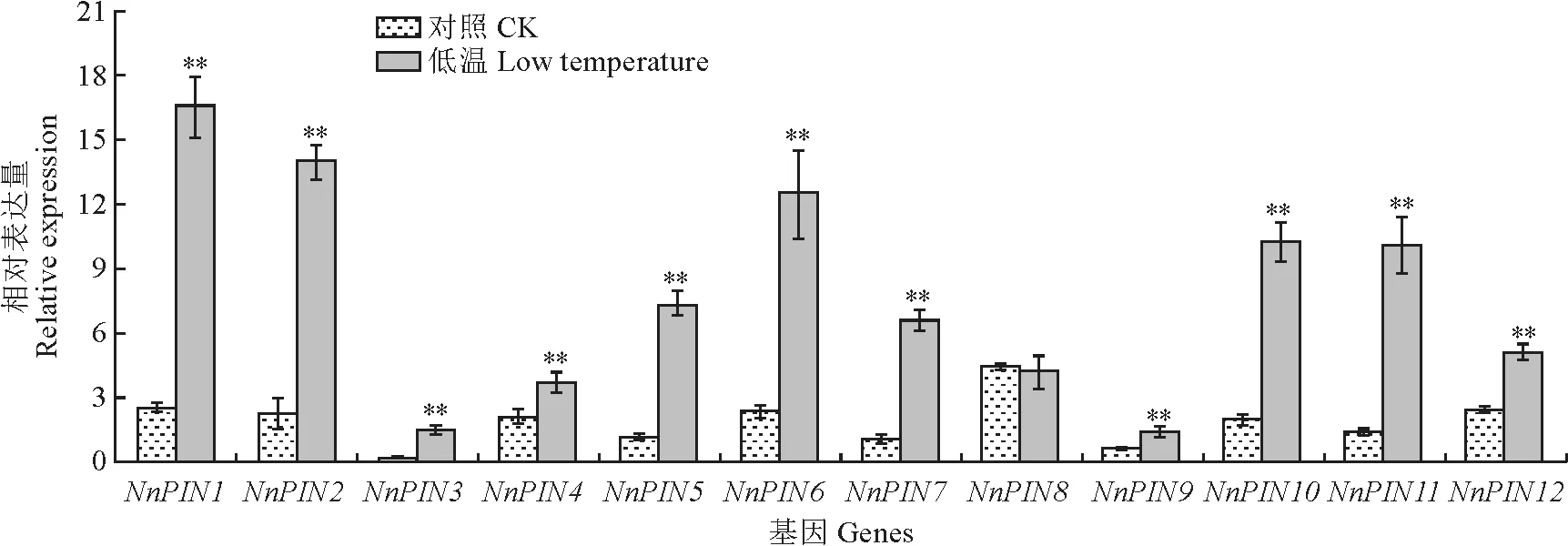
**表示基因的表达量在处理与对照间存在显著差异(P<0.01)。下同。图7 荷花NnPIN 基因在低温(4℃)处理6 h后的表达模式**indicates significant difference in gene expression between treatment and control(P<0.01).The same as below.Fig.7 Expression patterns of the Nn PIN genes under low temperature(4℃)for 6 hours
2.7.2NnPIN基因特异性响应水淹胁迫
为了探究Nn PIN基因如何响应厌氧胁迫,对荷花幼苗进行了水淹处理,并通过qRT-PCR 分析Nn PIN基因在该处理6 h后的表达量模式。结果(图8)表明,不同Nn PIN基因在水淹处理下具有不同的表达模式,其中Nn PIN6和NnPIN7的基因表达量显著上调,而NnPIN1、NnPIN2、NnPIN3、NnPIN4、NnPIN5、NnPIN8、NnPIN9和NnPIN12基因表达量则显著下调,Nn PIN10和Nn PIN11基因表达量则没有发生显著变化,推测Nn PIN基因在响应厌氧胁迫中出现了功能分化。

图8 荷花Nn PIN 基因在水淹胁迫处理6 h后的表达模式Fig.8 Expression patterns of the Nn PIN genes under flooding stress for 6 hours
2.7.3NnPIN基因正向响应外源ABA 处理
对荷花幼苗进行了外源3 mmol/L ABA 处理,并检测了Nn PIN基因家族各成员在该处理6 h后的表达模式。
结果(图9)表明,在经外源ABA 处理6 h后,Nn PIN基因与低温处理有类似的表达模式,即与对照相比,NnPIN基因(NnPIN8除外)的表达量均呈显著上升趋势,其中NnPIN1、NnPIN2、NnPIN3、NnPIN4、NnPIN7、NnPIN10、NnPIN11、NnPIN12基因表达量都显著提高30 倍以上,而Nn PIN5、Nn PIN6、Nn PIN9基因表达量也都显著提高近20倍,推测Nn PIN基因正向响应ABA 胁迫。
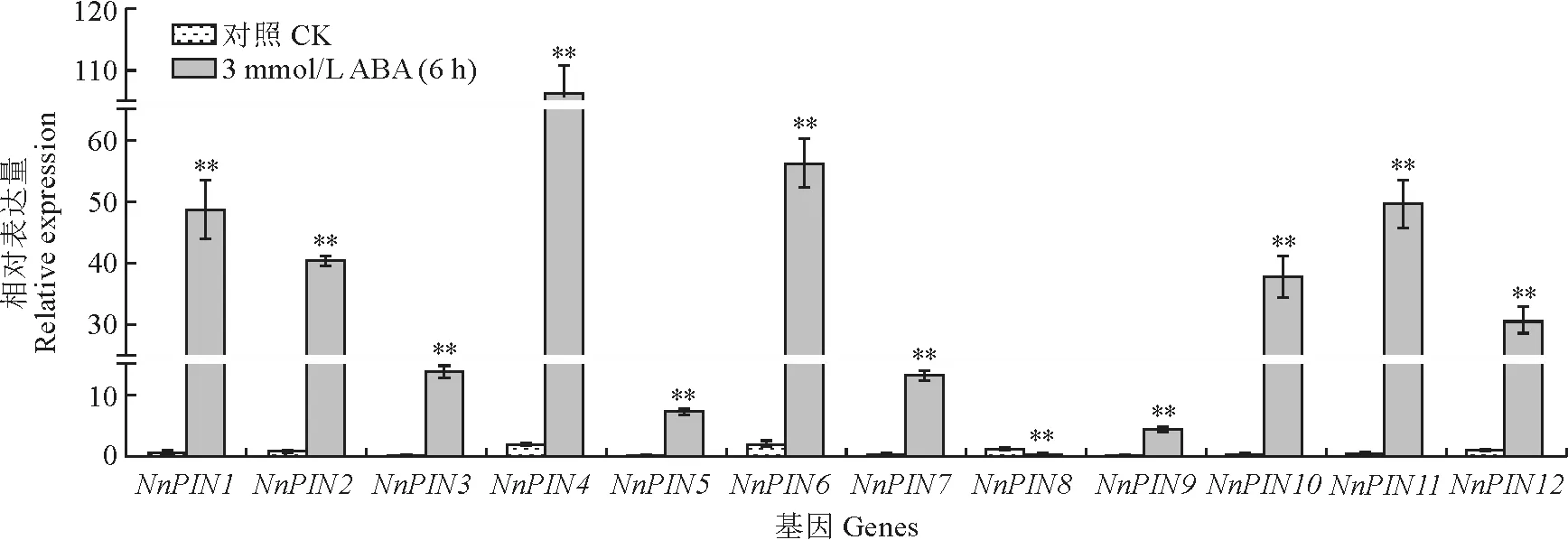
图9 荷花Nn PIN 基因在外源3 mmol/L ABA处理6 h后的表达模式Fig.9 Expression patterns of the NnPIN genes under exogenous 3 mmol/L ABA treatment for 6 hours
3 讨论
研究从荷花基因组中鉴定出12个Nn PIN基因,与拟南芥[27-28](8 个)、水稻[29](12 个)、玉米[30](14个)及番茄[31](10个)等多种植物大体相当。理化性质分析表明:NnPIN 蛋白均为碱性氨基酸,有8~9个跨膜结构域,而且各成员均含有保守结构域Men_Trans(PF03547),与小麦[20]、棉花[32]、葡萄[33]中PIN蛋白的研究结果一致。有研究表明“NPNTY”结构基序与PIN 蛋白的转运有关,其对于胞吞过程中膜蛋白和受体蛋白之间的相互作用非常重要[33],多序列比对结果发现所有NnPIN 在C 端都包含“NPNTY”基序,这表明其在荷花中也可能发挥相类似的功能。通过进化树分析,可将这12个NnPIN蛋白分为经典型和非经典型,多数NnPIN 与At-PIN 聚在一起,预示着NnPIN 与AtPIN 的亲缘关系更为密切,也表明了荷花这一古老的双子叶植物保留了更多双子叶植物属性。Gou等[33]发现葡萄中Vv PIN基因与拟南芥有7对同源基因,与水稻却只有1对,本研究也发现荷花同拟南芥具有8对同源基因,但并未在水稻中发现NnPIN的同源基因,进一步预示Nn PIN在双子叶植物的进化过程中更为保守。
PIN 家族蛋白可根据中央亲水环的长短分为经典型和非经典型,在拟南芥中,经典型PIN 蛋白(AtPIN1、2、3、4和7)定位于质膜(plasma membrane,PM);非经典型PIN 蛋白(At PIN5和8)则位于内质网(endoplasmic reticulum,ER)[6-7]。本研究也发现,经典型Nn PIN 蛋白具长中央亲水环(motif 6、motif 8、motif 9和motif 12),定位于细胞质膜;而非经典型NnPIN 蛋白则具短亲水环,定位在内质网,表明2种类型的NnPIN 存在结构和功能上的分化。此外,本研究预测NnPIN6和NnPIN7蛋白可能定位于质膜和内质网上。多序列比对及进化树分析发现荷花NnPIN6与拟南芥At PIN1蛋白的相似度最高,基因结构分析发现荷花NnPIN6具有经典型PIN 特征,且亚细胞定位预测工具 Wo LF PSORT、Cell-PLoc和CELLO 都预测到其定位于质膜上,故推测NnPIN6也可能定位在质膜上。而荷花NnPIN7与拟南芥AtPIN8的相似度最高且其也符合非经典型PIN 特征,但Wo LF PSORT 显示其可能定位于质膜或内质网上,Loc Tree3、CELLO、Cell-PLoc分别显示其可能定位于内质网膜、质膜和细胞质上,所以结合非经典型PIN 特征及其与拟南芥AtPIN8进化关系,推测NnPIN7定位于内质网上的可能性更大,但也不排除有定位于质膜等其他部位的可能。
分析基因启动子序列的顺式作用元件,对于深入挖掘基因潜在功能具有重要意义。目前在不同植物中已经鉴定出多种顺式作用元件,它们调控基因转录水平,影响植物的生长发育、胁迫抗性等[34]。本研究通过对荷花Nn PIN基因启动子区顺式元件预测,发现激素响应元件和非生物胁迫响应元件占有重要比重,且12个Nn PIN基因的启动子均具有脱落酸响应和缺氧诱导元件,qRT-PCR 发现Nn PIN基因确实可对脱落酸(除Nn PIN8外)和水淹胁迫(除Nn PIN10和Nn PIN11外)做出响应,表明启动子顺式作用元件预测结果基本可靠。尤其是Nn PIN6和Nn PIN7基因的启动子还包含大量非生物胁迫及分生组织表达等元件,推测水淹胁迫中植物的抗逆和生长会发生相应的变化,因此需要更多相关的作用元件,这也预示着Nn PIN6和Nn PIN7基因在响应水淹胁迫中有更重要的作用,其作用机理值得进一步研究。
荷花作为多年生挺水植物,其在生长发育过程中主要面临低温、水淹等诸多逆境,而环境胁迫会促使生长素转运蛋白基因做出响应以改变生长素的分布和稳态[35]。在高粱[19]、玉米[36]和大豆[37]中的绝大多数PIN基因成员对非生物胁迫处理有反应。一些研究表明PIN 蛋白与冷应激之间存在关系,冷应激会影响生长素转运载体对生长素的转运[38]。王灏等发现在低温(0℃)会诱导Dc PIN1a表达上调,会抑制Dc PIN9a和Dc PIN9d的表达[39];而Gou等却发现在4℃低温处理下,葡萄根部Vv PIN1、Vv PIN2、Vv PIN3、Vv PIN4、Vv PIN6、Vv PIN8、Vv PIN10、Vv PIN11和Vv PIN12基 因显著上调[33]。在本研究中也得到了与Gou 等相似的结果,几乎所有Nn PIN基因(除Nn PIN8外)的表达水平在4℃低温处理下均显著提高(图7),表明Nn PIN基因可以响应低温,预示Nn PIN基因在增强荷花的冷胁迫耐受性方面发挥着重要作用。水位自始自终都是影响荷花生长发育过程的重要因素,其在莲子萌发、浮叶开展、立叶及花蕾出水等都扮演着重要的角色,而过高水位产生的厌氧环境会严重制约着荷花生长发育。本研究发现,水淹处理后荷花幼苗叶柄在短时间内会迅速伸长,而Nn PIN6和Nn PIN7基因的表达量则显著上调,其余多数Nn PIN基因表达量则显著下降,推测在水淹胁迫下Nn PIN6和Nn PIN7基因可能对于调控荷花的生长发育具有重要作用,然而是何种原因导致Nn PIN基因家族成员在水淹胁迫中呈现功能分化以及Nn PIN基因如何调控水淹胁迫值得进一步研究和探讨。
植物激素参与不同信号通路之间的广泛串扰,而PIN基因可对多种生理生化过程及激素信号做出反应[40]。ABA 是调节植物对各种非生物和生物胁迫反应的重要植物激素,在介导植物防御反应方面发挥着重要作用。Gou等研究发现ABA 可诱导葡萄多数Vv PINs的上调表达[33],Zhang等也发现辣椒根中的Ca PIN3、Ca PIN5、Ca PIN8、Ca PIN9、Ca PIN10基因正向响应ABA[41]。本研究结果表明,除Nn PIN8外,Nn PIN1~12基因均受ABA 的正向显著诱导,此结果与Gou等和Zhang等的研究[33,41]基本一致。越来越多的证据表明ABA 参与了冷应激信号的调控,在CBF 依赖途径中发挥新作用[42]。值得注意的是,本研究发现Nn PIN基因在外源ABA 和4℃低温处理下的表达图谱基本一致,预示着荷花Nn PIN基因对低温和ABA 的响应存在协同作用,推测其可能在介导ABA 在荷花抗低温方面发挥着调控作用,外源施加ABA 可能具有提高荷花抗寒性的潜力。
4 结论
研究通过生物信息学方法在荷花中共鉴定出12个Nn PIN成员,分为经典型和非经典型,主要定位于质膜和内质网。顺式作用元件分析及逆境处理表达图谱显示Nn PIN基因特异性响应水淹、外源ABA 和低温等胁迫,特别是Nn PIN6和Nn PIN7基因正调控水淹胁迫下荷花的生长发育,但具体调控机制还有待进一步研究。
