红蓝光促进陆地棉愈伤组织诱导和增殖
2024-03-08李凯利魏云晓种智力孟志刚王远梁成真陈全家张锐
李凯利,魏云晓,种智力,孟志刚,王远,梁成真,陈全家,张锐
红蓝光促进陆地棉愈伤组织诱导和增殖

1新疆农业大学农学院/棉花教育部工程研究中心/农业生物技术重点实验室,乌鲁木齐 830052;2中国农业科学院生物技术研究所,北京 100081
【目的】陆地棉()的遗传转化技术存在转化周期长、转化效率低等问题,其中,愈伤组织增殖速度慢是导致棉花转化周期长的关键因素。探究陆地棉愈伤组织增殖的最适光照条件,为缩短棉花转化周期提供技术基础。【方法】以陆地棉受体品种WC的下胚轴为外植体诱导愈伤组织,设置红光、蓝光、红蓝光(1﹕1)和白光(CK)4种不同光照处理,研究不同光质下愈伤组织的增殖速度、形态特征,以及相关基因表达水平和相关酶活性的差异,解析光照对愈伤组织增殖的影响并获得最优光照条件。【结果】不同光质对诱导棉花外植体出愈和愈伤组织生长具有明显影响。在4种不同光照处理下,红蓝光相较其他光质具有更显著地促进外植体出愈和愈伤组织增殖的效果,表现为愈伤组织分化时间更短,7—15 d,即与其他处理存在明显表型差异,7 d愈伤组织鲜重红蓝光(0.39 g)>蓝光(0.34 g)>白光(0.24 g)>红光(0.23 g),15 d时,红蓝光(1.15 g)>蓝光(0.98 g)>白光(0.69 g)>红光(0.51 g),红蓝光照射下的愈伤组织鲜重是白光对照的1.65倍,比单一蓝光或红光照射下的愈伤组织鲜重增加16.5%或125.5%;与此相一致的是,红蓝光处理下,第二周的愈伤增殖率也最高,达14.67%,比红光处理(7.17%)增加1倍多。4种光质下,愈伤增殖及体胚再生相关基因的表达量,红蓝光处理均显示最高。此外,红蓝光处理下愈伤组织的过氧化氢酶(CAT)活性显著提高,活性氧(ROS)含量低于白光对照。【结论】不同光质条件下,棉花外植体的愈伤组织增殖速度不同,红蓝光(1﹕1)促进外植体出愈和愈伤增殖表现最优,其次为蓝光,再次为白光,单独的红光不利于棉花出愈和愈伤增殖。红蓝光(1﹕1)处理诱导光受体及其互作因子、愈伤增殖等相关基因的表达,增强愈伤组织内过氧化氢酶的活性,降低活性氧含量,促进细胞分裂,进而促进愈伤增殖。
陆地棉;红光;蓝光;愈伤组织增殖速度;活性氧
0 引言
【研究意义】棉花(L.)既为纺织工业提供原料,又是重要的油料作物[1]。中国是世界上最大的原棉生产国和消费国,因此,棉花在我国的经济发展中占有重要的地位[2]。转化周期长是棉花遗传转化的一大技术难点,严重阻碍了棉花基因功能验证和优异转基因材料创制,通过利用分子生物学技术,解析棉花经济性状形成的机理,以促进棉花产业可持续发展,都离不开棉花的遗传转化[3]。棉花的遗传转化依赖体细胞胚再生过程,农杆菌侵染后的外植体要获得转化植株,通常要经历愈伤诱导、胚性愈伤诱导、体胚发育和植株再生4个相对独立又相互关联的阶段。作为起始阶段的愈伤诱导是后续阶段顺利进行的基础,因此,研究愈伤组织的快速诱导及增殖,可以促进高效棉花遗传转化体系的建立。【前人研究进展】在植物组织培养中,光照对诱导愈伤组织有重要影响。植物吸收红光和蓝光的能力比吸收其他光的能力强。红光影响茎的伸长、根冠比、叶绿素含量和光合效率[4-5],蓝光影响植物的向光性、下胚轴伸长、叶片增大、气孔开放、叶绿体运动等[6-7]。蓝光和红光在植物的生长发育中发挥着不同的功能,单独使用红光或蓝光都不能完全满足植物健康生长发育的要求[8]。与单色光相比,红光和蓝光混合,能提高植物的光合速率,促进植物的健康发育[9-10]。植物通过光受体感知并传递光信号。光敏色素A(phytochrome A,PHYA)和光敏色素B(phytochrome B,PHYB)是植物中最早发现的2种光敏色素,其中,PHYA为远红光的主要受体,介导远红光反应,而PHYB是红光的主要受体,介导红光反应[11]。它们能够感知波长为600—750 nm的光,参与植物光形态建成、生长发育调控等多个过程[12]。隐花色素(cryptochromes,CRYs)的发现相对较晚,是一类广泛存在于动植物中的蓝光受体,能够感受蓝光和近紫外光(330—500 nm)。AtCRY1和AtCRY2是拟南芥的蓝光感受器[13-15]。AtCRY1主要负责在蓝光下抑制下胚轴伸长,而AtCRY2主要控制光周期开花[16]。光敏色素互作因子(phytochrome-interacting factors,PIFs)是一类与光受体互作、具有碱性螺旋-环-螺旋(basic helix–loop–helix,bHLH)结构的转录因子,它们传递光受体感知到的光信号,通过调控有关下游基因的表达,参与植物的生长发育,并且在植物抵御逆境胁迫的过程中也发挥着重要作用[17]。目前,已陆续从水稻、玉米、番茄等多种植物中鉴定出PIF1—PIF7类转录因子,以及各成员间的共同结构域和特殊结构域[18-23]。多子叶转录因子(leafy cotyledon,LEC)包含LEC1和LEC2 2个成员,参与植物的生长发育及储藏物质的积累[24]。其中,LEC2是含有B3结构域的胚胎发育相关调控因子,与LEC1存在协同作用,是一类胚胎发育相关的标志基因[25-26]。当植物的体细胞在光和激素等的诱导下产生愈伤组织时,体细胞胚胎发育路径相关的转录因子,包括LEC1、LEC2等转录因子的表达量会提高,促进体细胞胚胎的发生[27]。GhTCE1是一种螺旋-环-螺旋家族转录因子,Deng等[28]研究表明其作用于棉花愈伤组织去分化过程中早期细胞命运转变,RNAi或CRISPR/Cas9介导的功能丧失导致活性氧(reactive oxygen species,ROS)过度积累,阻止愈伤组织细胞伸长,并增加不定器官的发生。Yuan等[29]重点研究了体外去分化过程中愈伤组织形成早期的细胞命运转变,并在棉花胚胎发生过程的RNA-seq图谱分析中鉴定出,推测它可能在愈伤组织形成或胚胎发生过程的早期事件中发挥作用。自由基诱导的细胞死亡1(radical-induced cell death1,RCD1)转录因子作为ROS信号通路的关键调节因子,在调节植物的环境应激、激素和发育反应中发挥着至关重要的作用[30-32]。通过调节线粒体呼吸和叶绿体ROS的产生,RCD1确保了植物在变化的环境条件下的生存[33-34]。MYB转录因子是一种普遍存在于植物和动物中的转录因子,广泛参与胁迫响应、次生代谢调控和激素应答等过程[35]。此外,Wang等[36]研究发现拟南芥MYB118转录因子还可诱导根外植体形成体细胞胚胎,并加快营养体向胚状体的过渡。Yuan等[29]研究发现、等在愈伤组织诱导、增殖和胚性细胞产生过程中出现时序性表达,调节体胚发生过程中ROS的动态积累,表明GhRCD1-GhMYC3- GhMYB44-GhLBD18等组成的转录级联模块可时序性调节细胞内ROS的积累,继而影响体胚发生过程中细胞的命运。【本研究切入点】如何缩短遗传转化周期、提高转化效率是棉花遗传转化面临的一个主要问题,目前的研究基本集中在优化胚性愈伤组织诱导和分化的中后期阶段,而就不同光质对起始阶段愈伤诱导和增殖影响的研究较少。【拟解决的关键问题】本研究以陆地棉受体品系WC为试验材料,以其7 d无菌苗下胚轴为外植体进行愈伤组织诱导和增殖培养,设计4种不同光质处理,研究不同光质下愈伤组织诱导及增殖的速度,并分析不同光质对出愈和愈伤增殖快慢造成差异的内在原因,为缩短棉花的遗传转化周期提供参考。
1 材料与方法
1.1 植物材料
组织培养的试验材料为陆地棉品系WC,种子由中国农业科学院生物技术研究所保存。以7 d无菌苗下胚轴为试验外植体。为统计愈伤时增殖情况,利用愈伤增值率(callus growth rate,CPR)这个参数来衡量愈伤,CPR=(W2-W1)/W1,其中,W1为外植体培养前的初始重量;W2为外植体培养一段时间后的重量。
1.2 棉花组织培养
1.2.1 外植体准备 种子准备:选取WC种子,用75%乙醇和30%过氧化氢溶液消毒置于种苗培养基上,28 ℃暗培养6 d,光照处理1 d,获得无菌苗。茎段准备:将培养7 d的无菌苗切成长度为5—8 mm的茎段用于诱导愈伤生成和增殖。诱导培养基(callus induction medium,CIM)的准备:MS培养基添加激素2,4-D和KT、30 g葡萄糖,pH=5.85,灭菌使用。
1.2.2 光照诱导愈伤组织及愈伤组织学观察
将茎段平均分为4组,分别置于红光、红蓝光(1﹕1)、蓝光、白光(CK)4种不同光质条件下培养。红蓝光强度参照魏喜等[37],红蓝光的波峰值分别为660和460 nm。白光(CK)光质处理的光强设置为30—50 μmol·m-2·s-1。在第7和15天时拍照、称重并取样。
选取第25天的愈伤组织,使用FAA固定液固定,经过脱水、透明、浸蜡和包埋、切片和烤片、脱蜡复水和染色之后,使用显微镜观察愈伤组织的横切面。
1.3 不同时期光受体及愈伤增殖基因的表达量检测
分别取不同光照下第7和15天的棉花愈伤组织,利用RT-qPCR的方法检测WC棉花愈伤组织样品中()、()、()、()、()、()、()、()、()、()、()、()、()和()在特定组织中的表达量。CDS序列来自于https://cottonfgd.net/。
1.4 体外抗氧化活性的测定
分别称取不同光照处理7和15 d的愈伤组织0.25 g,依据CAT和ROS检测试剂盒测定样品CAT活性和ROS含量。
1.5 数据处理
采用Graph pad Prism9.5.1和DPS数据处理系统及AI软件对不同光照棉花愈伤组织结果进行统计分析并绘图,3次生物学重复。
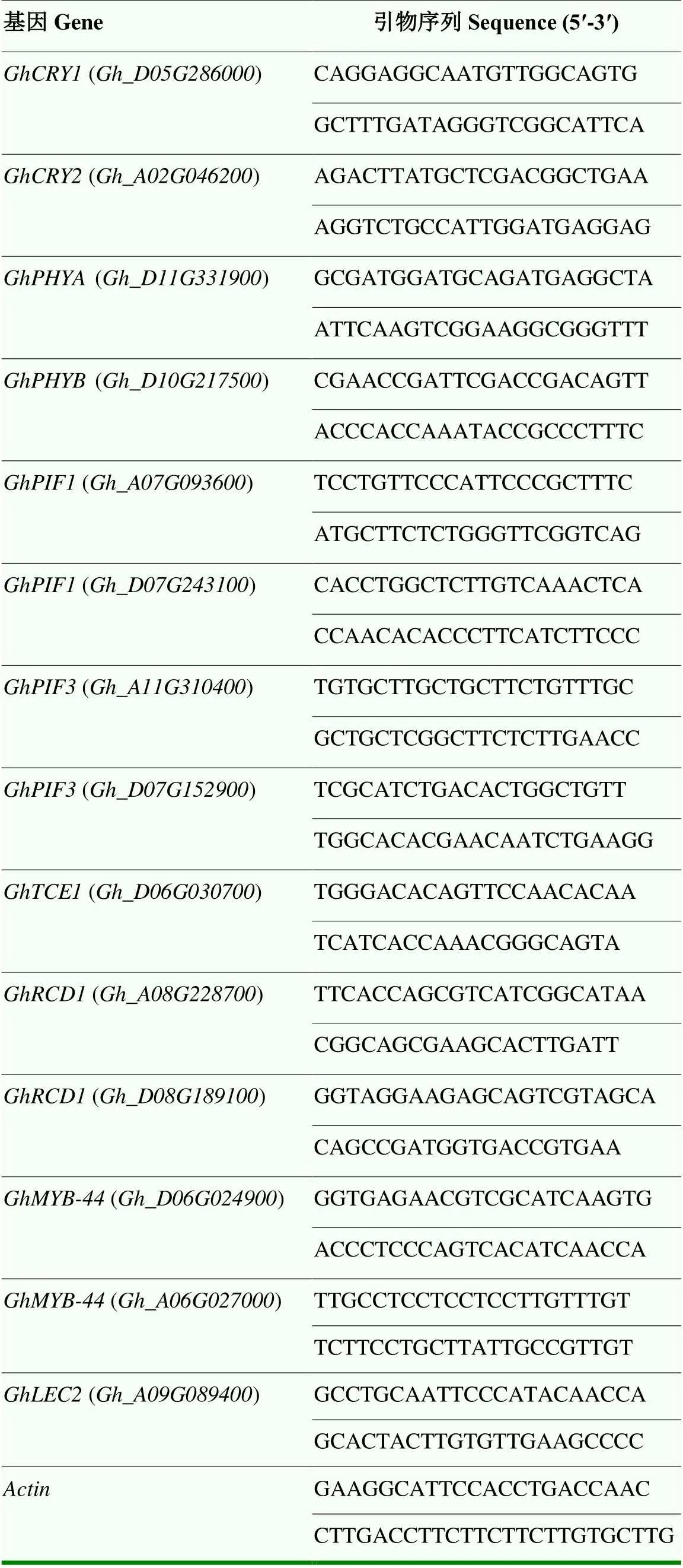
表1 用于rt-qPCR的引物序列
2 结果
2.1 不同光照处理对棉花愈伤组织诱导增殖的影响
利用红光、蓝光、红蓝光和白光4种不同光照对棉花品系WC的下胚轴进行愈伤诱导,在红蓝光处理条件下,棉花下胚轴最早出现愈伤分化,且愈伤增长快,颜色更绿;蓝光处理条件下,下胚轴边缘出现较少的愈伤组织,愈伤增长次于红蓝光;红光和白光处理条件下,棉花愈伤组织生长较慢,愈伤组织较少(图1-A)。通过检测愈伤组织鲜重,发现红蓝光处理的愈伤组织鲜重最高,红光处理的最低。7 d愈伤组织鲜重分别为0.39(红蓝光)、0.34(蓝光)、0.24(白光)和0.23 g(红光),15 d愈伤组织鲜重分别为1.15(红蓝光)、0.98(蓝光)、0.69(白光)和0.51 g(红光,图1-B)。从形态和鲜重均可以看出,在红光与白光处理7 d时,棉花外植体诱导愈伤表现无明显差异,但在15 d时,红光处理条件下的愈伤组织较少,鲜重低于白光处理,表明单独的红光不利于愈伤组织的诱导和增殖。
愈伤增值率(CPR)可比较直观地反映愈伤组织的增殖速度。计算4种光质处理下的愈伤增殖率(图1-C),发现红蓝光诱导下的愈伤增殖率最高,其次是蓝光、白光和红光。在红蓝光、蓝光、红光和白光处理条件下,7 d的愈伤增殖率分别为1.15%、0.91%、0.31%和0.36%,15 d的愈伤增殖率分别是5.39%、4.56%、1.09%和2.97%。说明4种光质处理条件下愈伤组织的增殖速度不同,红蓝光最有利于棉花愈伤组织的增殖生长,而单一的红光最不利于其生长。
进一步对25 d的愈伤茎段进行细胞学观察(图1-D),发现在4种光质处理条件下,愈伤组织的结构存在一定的差异,表现在内外层细胞的数量、层数和大小等方面。红蓝光处理条件下的愈伤组织细胞数量和层数均最多,且大部分细胞为旺盛生长的薄壁细胞;蓝光处理条件下的愈伤组织结构与红蓝光处理相似,但细胞数量、层数略少;白光处理条件下仍有一定数量的薄壁细胞,而红光处理条件下薄壁细胞数量最少,细胞脱分化的程度最低。
2.2 不同光照处理诱导棉花不同光信号系统基因的表达
光敏色素PHYA、PHYB是红光的主要受体,隐花色素(CRYs)是一类广泛存在于动植物中的蓝光受体。通过检测光受体基因、、和在不同光照下的表达量,发现和在蓝光处理条件下的表达量最高,红蓝光次之;而和在红光的处理条件下表达量最高,红蓝光次之(图2-A—D)。表明红光、蓝光处理分别促进了相应光受体的表达,进而增加红光、蓝光的吸收,表明采用不同光质处理、诱导棉花外植体出愈和愈伤增殖是有效的。
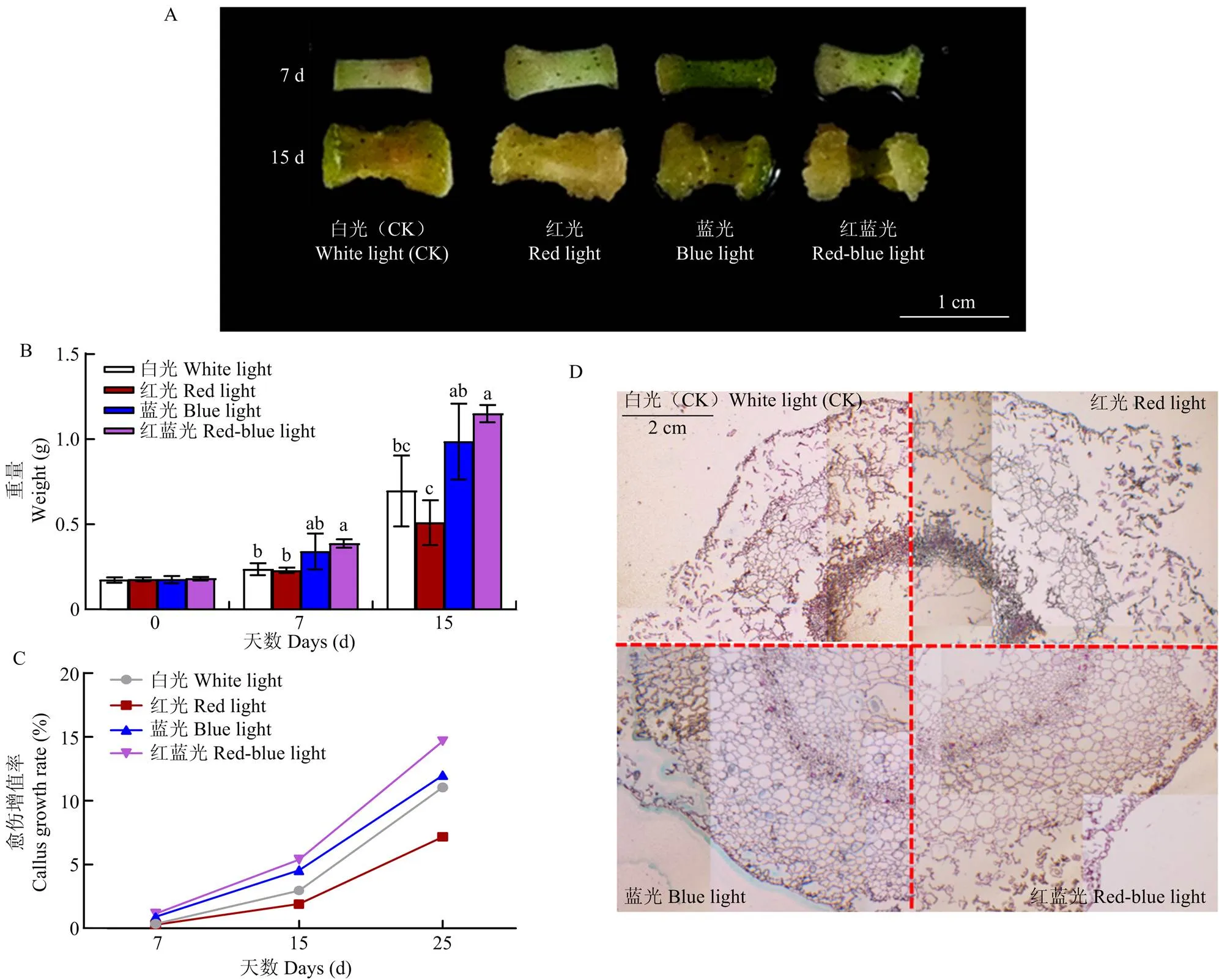
A:7和15 d的下胚轴;B:0、7和15 d的下胚轴重量变化;C:7—25 d愈伤组织的愈伤增值率;D:愈伤细胞形态观察。不同字母表示在=0.05水平差异显著
A: 7 d and 15 d hypocotyl; B: weight change of 0 d, 7 d and 15 d hypocotyl; C: callus enhancement rate of 7-25 d callus; D: cell morphological observationz. Different letters represent a significant difference at=0.05
图1 不同光照下棉花下胚轴诱导愈伤组织的动态变化
Fig. 1 The dynamic change of callus induced from hypocotyl under varied lights
此外,光受体感知光信号后,通过与其互作的转录因子PIF将相应的光信号进行传递。通过检测有关的表达,发现的表达量在红蓝光、蓝光、红光处理条件下均显著高于白光,的表达在蓝光与红蓝光处理条件下显著高于白光,而红光在处理条件下低于白光。推测红光和蓝光均诱导的表达,且红光的诱导效果优于蓝光,同时,蓝光还诱导的表达。结果表明,不同光质处理诱导了不同光受体的表达,促进了光的吸收,进而通过调控相应的互作因子表达,将光信号进一步传递,调控生长发育进程。
2.3 不同光照处理影响了棉花愈伤组织体胚再生相关基因的表达
通过对愈伤组织体胚相关基因进行检测,结果显示,4种光照处理条件下,的表达量存在差异。红蓝光处理有利于的表达,而单一的红光处理不利于该基因的表达(图3-A和图3-C)。在7和15 d的愈伤组织中,经红蓝光处理的表达量均为最高,且显著高于白光,但在单一红光处理下,7 d时的表达量与白光处理相当(图3-A),而15 d时其表达量已显著低于白光(图3-C)。在15 d的愈伤组织中(图3-C),经红蓝光处理的表达量显著高于蓝光、红光和白光,后3种光照间无显著差异(图3-C)。
4种光照处理条件下,的表达量存在差异,其表达模式与相似,红蓝光处理有利于的表达,而单一的红光处理不利于该基因的表达(图3-B和图3-D),在7和15 d的愈伤组织中,经红蓝光处理的的表达量均为最高,而在红光处理15 d的愈伤组织中,的表达量极显著低于白光处理。
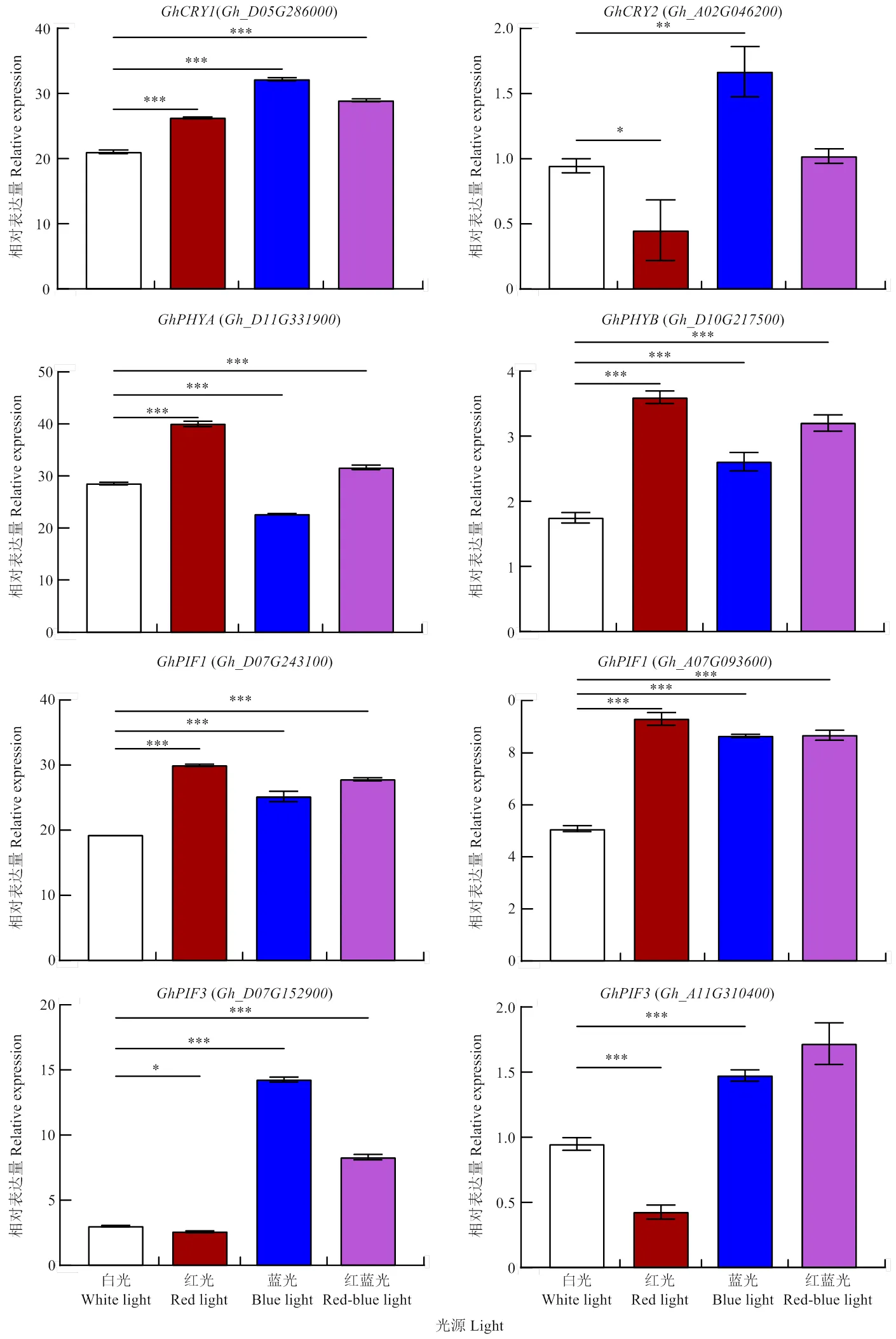
*<0.05,**<0.01,***<0.0005。下同 *<0.05, **<0.01, ***<0.0005. The same as below
图2 4种光照处理条件下愈伤组织光信号系统基因的表达
Fig. 2 Gene expression level of light signaling system in calluses under four light conditions
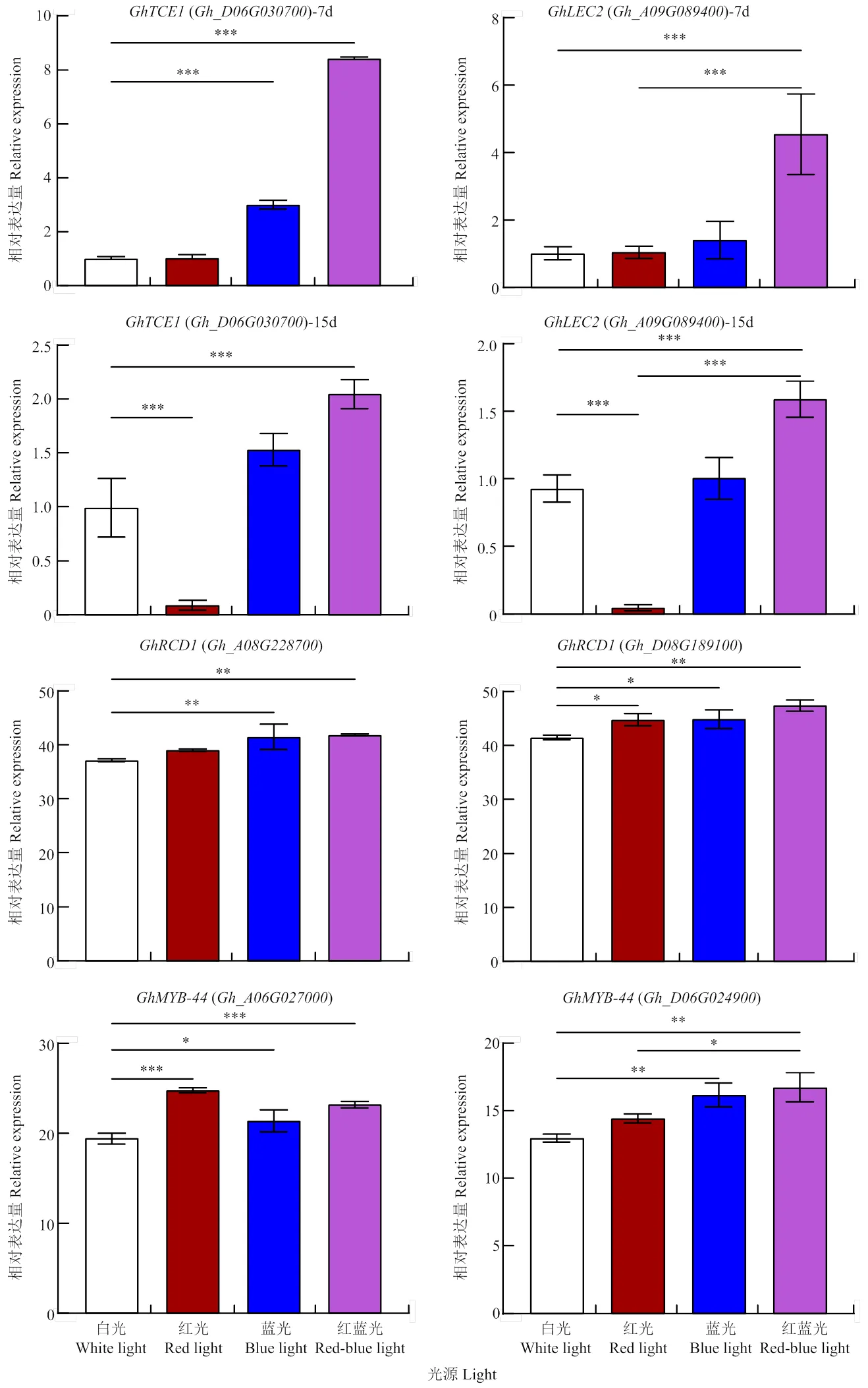
图3 不同光照处理下愈伤组织中分化相关基因的表达量
4种光照处理条件下,在红蓝光处理条件下的表达量最高,且显著高于白光处理(图3-E—F),()红蓝光处理条件下的表达量最高,且显著高于白光处理(图3-G)
以上结果表明,红蓝光处理促进后期体胚的发生,从而影响愈伤组织的生长。
2.4 不同光照处理对棉花愈伤组织内ROS含量的影响
通过检测7和15 d愈伤组织中CAT酶的活性和ROS含量,发现在检测的2个时期,CAT酶活均在红蓝光处理条件下最高,蓝光处理下次之,而红光处理条件下最低(图4-A和图4-C)。在7和15 d愈伤组织中,ROS含量虽表现出在蓝光和红蓝光处理条件下稍低,但不同处理间并不存在显著差异(图4-B和图4-D)。结果表明,红蓝光、蓝光处理可提高愈伤组织中CAT酶的活性,从而使细胞中ROS的含量处于相对较低水平,促进愈伤增殖。

A:第7天CAT酶活;B:第7天的ROS含量;C:第15天的CAT酶活;D:第15天的ROS含量
A: CAT enzyme activity on day 7; B: ROS content on day 7; C: CAT enzyme activity on day 15; D: ROS content on day 15
图4 愈伤组织在第7和15天的CAT酶活及ROS含量比较
Fig. 4 Comparison of CAT enzyme activity and ROS content of calluses in 7 d and 15 d
3 讨论
3.1 不同光质影响棉花愈伤组织的增殖
在组织培养中,光是影响植物愈伤组织生长和分化的重要环境因子[38],不同的光质对愈伤组织的生长有不同的效应。本研究结果表明,红蓝光(1﹕1)处理条件下的愈伤组织鲜重是白光对照处理下的1.65倍,而红蓝光处理相比于白光(CK)处理,棉花愈伤组织分化时间提前约30 d,表明愈伤组织增殖是分化的前提和基础。此外,再生相关基因、的表达量在红蓝光处理下最高,与愈伤组织增殖速度的结果一致。魏喜等[37]研究发现红蓝光促进棉花体细胞胚胎的发生,与本研究部分结果一致。张真等[39]发现黄光有利于葡萄愈伤组织的增殖,刘浩等[40]发现红光下萝卜愈伤组织的增殖倍数最高,顾梦云等[41]发现红蓝光3﹕1配比促进红掌愈伤组织的增殖。吴鹏飞[42]、谷艾素[43]分别对草莓、花烛叶片进行愈伤组织诱导,发现红光促进愈伤组织的诱导与形成。上述研究表明,不同植物对光的响应不同,不同光质组合对不同植物愈伤组织增殖和体细胞胚胎发生的影响存在差异。
3.2 活性氧对棉花愈伤增殖的影响
活性氧ROS是调控植物细胞增殖与分化的重要信号分子[44]。CAT酶是生物防御体系的关键酶之一。Fry的研究表明一定含量的ROS有利于细胞壁多糖的降解,促进细胞分裂[45]。Deng等[28]研究发现,的过表达可减少愈伤组织中ROS的过度积累,促进细胞增殖。Yuan等[29]发现、、和在愈伤组织诱导、增殖和胚性细胞产生过程中时序表达,调控体胚发生过程中ROS的动态平衡,进而影响体细胞胚胎发生。本研究结果表明,红蓝光处理下愈伤组织中、、的表达量最高,而ROS水平较低。表明红蓝光处理促进了愈伤组织中、、等基因的表达和CAT酶活性,同时,其ROS含量相对较低,因而促进了愈伤组织的增殖和再生。ROS的分布存在空间特异性,在植物器官形成和发育过程中具有重要作用,适当浓度的ROS可促进植物的生长和发育[46-47]。
3.3 植物光的吸收和传递对棉花愈伤增殖的影响
植物通过光感受系统和信号系统感知并传递光信号,进而调节其生长发育[27]。许大全等[48]在探究多种光质对植物生长发育影响时发现,红蓝组合光最优,其次是白光。Bukhov等[49]研究进一步表明,红蓝组合光中合适的蓝光比例有利于植物高光合能力的形成。Matsuda等[50]研究也发现,在红蓝组合光下生长的水稻叶片,其光合速率高于在单一红光下生长的叶片。刘文科等[51]也发现,与单一的红、蓝光相比,红蓝组合光和白光有利于提高豌豆苗的营养品质。本研究结果表明,不同光质处理可以诱导愈伤组织中不同的光受体基因表达,、、和等光受体基因的表达量在红光和蓝光的诱导下显著提高,对应的PIF基因的表达量也相应增加,表明愈伤组织虽非成熟的植物组织和器官,但同样可以感知光,且其增殖和生长受到光的诱导和光质的影响(图5)。
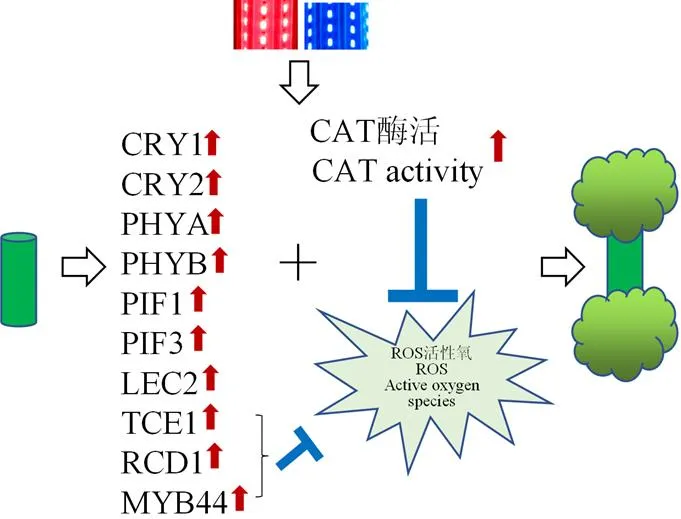
图5 红蓝光促进棉花愈伤诱导增殖
4 结论
红蓝光(1﹕1)处理促进了愈伤组织中增殖再生相关基因的表达,提高了CAT酶活性,并使其ROS水平相对较低,最终促进愈伤组织的诱导和增殖。
[1] ZHANG G Y, LIU L F, MA Z Y. Study on heterosis utilization of insect-resistant transgenic Bt () cotton. Acta Gossypii Sinica, 2001, 13(5): 264-267.
[2] SINGH D P, SINGH I P, TYAGI A P. Association analysis for yeild components in upland cotton. Madras Agricultural Journal, 2015, 1 (52): 37-40.
[3] ZHENG W, ZHANG X Y, YANG Z R, WU J H, LI F L, DUAN L L, LIU C L, LU L L, ZHANG C J, LI F G. Atwuschel promotes formation of the embryogenic callus in. PLoS ONE, 2014, 9(1): e87502.
[4] APPELGREN M. Effects of light quality on stem elongation of. Scientia Horticulturae, 1991, 45(3/4): 345-351.
[5] SÆBØ A, KREKLING T, APPELGREN M. Light quality affects photosynthesis and leaf anatomy of birch plantlets. Plant Cell, Tissue and Organ Culture, 1995, 41(2): 177-185.
[6] INOUE S I, KINOSHITA T, MATSUMOTO M, NAKAYAMA K I, DOI M, SHIMAZAKI K I. Blue light-induced autophosphorylation of phototropin is a primary step for signaling. Proceedings of the National Academy of Sciences of the United States of America, 2008, 105(14): 5626-5631.
[7] WANG H, GU M, CUI J X, SHI K, ZHOU Y H, YU J Q. Effects of light quality on CO2assimilation, chlorophyll-fluorescence quenching, expression of Calvin cycle genes and carbohydrate accumulation in. Journal of Photochemistry and Photobiology B, Biology, 2009, 96(1): 30-37.
[8] WANG X Y, XU X M, CUI J. The importance of blue light for leaf area expansion, development of photosynthetic apparatus, and chloroplast ultrastructure ofgrown under weak light. Photosynthetica, 2015, 53(2): 213-222.
[9] LI H M, TANG C M, XU Z G. The effects of different light qualities on rapeseed (L.) plantlet growth and morphogenesis. Scientia Horticulturae, 2013, 150(2): 117-124.
[10] HERNÁNDEZ R, KUBOTA C. Physiological responses of cucumber seedlings under different blue and red photon flux ratios using LEDs. Environmental and Experimental Botany, 2016, 121(1): 66-74.
[11] Horvath D. Common mechanisms regulate flowering and dormancy. Plant Science, 2009, 177(6): 523-531.
[12] Chen M. Phytochrome nuclear body: an emerging model to study interphase nuclear dynamics and signaling. Current Opinion in Plant Biology, 2008, 11(5): 503-508.
[13] Ahmad M, Cashmore A R.gene ofencodes a protein with characteristics of a blue-light photoreceptor. Nature, 1993, 366(6451): 162-166.
[14] Hoffman P D, Batschauer A, Hays J B. PHH1, a novel gene fromthat encodes a protein similar to plant blue-light photoreceptors and microbial photolyases. Molecular & General Genetics, 1996, 253(1/2): 259-265.
[15] Cashmore A R, Jarillo J A, Wu Y J, Liu D. Cryptochromes: blue light receptors for plants and animals. Science, 1999, 284(5415): 760-765.
[16] Guo H, Yang H, Mockler T C, Lin C. Regulation of flowering time byphotoreceptors. Science, 1998, 279(5355): 1360-1363.
[17] 岳玲琦, 邢巧娟, 张晓兰, 梁雪, 王乾, 齐红岩. 光敏色素互作因子在植物抵御逆境胁迫中的作用研究进展. 园艺学报, 2021, 48(4): 632-646.
YUE L q, XING Q j, ZHANG X l, LIANG X, WANG Q, QI H y. Research progress on the effect of phytochrome interacting factors in plant resistance to abiotic stress. Acta Horticulturae Sinica, 2021, 48(4): 632-646. (in Chinese)
[18] Cordeiro A M, Figueiredo D D, Tepperman J, Borba A R, LourenÇo T, Abreu I A, Ouwerkerk P B F, Quail P H, MARGARIDA OLIVEIRA M, Saibo N J M. Rice phytochrome- interacting factor protein OsPIF14 represses OsDREB1B gene expression through an extended N-box and interacts preferentially with the active form of phytochrome B. Biochimica et Biophysica Acta, 2016, 1859(2): 393-404.
[19] Kumar I, Swaminathan K, Hudson K, Hudson M E. Evolutionary divergence of phytochrome protein function inPIF3 signaling. Journal of Experimental Botany, 2016, 67(14): 4231-4240.
[20] Rosado D, Gramegna G, Cruz A, Lira B S, Freschi L, de Setta N D, Rossi M. Phytochrome interacting factors (PIFs) in: diversity, evolutionary history and expression profiling during different developmental processes. PLoS ONE, 2016, 11(11): e0165929.
[21] Zhou L J, Mao K, Qiao Y, Jiang H, Li Y Y, Hao Y J. Functional identification of MdPIF1 as a phytochrome interacting factor in apple. Plant Physiology and Biochemistry, 2017, 119: 178-188.
[22] 李瑞玲, 叶云天, 江雷雨, 叶宇芸, 肖婕, 李亚丽, 李欣, 汤浩茹. 草莓PIF3基因的克隆及表达分析. 分子植物育种, 2018, 16(19): 6220-6227.
Li R L, Ye Y T, Jiang L Y, Ye Y Y, Xiao J, Li Y L, Li X, Tang H R. Cloning and expression analysis of PIF3 gene in× ananassa. Molecular Plant Breeding, 2018, 16(19): 6220-6227. (in Chinese)
[23] 徐向东, 任逸秋, 张利, 李煜, 王丽娟, 卢孟柱. 杨树PIF基因家族成员表达模式研究. 林业科学研究, 2018, 31(2): 19-25.
XU X D, REN Y Q, ZHANG L, LI Y, WANG L J, LU M Z. Analysis of expression pattern of PIF family members in. Forest Research, 2018, 31(2): 19-25. (in Chinese)
[24] 刘畅畅, 黄敏. 玉米LEC1基因家族的鉴定与生物信息学分析. 甘肃农业科技, 2022, 53(1): 31-37.
LIU C C, HUANG M. Identification and bioinformatics analysis ofgene family in maize. Gansu Agricultural Science and Technology, 2022, 53(1): 31-37. (in Chinese)
[25] Braybrook S A, Harada J J. LECs go crazy in embryo development. Trends in Plant Science, 2008, 13(12): 624-630.
[26] Le B H, Cheng C, Bui A Q, Wagmaister J A, Henry K F, Pelletier J, Kwong L, Belmonte M, Kirkbride R, Horvath S, Drews G N, Fischer R L, Okamuro J K, Harada J J, Goldberg R B. Global analysis of gene activity duringseed development and identification of seed- specific transcription factors. Proceedings of the National Academy of Sciences of the United States of America, 2010, 107(18): 8063-8070.
[27] Yang X Y, Zhang X L. Regulation of somatic embryogenesis in higher plants. Critical Reviews in Plant Sciences, 2010, 29(1): 36-57.
[28] DENG J W, SUN W N, ZHANG B Y, SUN S M, XIA L J, MIAO Y H, HE L R, LINDSEY K, YANG X Y, ZHANG X L. GhTCE1-GhTCEE1 dimers regulate transcriptional reprogramming during wound-induced callus formation in cotton. The Plant Cell, 2022, 34(11): 4554-4568.
[29] YUAN J C, LIU X X, ZHAO H, WANG Y, WEI X, WANG P, ZHAN J J, LIU L S, LI F G, GE X Y. GhRCD1 regulates cotton somatic embryogenesis by modulating the GhMYC3-GhMYB44-GhLBD18 transcriptional cascade. The New Phytologist, 2023, 240(1): 207-293.
[30] Yang X y, Zhang X l, Yuan D j, Jin F y, Zhang Y c, Xu J. Transcript profiling reveals complex auxin signalling pathway and transcription regulation involved in dedifferentiation and redifferentiation during somatic embryogenesis in cotton. BMC Plant Biology, 2012, 12: 110.
[31] Jaspers P, Overmyer K, Wrzaczek M, Vainonen J P, Blomster T, Salojärvi J, Reddy R A, KangasjärvI J. The RST and PARP-like domain containing SRO protein family: analysis of protein structure, function and conservation in land plants. BMC Genomics, 2010, 11: 170.
[32] Brosché M, Blomster T, Salojärvi J, Cui F Q, Sipari N, Leppälä J, Lamminmäki A, Tomai G, Narayanasamy S, Reddy R A, Keinänen M, Overmyer K, Kangasjärvi J. Transcriptomics and functional genomics of ROS-induced cell death regulation by RADICAL-INDUCED CELL DEATH1. PLoS Genetics, 2014, 10(2): e1004112.
[33] Wirthmueller L, Asai S t, Rallapalli G, Sklenar J, Fabro G, Kim D S, Lintermann R, Jaspers P, Wrzaczek M, KANGASJÄRVI J, MACLEAN D, MENKE F L H, BANFIELD M J, JONES J D G.downy mildew effector HaRxL106 suppresses plant immunity by binding to RADICAL-INDUCED CELL DEATH1. The New Phytologist, 2018, 220(1): 232-248.
[34] Shapiguzov A, Vainonen J P, Hunter K, Tossavainen H, Tiwari A, JÄRVI S, Hellman M, Aarabi F, Alseekh S, Wybouw B, VAN DER KELEN K, NIKKANEN L, KRASENSKY- WRZACZEK J, SIPARI N, KEINÄNEN M, TYYSTJÄRVI E, RINTAMÄKI E, DE RYBEL B, SALOJÄRVI J, VAN BREUSEGEM F, FERNIE A R, BROSCHÉ M, PERMI P, ARO E M, WRZACZEK M, KANGASJÄRVI J.RCD1 coordinates chloroplast and mitochondrial functions through interaction with ANAC transcription factors. eLife, 2019, 8: 4328.
[35] 许文杰, 黄远浩, 韩蓉蓉, 刘燕琴, 曹敏, 宋经元. 基于全基因组的栀子苷生物合成相关MYB转录因子系统分析. 药学学报, 2023, 58(8): 2522-2531.
XU W j,HUANG Y h,HAN R r, LIU Y q, CAO M,SONG J y. systematic analysis of MYB transcription factors related to the geniposide biosynthesis inEllis based on whole genome.Acta Pharmaceutica Sinica, 2023, 58(8): 2522-2531. (in Chinese)
[36] Wang X c, Niu Q W, Teng C, Li C, Mu J y, Chua N H, Zuo J r. Overexpression of PGA37/MYB118 and MYB115 promotes vegetative-to-embryonic transition in. Cell Research, 2009, 19(2): 224-235.
[37] 魏喜, 王倩华, 葛晓阳, 陈艳丽, 丁颜朋, 赵明哲, 李付广. 不同红蓝配比的光质对棉花体细胞胚胎发生和植株再生的影响. 中国农业科学, 2019, 52(6): 968-980.doi:10.3864/j.issn.0578-1752.2019. 06.002.
WEI X, WANG Q h, GE X y, CHEN Y l, DING Y p, ZHAO M z, LI F g. Effects of different red and blue ratios on the somatic embryogenesis and plant regeneration of cotton. Scientia Agricultura Sinica, 2019, 52(6): 968-980. doi:10.3864/j.issn.0578-1752.2019.06. 002. (in Chinese)
[38] 倪德祥. 光在植物组织培养中的调控作用. 自然杂志, 1986, 8(3): 193-198.
NI D x. regulatory of light in plant tissue culture. Nature Magazine, 1986,8(3): 193-198. (in Chinese)
[39] 张真, 李胜, 李唯, 刘媛, 吴兵, 张青松, 李婷. 不同光质光对葡萄愈伤组织增殖和白黎芦醇含量的影响. 植物生理学通讯, 2008, 44(1): 106-108.
ZHANG Z, LI S, LI W, LIU Y, WU B, ZHANG Q s, LI T. Effects of different light qualities on the callus fromL.and resveratrol content. Plant Physiology Communications, 2008, 44(1): 106-108. (in Chinese)
[40] 刘浩, 李胜, 马绍英, 罗丽媛, 薛冲, 方艳, 张真, 刘媛. LED不同光质对萝卜愈伤组织诱导、增殖和萝卜硫素含量的影响. 植物生理学通讯, 2010, 46(4): 347-350.
LIU H, LI S, MA S y, LUO L y, XUE C, FANG Y, ZHANG Z, LIU y. Effects of different LED light qualities on callus induction, proliferation and sulforaphane content ofL.. Plant Physiology Communications, 2010, 46(4): 347-350. (in Chinese)
[41] 顾梦云, 曾伟达, 宿庆连, 黄明翅, 冯肖梅, 刘艳艳, 张雪莲, 周晓云. 不同LED光质配比和光照强度对红掌新品种‘福星’组织培养的影响. 广东农业科学, 2023, 50(5): 46-55.
GU M y, ZENG W d, SU Q l, HUANG M c, FENG X m, LIU Y y, ZHANG X l, ZHOU X y. Effects of different LED light quality ratio and light intensity on tissue culture of a newcultivar Fuxing. Guangdong Agricultural Sciences, 2023, 50(5): 46-55. (in Chinese)
[42] 吴鹏飞. 激素与光质处理对施草莓组培快繁的影响研究[D]. 天津: 天津农学院, 2017.
Wu P f. Effects of hormone and light treatment on rapid propagation of tissue culture of strawberry[D]. Tianjin: Tianjin Agricultural University, 2017. (in Chinese)
[43] 谷艾素. 光调控对花烛组织培养及试管苗光合特性的影响[D]. 南京: 南京农业大学, 2011.
Gu A s. Effects of light control on tissue culture and photosynthesis characteristics of[D]. Nanjing: Nanjing Agricultural University, 2011. (in Chinese)
[44] Mccully M. The development of lateral roots in the development and function of roots. New York: AcademicPress, 1975.
[45] Fry S C. Oxidative scission of plant cell wall polysaccharides by ascorbate induced hydroxyl radicals. The Biochemical Journal, 1998, 332(2): 507-515.
[46] 罗丽. 甜橙NADPH氧化酶基因家族的鉴定及抗寒性分析[D]. 扬州: 扬州大学, 2019.
Luo l. Identification and cold resistance analysis of NADPH oxidase gene family in sweet orange[D]. Yangzhou: Yangzhou University, 2019. (in Chinese)
[47] Asada K. Production and scavenging of reactive oxygen species in chloroplasts and their functions. Plant Physiology, 2006, 141(2): 391-396.
[48] 许大全, 高伟, 阮军. 光质对植物生长发育的影响. 植物生理学报, 2015, 51(8): 1217-1234.
Xu D q, Gao W, Ruan J.Effects of light quality on plant growth and development. Plant Physiology Journal, 2015, 51(8): 1217-1234. (in Chinese)
[49] Bukhov N, Makarova V, Bondar V, Drozdova I, Egorova E, Kotova L, Kotov A, Krendeleva T. Photosynthetic apparatus in primary leaves of barley seedlings grown under blue or red light of very low photon flux densities. Photosynthesis Research, 1999, 60(2): 179-190.
[50] Matsuda R, Ohashi-Kaneko K, Fujiwara K, Goto E, Kurata K. Photosynthetic characteristics of rice leaves grown under red light with or without supplemental blue light. Plant and Cell Physiology, 2004, 45(12): 1870-1874.
[51] 刘文科, 杨其长, 邱志平, 赵姣姣. LED光质对豌豆苗生长、光合色素和营养品质的影响. 中国农业气象, 2012, 33(4): 500-504.
LIU W k, YANG Q c, QIU Z p, ZHAO J j. Effects of LED light quality on growth, photosynthetic pigments and nutritional quality of pea seedlings. Chinese Journal of Agrometeorology, 2012, 33(4): 500-504. (in Chinese)
Red and Blue Light Promotes Cotton Callus Induction and Proliferation

1College of Agronomy, Xinjiang Agricultural University/Engineering Research Center for Cotton, Ministry of Education/Emphasis Laboratory of Agricultural Biotechnology, Urumqi 830052;2Biotechnology Research Institute, Chinese Academy of Agricultural Sciences, Beijing 100081
【Objective】Upland cotton () genetic transformation faces series of challenges such as a prolonged cycle and low efficiency, with the relatively slow proliferation rate of callus tissue being a critical factor contributing to the extended transformation period. This study aims to investigate the optimal light conditions for upland cotton callus growing. The establishment of this research endeavor is poised to accelerate callus proliferation and ultimately provide a technical foundation for shortening the period of cotton genetic transformation. 【Method】The hypocotyls of the upland cotton line WC were used as explants to induce callus tissues under four different lights: red, blue, red-blue (1:1), and white light (CK). The study aimed to investigate the varied effects of the different lights on callus induction and proliferation, determine the optimal light condition by comparing with the callus proliferation rate, morphological characteristics et al. under different light treatments. 【Result】Different light treatments had a significant impact on the callus induction and growth. The red-blue light treatment exhibited a most positive effect on both callus inducing and proliferation, which observed on the 7th and 15th day. The fresh weight of callus at 7 d under the red-blue light (0.39 g) was the heaviest, followed by the blue light (0.34 g), then the white light (0.24 g) and the red light (0.23 g). The same fresh weight order of the callus was observed at 15 d, with the treatment of the red-blue light (1.15 g) > blue light (0.98 g) > white light (0.69 g) > red light (0.51 g). The callus weight under red-blue light was 1.65 times heavier than the control, increased by 16.5% and 125.5% compared to the treatment of only blue or red light, respectively. In line with this, the callus proliferation rate in the second week under red-blue light was as high as 14.67%, which is twice to that of the red-light treatment (7.17%). The expression level of those genes promoted to cell proliferation and somatic embryo regeneration was consistent with the phenotype, the highest level was under the red-blue light treatment. Furthermore, the activity of the catalase (CAT) was significantly increased under the red-blue light treatment, while the content of reactive oxygen species (ROS) was lower than control. 【Conclusion】Employing different light conditions could result in the varied proliferation rate of cotton callus. The optimal light treatment is by red-blue light in a 1﹕1 ratio, followed by blue light and then white light. However, employing red light only does not favor the callus growth. The treatment of red-blue light (1﹕1) induces the expression of phytochromes and cryptochromes in the callus, increases the expression level of those genes promoted to callus growth. It also enhances the activity of catalase, reduces the content of ROS, and finally promotes the callus proliferation.
upland cotton; red light; blue light; callus proliferation rate; active oxygen species

2023-08-04;
2023-09-26
国家重点研发计划子课题(2022YFD1200304-3)、国家自然科学基金(52161145104)、中国农业科学院科技创新工程、中国农业科学院生物技术研究所基本科研业务费
李凯利,E-mail:835294355@qq.com。通信作者张锐,E-mail:zhangrui@caas.cn。通信作者陈全家,E-mail:chqjia@126.com
(责任编辑 李莉)
