丁香酚对大鼠心肌缺血再灌注损伤的抑制作用及其机制
2024-03-08朱秋梦石佳琦吕玮张昕肖云峰
朱秋梦,石佳琦,吕玮,张昕,肖云峰,2
1 内蒙古医科大学药学院,呼和浩特 010110;2 内蒙古医科大学新药安全评价研究中心
早期恢复血流是缺血性心脏病常见的治疗策略。在心肌梗死及再灌注初期,心肌细胞发生坏死、凋亡,导致心肌细胞数量减少,引起心功能不全。再灌注治疗可缩小心肌梗死面积,保护心肌组织,但再灌注也有可能会导致进一步的心肌损伤,也称为心肌缺血再灌注损伤(MIRI)。缺血后处理是通过短暂的冠状动脉闭塞反复中断再进行灌注,可减轻再灌注损伤,从而导致心肌梗死范围缩小[1]。MIRI涉及多种复杂的病理机制,研究显示其与钙超载、氧化应激、炎症反应、细胞凋亡和自噬等密切相关[2-3]。钙通道阻滞剂地尔硫䓬是治疗MIRI的常用药物,其对MIRI的改善作用已被临床证实[4]。丁香酚是一种酚类芳香族化合物,主要从丁香油中获得,具有良好的抗炎、抗氧化作用,临床上可用于心肌缺血类疾病的治疗。本课题组前期研究显示,丁香酚能够有效改善MIRI大鼠的心功能,并且发现其可通过抑制心肌细胞凋亡[5]、降低心肌细胞氧化应激水平[6]及增强心肌细胞能量代谢[7]来延缓MIRI的发展,但丁香酚在基因水平抑制MIRI的作用机制尚不明确。转录组测序技术可以定量、准确的确定RNA的表达水平,并能够通过对研究结果的比较确定细胞群中每一个分子的绝对数量[8]。由于外界刺激或环境变化时生物体中基因表达水平变化微小,2022年4月—8月,本研究采用转录组测序技术分析丁香酚作用于MIRI的差异表达基因,从转录组学水平进一步揭示MIRI的相关调控蛋白,以期阐明丁香酚改善MIRI的具体作用机制。
1 材料与方法
1.1 主要材料 清洁级Wistar 大鼠60 只,体质量(200 ± 20)g,购自斯贝福(北京)生物技术有限公司,实验动物生产许可证:SCXK(京)2019-0010。丁香酚(上海源叶生物科技有限公司),盐酸地尔硫䓬(天津田边制药有限公司),乌拉坦(上海康拓化工有限公司);TruSeq Stranded mRNA LT Sample Prep Kit(美国Illumina),Qubit RNA Assay Kit(美国Life Technologies),Bioanalyzer 2100 RNA-6000 Nano Kit(美国Aglient),Bioanalyzer 2100 DNA-1000 Kit(美国Aglient),SuperScript Ⅱ Reverse Transcriptase(美国Invitrogen),乳酸脱氢酶(LDH)试剂盒、肌酸激酶(CK)试剂盒、肌酸激酶同工酶(CK-MB)试剂盒(宁波美康生物科技股份有限公司);台式离心机(德国Eppendorf),PCR仪(美国Bio-Rad);紫外分光光度计(美国Thermo),定量仪(美国Invitrogen)。
1.2 动物分组处理与建模 健康Wistar 大鼠60只,随机分为假手术组、MIRI 组、丁香酚低剂量组、丁香酚中剂量组、丁香酚高剂量组、阳性对照组,每组10只。丁香酚低剂量组、丁香酚中剂量组、丁香酚高剂量组、阳性对照组分别给予50、100、200 mg/(kg·d)丁香酚及30 mg/(kg·d)盐酸地尔硫䓬灌胃,假手术组、MIRI组给予普通人羧甲基纤维素钠溶液灌胃,每日1次,共给药14 d。除假手术组外,各组均于末次给药1 h后采用结扎冠状动脉左前降支法建立大鼠MIRI模型。腹腔注射20%乌拉坦麻醉大鼠,仰卧位固定,使用生物机能实验系统记录其正常Ⅱ导联心电图。待心电稳定后连接小动物呼吸机,消毒左侧胸前及腋下皮肤,备皮。使用乳突撑开器于大鼠左侧第3、4肋间撑开胸廓暴露心脏。使用7-0带线缝合针在距冠状动脉左前降支2 mm处进针,在结扎处垫一硅胶管,而后将冠状动脉左前降支及硅胶管一起结扎。术中监测Ⅱ导联心电图ST段变化,心电图结果表明,大鼠进行血管结扎手术后ST段抬高,提示心肌缺血模型建立成功。30 min后松开结扎线,取出结扎线和硅胶管,从内向外逐层缝合,再灌注24 h。假手术组开胸后,在冠状动脉左前降支处仅穿线不结扎。
1.3 血清心肌损伤标志物检测 取各组大鼠腹主动脉血,采血管静置30 min,3 500 r/min 离心10 min取血清。采用全自动生化分析仪检测血清心肌损伤标志物CK、CK-MB、LDH。
1.4 心肌梗死面积比测定 采血结束后,快速摘取大鼠心脏,将其切成4~5 片,置于0.05%的TTC 溶液中,37 ℃恒温水浴振摇染色10~15 min。将其取出,洗去多余染料;心肌片按顺序排好并拍照,应用Image J 软件分析计算左心室面积及梗死区面积。心肌梗死面积比以梗死区心肌面积占左心室面积的百分比表示。
1.5 丁香酚作用于MIRI的差异表达基因筛选 采用转录组测序筛选丁香酚作用于MIRI 的差异表达基因。各组随机取3份心脏组织,用0.9%氯化钠溶液冲洗多余血迹,于液氮中速冻,放置在-80 ℃冰箱保存。提取心脏组织总RNA 并使用DNase 消化DNA 后,用带有Oligo 的磁珠富集真核生物mRNA;加入打断试剂将mRNA 打断成短片段,以打断后的mRNA 为模板,用六碱基随机引物合成一链cDNA,然后配制二链成反应体系合成二链cDNA,并使用试剂盒纯化双链cDNA;纯化的双链cDNA 再进行末端修复、加A尾并连接测序接头,进行片段大小选择并进行PCR 扩增;构建好的文库用Agilent 2100 Bioanalyzer 质检合格后,使用Illumina HiSeqTM2500 或Illumina HiSeq X Ten等测序仪进行测序,产生125 bp或150 bp 的双端数据。质检合格后,使用Illumina测序仪进行测序。先使用Trimmomatic[9]软件进行质控并去除接头,在此基础上过滤掉低质量碱基以及N 碱基,最终得到高质量的clean reads。将clean reads 使用hisat2[10]比对到物种的参考基因组,软件参数为默认参数,通过基因组比对率来评估样本的情况。通过eXpress[11]软件获取落到各个心脏组织中转录本的reads 数目,使用DESeq[12](2012) R package 的estimateSizeFactors 函数对数据进行标准化,并使用nbinomTest 函数计算差异比较的P值和foldchange 值。挑选出P<0.05,差异倍数>2 的差异转录本作为丁香酚作用于MIRI的差异表达基因。
1.6 差异表达基因的GO功能及KEGG信号通路富集分析 对转录组测序筛选出的差异表达基因进行GO 功能及KEGG 信号通路富集分析[13],其中GO 分析包括生物过程、分子功能及细胞组分。
1.7 统计学方法 采用SPSS22.0 统计软件及GraphPad Prism8.0绘图软件。计量资料采用K-S检验进行正态性分析,符合正态分布的资料以表示,组间比较行独立样本t检验。P<0.05 为差异有统计学意义。
2 结果
2.1 各组血清心肌损伤标志物CK、CK-MB、LDH 比较 血清心肌损伤标志物CK、CK-MB、LDH水平MIRI组>丁香酚低剂量组、丁香酚中剂量组、丁香酚高剂量组、阳性对照组>假手术组(P均<0.05)。见表1。
表1 各组血清CK、CK-MB、LDH比较(U/L,)
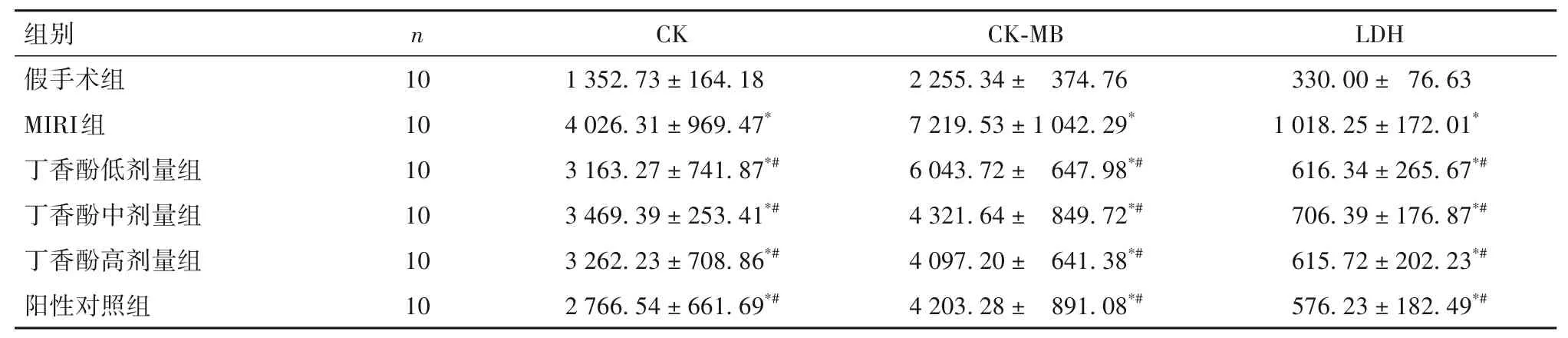
表1 各组血清CK、CK-MB、LDH比较(U/L,)
注:与假手术组比较,*P<0.05;与MIRI组比较,#P<0.05。
?
2.2 各组心肌梗死面积比比较 假手术组、MIRI组、丁香酚低剂量组、丁香酚中剂量组、丁香酚高剂量组、阳性对照组心肌梗死面积比分别为0、36.63% ± 0.11%、28.43% ± 0.05%、17.60% ±0.03%、17.47% ± 0.01%、22.27% ± 0.06%;心肌梗死面积比假手术组>丁香酚低剂量组、丁香酚中剂量组、丁香酚高剂量组、阳性对照组>MIRI 组(P均<0.05)。
2.3 丁香酚作用于MIRI 的差异表达基因筛选结果 与MIRI 组比较,丁香酚低剂量组共有1 035 个差异表达基因,其中594 个基因上调、441 个基因下调;丁香酚中剂量组共有513个差异表达基因,其中197 个基因上调、316 个基因上调;丁香酚高剂量组共有1 962 个差异表达基因,其中1 151 个基因上调、、811个基因下调。见OSID码图1。
2.4 差异表达基因的GO 功能富集分析结果 丁香酚低剂量组与MIRI组差异表达基因的GO分析结果显示,丁香酚作用于MIRI的生物过程主要涉及免疫反应、对脂多糖的反应、T 淋巴细胞增殖的正调控、病毒基因组复制的负调控等;细胞组分主要涉及细胞外空间、细胞表面、质膜外侧等;分子功能主要涉及趋化因子的活动、聚糖绑定、肽聚糖绑定、信号受体结合等(OSID 码图2)。丁香酚中剂量组与MIRI 组差异表达基因的GO 分析结果显示,丁香酚作用于MIRI的生物过程主要涉及对细菌的反应、病毒基因组复制的负调控、氧气输送以及核糖核酸酶活性的调节等;细胞组分主要涉及细胞外空间、血红蛋白复合体、染色体、着丝粒区以及着丝粒等;分子功能主要涉及低聚腺苷酸合成酶活性、载氧活性、血红素结合、信号受体结合等(OSID 码图3)。丁香酚高剂量组与MIRI组差异表达基因的GO分析结果显示,丁香酚作用于MIRI的生物过程主要涉及急性期反应、氧气输送、细胞群体增殖的正调控、细胞群体增殖的负调控等;细胞组分主要涉及细胞外空间、细胞外基质、C/D RNP 复合体等;分子功能主要涉及微管运动活动、信号受体活性、载氧活性、钙离子结合等(OSID码图4)。
2.5 差异表达基因的KEGG 信号通路富集分析结果 丁香酚低剂量组与MIRI 组差异表达基因的KEGG 分析结果显示,丁香酚作用下差异表达基因主要涉及细胞因子—细胞因子受体相互作用、趋化因子信号通路、NOD 样受体信号通路、TNF 信号通路等过程(OSID 码图5)。丁香酚中剂量组与MIRI组差异表达基因的KEGG 分析结果显示,丁香酚作用下差异表达基因 主要涉及1 型糖尿病、抗原处理和呈递、自身免疫性甲状腺疾病、FOXO 信号通路等过程(OSID 码图6)。丁香酚高剂量组与MIRI 组差异表达基因的KEGG 分析结果显示,丁香酚作用下差异表达基因主要涉及HIF-1 信号通路、AGERAGE 信号通路、PI3K-AKT 信号通路,JAK-STAT 信号通路等过程(OSID码图7)。
3 讨论
心肌缺血是中老年人的高危疾病。溶栓治疗后,心脏组织可能会遭受进一步的损害,即MIRI[14]。MIRI 的治疗方法主要包括非药物干预(缺血预处理)和药物治疗[15]。本课题组前期研究显示,丁香酚可对MIRI产生保护作用,但目前在基因层面对其分子机制研究较少。本研究结果显示,通过结扎大鼠冠状动脉左前降支30 mim,再灌注24 h 可使大鼠心电信号ST 段抬高,显示模型建立成功。心肌缺血后,心肌细胞受损,由于细胞膜破裂,细胞中的酶被释放出细胞。通过测量血清或培养基中的酶含量,可以评估心肌细胞损伤的程度。血清中LDH、CK、CK-MB 水平可直接反映大鼠心功能损伤的严重程度[16]。本研究结果表明,与MIRI 组比较,丁香酚各剂量组大鼠血清中LDH、CK、CK-MB 水平均在不同程度上有所降低,提示丁香酚可以减轻大鼠MIRI,降低心肌组织损伤标志物LDH、CK、CK-MB水平。
超低温取各组大鼠的心脏组织,提取其RNA 进行转录组测序显示,丁香酚低、中、高剂量组可分别对MIRI 大鼠产生1 035、513、1 962 个差异表达基因,其中丁香酚高剂量组差异基因表达数量最多,有个811 下调基因,1 151 个上调基因。这提示丁香酚对MIRI 的改善作用调用了许多具有广泛功能的基因。
丁香酚作用于MIRI差异表达基因的GO功能富集分析中,丁香酚各剂量给药组主要涉及生物调节、细胞过程以及刺激反应等功能。本课题组在丁香酚各剂量组作用于MIRI 的差异表达基因中检索心脏相关差异表达基因,并未得到内容,但得到一个与线粒体和自噬相关的差异表达基因Bnip3。在测序结果中,Bnip3于MIRI组基因表达上调。有研究表明,Bnip3 可以通过触发保护性应激反应,上调细胞自噬及去除受损的线粒体,从而改善MIRI[17]。Bnip3在GO 分析与缺氧反应、线粒体、心肌细胞凋亡过程的正调控、程序性细胞死亡的调控、线粒体碎片参与凋亡过程、线粒体自噬的正调控、有氧呼吸的调控、内在凋亡信号通路对缺氧的响应有关。这提示丁香酚可能通过提高心脏组织中Bnip3 的表达,在缺氧条件下通过上调线粒体自噬来清除受损线粒体,维持机体内环境稳定,从而缓解MIRI进展。丁香酚作用于MIRI 差异表达基因的KEGG 信号通路富集分析中,丁香酚各剂量给药组主要涉及JAK-STAT 信号通路、PI3K-AKT 信号通路信号通路、HIF-1α 信号通路等。该结果与本研究团队前期研究结果一致,即丁香酚可能通过抑制心肌细胞凋亡、降低心肌细胞氧化应激水平及增强心肌细胞能量代谢来缓解MIRI 的发展。与MIRI 组比较,缺氧诱导因子HIF-1信号通路在丁香酚高剂量组上调趋势中富集得分最高且差异最明显。有研究发现,MIRI大鼠血清HIF-1α水平显著升高[18],即HIF-1α 及其信号通路在MIRI中起到促进作用。而丁香酚干预可改变HIF-1 信号通路在心脏组织中的表达趋势,提示丁香酚可能通过调控HIF-1 信号通路来缓解MIRI 的发展,但其对HIF-1 信号通路的具体机制值得进一步研究。除此之外,FOXO 信号通路,PI3K-AKT 信号通路、铁死亡以及原发性免疫缺陷都与MIRI具有一定的相关性,值得进一步研究。
综上所述,丁香酚可抑制大鼠MIRI,其分子机制可能与HIF-1 信号通路有关。下一步可针对丁香酚通过HIF-1 信号通路缓解MIRI 的具体机制进行进一步研究,以期为MIRI的药理学预防提供更多理论依据。
