没食子酸改善低压低氧诱发心肌损伤的体内外观察及机制探讨
2024-03-08阿迪莱艾合麦提托合提艾尼娃尔艾克木是文辉方磊杨涛伊力亚尔尼加提3
阿迪莱·艾合麦提托合提,艾尼娃尔·艾克木,2,3,4,是文辉,方磊,杨涛,伊力亚尔·尼加提3,4,
1 新疆医科大学药学院,乌鲁木齐 830011;2 新疆维吾尔医学专科学校药学系;3 新疆和田特色中医药研究重点实验室;4 新疆维吾尔自治区维吾尔药材及制剂质量控制工程研究中心;5 新疆乌鲁木齐市军区总医院重点实验室;6 新疆医科大学中心实验室;
低压低氧(HH)是由于暴露于高原环境所导致的一种应激性环境条件[1]。心脏作为耗氧量较高的器官,向其提供充足的氧气对维持心肌细胞活力和功能至关重要[2]。当机体长时间处于HH环境下,心肌细胞供氧减少,可能加重或诱发心血管疾病[3]。目前临床上治疗HH 诱发的心肌损伤的方法有高压氧、钙拮抗剂等,然而这些治疗效果仍然不十分理想且不良反应较多。为了开发更有效的治疗药物,进一步提高用药物安全性,越来越多的研究人员将目光专注于天然中草药及其单体化合物。没食子酸(GA)又称五倍子酸,是一种天然产物化学成分,存在于五倍子、漆树、茶等植物中,具有抗氧化、抗炎、促进肿瘤细胞凋亡及保护心脑血管的作用[4]。然而,GA对心肌抗氧化损伤的综合作用机制仍不十分明确。2021 年7 月—2023 年9 月,本研究通过建立大鼠体内外低氧损伤模型,观察GA 对HH 诱发心肌损伤的改善作用,并探讨其相关机制。现报告如下。
1 材料与方法
1.1 主要材料 雄性无特定病原体SD 大鼠30 只,体质量(200 ± 30)g,由新疆医科大学实验动物中心提供,实验动物生产许可证号:SYSK(xin)2020-003;大鼠心肌细胞H9C2 购自中国科学院上海生科院细胞资源中心。GA(纯度≥98.0%,上海源叶生物科技有限公司),Hochst33342(北京索莱宝科技有限公司),活性氧(ROS)试剂盒(北京索莱宝科技有限公司),双抗/青链霉素合剂、0.25%胰酶-EDTA消化液(美国Hyclone 公司),胎牛血清(美国Gbico 公司),二甲基亚砜DMSO(美国MP Biomedicals 公司),MTT(美国Sigma 公司),凋亡试剂盒(美国BD 公司),BCA 蛋白浓度测定试剂盒(北京索莱宝科技有限公司),β-actin、B 淋巴细胞瘤2(Bcl-2)、Bcl-2 关联X 蛋白(Bax)、半胱氨酸天冬氨酸蛋白酶3(Caspase-3)抗体(北京Affinity 公司),丙二醛(MDA)、超氧化物歧化酶(SOD)、谷胱甘肽过氧化氢酶(GSH-Px)、一氧化氮合酶(iNOS)、内皮素1(ET-1)试剂盒(武汉伊莱瑞特生物科技有限公司)。BD 流式细胞仪(美国BD公司),蛋白质电泳系统套装(美国Bio-Rad 公司),正置激光共聚焦显微镜(日本Nikon 公司),心脏超声探头(美国PHILIPS 公司),多功能酶标仪(北京悦昌行科技有限公司),化学发光蛋白质印迹成像定量分析仪(美国Protein Simple 公司),高低速冷冻离心机(湖南湘仪实验室仪器开发有限公司)。
1.2 GA改善HH诱发心肌损伤的体内观察
1.2.1 大鼠心肌损伤模型建立及分组处理 30 只SD 大鼠随机分为正常组、HH 模型组、GA 低剂量组、GA 中剂量组、GA 高剂量组,每组6 只。除正常组外,各组均在模拟海拔5 000 m 的HH 舱中暴露30 d建立SD大鼠慢性高原病模型,实验舱的环境条件为海拔5 000 m,大气压54.1 kPa,氧分压10.84 kPa,温度18~26 ℃,湿度40%~60%。将SD大鼠分笼饲养在实验舱内,在造模过程中每日检查并记录各组SD 大鼠的毛发脱落、口腔、鼻腔、眼分泌物等情况。GA 低、中、高剂量组在建模后分别给予12.5、25.0、50.0 mg/kg 的GA 灌胃,每天1 次,正常组及HH 模型组给予等量生理盐水灌胃,持续15 d。各组均给予普通饲料喂养,自由取食和饮水。
1.2.2 大鼠心功能观察 采用心脏超声检测。腹腔注射1.5%戊巴比妥钠麻醉大鼠,超声心动图检测大鼠的心脏功能,常规探查大鼠胸骨旁、心尖四腔切面,包括右心室射血期(RVET)、右心室射血前期(RPEP)、射血分数(EF)、肺动脉压加速时间(PAAT),检测由有超声工作经历的专业技术人员进行操作。
1.2.3 大鼠血清氧化应激指标检测 各组均采用腹主动脉取血方式收集血液,室温下放置30 min,4~5 ℃,3 000 r/min 离心20 min,取上清液,严格按照生化试剂盒操作说明书测定氧化应激指标MDA、SOD、GSH-Px。
1.2.4 大鼠心肌组织病理学观察 采用HE 染色。末次给药24 h后收集各组大鼠心肌组织,固定48 h,在低熔点石蜡中浸润并包埋制成蜡块,将蜡块里的组织制成切片,使用乙醇展开并放在载玻片上烘干,随后将蜡块脱蜡,HE 染色,乙醇脱水,滴加中性树胶,制作成组织切片,在光学显微镜下察看并拍照。
1.2.5 大鼠心肌组织血管内皮功能指标检测 采用ELISA 法。取各组大鼠心肌组织,采用ELISA 试剂盒检测血管内皮功能指标iNOS、ET-1,所有操作严格按照相应试剂盒说明书步骤进行。
1.3 GA改善HH诱发心肌损伤的体外观察
1.3.1 大鼠心肌细胞分组及模型建立 心肌细胞H9C2 培养于完全培养基中,待细胞培养至融合度70%~80%,取状态良好的细胞,以1 × 105/mL 接种于6孔板内培养,细胞贴壁生长至70%时,分为正常组、模型组、GA 低剂量组、GA 中剂量组、GA 高剂量组。根据前期预实验结果,在GA 低、中、高剂量组分别加入0.075、0.100、0.125 µmol/L 的GA 处理,正常组不做处理正常培养,其余各组均在三气培养箱中(1% O2、5% CO2、92% N2)中培养24 h 构建H9C2心肌细胞低氧损伤模型。
1.3.2 大鼠心肌细胞形态学观察 各组继续培养24 h后,于倒置显微镜下观察细胞形态变化。
1.3.3 大鼠心肌细胞凋亡情况观察 各组继续培养24 h 后取出6 孔板,收集原培养基,预冷PBS 清洗各组细胞并将PBS 与原培养液合并,胰酶消化细胞脱落后,加入收集的原培养基终止消化,收集细胞并以1 000 r/min 离心5 min 弃去上清,2 mL 预冷PBS清洗细胞3 次。清洗完成后弃去上清,每个离心管中加入100 µL 溶液(Buffer∶PBS=1∶9 配制)重悬细胞。准备10 个1.5 mL 的EP 管,3 个正常调剂组,分别为不染色组、5 µL AnnexinV-FITC 单染组、5 µL PI单染组,其余正常组和模型组均加入Annexin VFITC及PI各5 µL混匀后室温下避光染色15 min,染色完成后每管再补加400 µL Bingding Buffer 混匀细胞,尼龙膜过滤后,流式细胞仪检测。重复3 次,计算细胞凋亡率。
1.3.4 大鼠心肌细胞ROS水平检测 采用DCFH-DA荧光探针染色。各组继续培养24 h 后,弃去原培养基,PBS清洗3次,每次5 min。入无血清培养基稀释的活性氧染色(DCFH-DA∶DMEM=1∶1 000)工作液37 ℃避光染色30 min 后,再使用无血清培养基洗涤3次,收集细胞后上流式细胞仪检测。
1.3.5 大鼠心肌细胞凋亡相关蛋白检测 采用Western blotting 法。各组细胞蛋白以RIPA 裂解液研磨后进行离心取上清,并采用BCA 法对蛋白进行定量,再经电泳、转膜、封闭,加入细胞凋亡相关蛋白Bax、Bcl-2、Caspase-3、β-actin 一抗封闭过夜;PBST溶液洗膜,加入相应二抗溶液,使用ECL 成像系统采集图像,并使用Image J 软件分析条带的灰度值。以β-actin 作为内参,以目的条带与对照条带灰度比值作为目的蛋白相对表达量。
1.4 统计学方法 采用Graphpad9.0 统计软件。计量资料正态性分析采用Kolmogorov-Smirnov检验,符合正态分布的资料以表示,组间比较行LSD检验;计数资料以n(%)表示,组间比较行χ2检验。P<0.05为差异有统计学意义。
2 结果
2.1 GA改善HH诱发心肌损伤的体内观察结果
2.1.1 各组大鼠心功能相关指标比较 与正常组比较,HH 模型组及GA 低、中、高剂量组PAAT 均降低,但HH 模型组降低更明显;RPEP 均升高,但HH模型组升高更明显(P均<0.05)。各组大鼠EF、RVET比较差异均无统计学意义(P均>0.05)。见表1。
表1 各组心功能相关指标比较()

表1 各组心功能相关指标比较()
注:与正常组比较,*P<0.05。
?
2.1.2 各组大鼠血清氧化应激指标比较 与正常组比较,HH模型组及GA低、中、高剂量组血清SOD、GSH-Px均降低,但HH模型组降低更明显;血清MDA均升高,但HH模型组升高更明显(P均<0.05)。见表2。
表2 各组血清氧化应激指标比较()

表2 各组血清氧化应激指标比较()
注:与正常组比较,*P<0.05。
?
2.1.3 各组大鼠心肌组织病理学观察结果 正常组心肌纤维排列整齐,结构正常,细胞质呈横纹状,炎症细胞较少,少数心肌细胞水肿,少量红细胞浸润,大部分心肌纤维有一个核,核呈卵圆形。HH 模型组心肌纤维排列松散,可见炎症细胞浸润,部分心肌细胞水肿并有红细胞浸润,高倍显微镜下大部分细胞质横纹不清晰,部分细胞核形态不规则,部分细胞核颜色变浅。与HH 模型组比较,GA 低、中、高剂量组病理组织改变均有改善,且随着药物剂量的增加,心肌纤维排列越来越整齐,炎症细胞逐渐减少,红细胞浸润逐渐减少,细胞排列逐渐紧密,细胞质横纹逐渐清晰。见OSID码图1。
2.1.4 各组大鼠心肌组织血管内皮功能指标比较 与正常组比较,HH 模型组及GA 低、中、高剂量组心肌组织ET-1、iNOS 均升高,但HH 模型组升高更明显(P均<0.05)。见表3。
表3 各组心肌组织血管内皮功能指标比较()
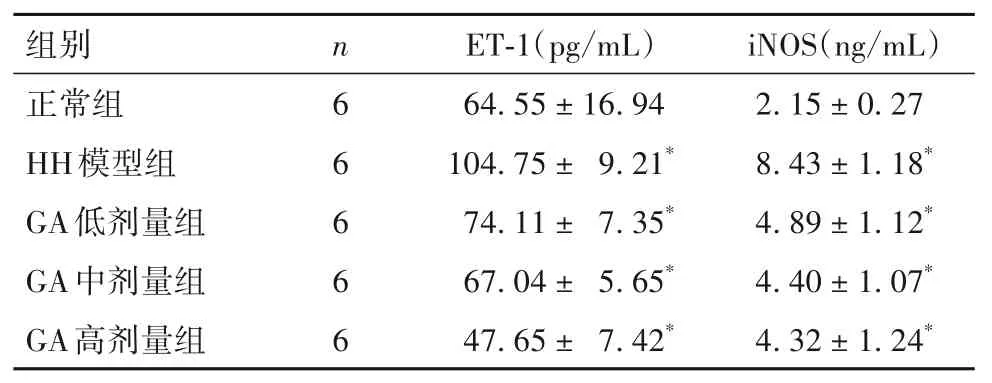
表3 各组心肌组织血管内皮功能指标比较()
注:与正常组比较,*P<0.05。
?
2.2 GA改善HH诱发心肌损伤的体外观察结果
2.2.1 大鼠心肌细胞形态学观察结果 正常组细胞形态正常,排列整齐,呈梭形,细胞边界清晰、大小相同。模型组细胞排列紊乱,呈短梭形,稀疏拉丝,死细胞漂浮,细胞间隙变宽。与模型组比较,GA低、中、高剂量组缺氧条件导致的拉丝情况明显改善,细胞数增加。见OSID码图2。
2.2.2 各组大鼠心肌细胞凋亡率比较 正常组、模型组、GA低剂量组、GA中剂量组、GA高剂量组细胞凋亡率分别为14.08%、53.50%、24.60%、22.85%、19.73%;与正常组比较,模型组及GA低、中、高剂量组心肌细胞凋亡率均升高,但模型组升高更明显(P均<0.05)。
2.2.3 各组大鼠心肌细胞ROS 水平比较 正常组、模型组、GA 低剂量组、GA 中剂量组、GA 高剂量组心肌细胞ROS 分别为22.54 ± 2.48、36.37 ±0.45、34.02 ± 1.07、23.58 ± 0.65、23.93 ± 3.07;与正常组比较,模型组及GA 低、中、高剂量组心肌细胞ROS 均升高,但模型组升高更明显(P均<0.05)。
2.2.4 各组大鼠心肌细胞凋亡相关蛋白比较 与正常组比较,模型组胞Caspase-3、Bax 蛋白表达升高,Bcl-2 蛋白表达降低;与模型组比较,GA 低、中、高剂量组Caspase-3、Bax 蛋白表达降低,Bcl-2 蛋白表达升高(P均<0.05)。见表4。
表4 各组心肌细胞凋亡相关蛋白比较()

表4 各组心肌细胞凋亡相关蛋白比较()
注:与正常组比较,*P<0.05;与模型组比较,#P<0.05。
?
3 讨论
高原缺氧与肺动脉高压密切相关,肺动脉高压会加重右心室负荷,最终导致右心室扩大和右心功能衰竭[5]。分析其机制可能为长期高原缺氧刺激会对心肌造成损伤,从而导致心肌细胞能量代谢紊乱,线粒体结构和功能受损,最终导致心肌细胞的死亡或凋亡。其中心肌细胞凋亡是缺氧引起的心血管系统的重要反应,心肌细胞异常凋亡影响心脏的正常收缩和泵血功能,促进心脏疾病的发生发展[6]。本研究旨在探讨GA 对HH 诱发大鼠心肌损伤的抑制作用及其潜在的治疗机制。有研究表明,GA和环孢素联合应用可保护心肌细胞形态,防止心肌缺血再灌注损伤[7]。GA 还是治疗心肌肥大和心力衰竭的一个有潜力的药物,有研究表明GA 对CaCl2诱发的心律失常具有抑制作用[8]。在本研究中,HH 建模大鼠PAAT 降低、RPEP 升高,心肌组织中可见心肌细胞排列紊乱、心肌间质血管扩张充血,偶见炎症细胞浸润,提示HH 诱发的心肌损伤模型大鼠构建成功。在给予不同剂量GA 药物干预后,大鼠PAAT 升高、RPEP 降低,心肌纤维排列整齐,结构正常,炎症细胞浸润减少,提示GA 可通过改善组织结构对心肌起到保护作用。同时,体外研究结果表明,给予不同剂量GA 药物干预后,大鼠H9C2 细胞形态明显改善,提示GA 可通过抗炎和抗氧化的作用来改善低氧诱发的心肌细胞损伤。
细胞凋亡被认为是心肌损伤的重要机制之一[9]。在心肌细胞凋亡过程中,心肌细胞数量减少,心肌成纤维细胞增生,导致心肌肥厚、收缩力下降,进而发展为心力衰竭[10]。细胞凋亡是一个通过大量基因表达后严格控制的过程,这些基因包括Bcl-2家族、Caspase家族等[11]。作为核心执行蛋白,Caspase-3参与线粒体途径介导的细胞凋亡过程,而裂解的Caspase-3 可以反映其活性。在执行凋亡的蛋白质中,Bax 有促进凋亡的作用,而Bcl-2 有抑制凋亡作用[12]。有研究表明,内皮细胞功能紊乱与心力衰竭的发展密切相关,ET-1及iNOS在心力衰竭等病理生理状态下发挥重要作用[13]。内毒素等刺激可诱导iNOS 的激活,从而促进NO 合成增加,虽然升高的NO 可以拮抗ET-1的作用,但过多的NO 可导致线粒体呼吸功能受损,增加心肌细胞凋亡[14]。另有研究发现,在低氧条件下,细胞会产生氧化应激,进而造成氧化损伤,此时细胞会产生免疫应答,分泌大量炎症因子参与心肌损伤[15],大量炎症因子可引起继发于细胞凋亡的ROS 激活,释放大量的氧自由基并加重心肌组织脂质过氧化及增加MDA 水平,进而诱发细胞死亡[16]。SOD、GSH-Px 等抗氧化酶是抵御氧自由基损伤的第一道防线[17],SOD、GSH-Px 水平下降及MDA 水平升高是反映心肌缺血缺氧程度的重要标志[18]。本研究结果显示,HH 诱发心肌损伤大鼠心肌组织中ET-1、iNOS 水平升高,血清中MDA 水平升高、SOD 及GSH-Px 水平降低,提示HH 所致心肌损伤大鼠发生了心肌重构和氧化应激。给予不同剂量GA 干预后,HH 心肌损伤大鼠组织中ET-1、iNOS水平降低,血清中MDA 水平降低、SOD 及GSH-Px 水平升高,提示GA 可通过改善HH 心肌损伤大鼠的心肌重构并调节氧化应激水平来保护心肌组织。同时,体外研究结果表明,模型组心肌细胞Bcl-2 蛋白表达降低,而Caspase-3、Bax 蛋白表达及ROS 水平、细胞凋亡率升高。在给予不同剂量GA 干预后,心肌细胞Bcl-2 蛋白表达升高,而Caspase-3、Bax 蛋白表达及ROS 水平、细胞凋亡率降低。该结果提示,GA 可能通过抑制细胞凋亡改善低氧诱发的心肌损伤来发挥对心脏的保护作用。
综上所述,GA 在体内外HH 心肌损伤模型中均可抑制心肌损伤,其机制可能与减轻氧化应激、改善内皮功能、减少细胞凋亡有关。GA具有潜在的改善HH 诱发心肌损伤的作用,有望成为治疗心肌疾病的有效方法,但仍需要更多的药理学研究以完善相关机制。
