甲酸对丝素蛋白结晶结构转变的影响
2024-03-07梁苏平何秀萍牛翔宇宁晚娥黄继伟
梁苏平, 何秀萍, 牛翔宇, 宁晚娥, 王 倩, 黄继伟,2
(1.广西科技大学 a.生物与化学工程学院;b.天虹现代纺织产业学院,广西 柳州 545006; 2.苏州大学 纺织与服装工程学院,江苏 苏州 215123)
桑蚕丝素作为一种天然高分子蛋白质,具有优良的生物相容性、可控的生物降解性、无毒和低免疫原性[1],因此它在生物医学工程材料、柔性可穿戴传感器件、食药品及精细化学品等领域具有广泛的应用前景[2]。在这些应用领域中,对丝素蛋白结晶结构的表征与调控是重要的研究内容[3],决定着丝素蛋白再生材料的物理机械性能和生物医学工程应用性能。如将丝素蛋白用作器官移植工程中的基质材料时,要求其具有合适的机械承载能力和生物降解速率,而这些性能与丝素蛋白的结晶结构及结晶度密切相关[4-5]。丝素蛋白材料作为一种半结晶物质,由结晶区和无定形区构成,晶粒的形状、尺寸、排列、取向和拓扑关系是决定丝素蛋白材料物理机械性能的关键因素[6-10]。进一步地,通过调控丝素蛋白材料中的结晶形态或结晶结构参数可实现对其物理机械性能的调控。如通过采用不同的工艺方案调控丝素材料的结晶形态,获得了具有Silk I结晶形态的丝素蛋白材料,进而获得了特定性能或功能的生物组织工程用支架、膜等[11-13]。
丝素蛋白材料的结晶结构与其制备加工方法有关,而不同的溶剂体系所制备的丝素蛋白材料的结晶结构可能存在显著差异[14]。已有研究表明,基于三元溶剂(摩尔比为1∶2∶8的氯化钙、乙醇和水组成的溶剂体系)制备的丝素蛋白初生材料具有水溶性,结晶度较低,但当其经一定浓度乙醇处理后表现为水不溶且结晶度提高,正因如此,乙醇常被用作丝素蛋白结晶促进剂[15]。而基于甲酸溶剂制备的丝素蛋白初生材料则具有高度的Silk Ⅱ结晶结构[16],这表明甲酸亦具有促丝素蛋白结晶的作用。然而,有关甲酸促丝素蛋白结晶的研究却鲜有报道。为了进一步阐明甲酸对丝素蛋白结晶结构的影响及甲酸促丝素蛋白结晶的作用,本文采用α-糜蛋白酶对所得丝素蛋白水溶液进行处理,分离出丝素蛋白的高结晶部分和低结晶部分[17-19]。随后,采用甲酸和乙醇分别对分离得到的高结晶部分和低结晶部分进行处理,以期利用这两种性状截然不同的丝素物质在甲酸或乙醇处理后的结晶结构转变说明甲酸对丝素蛋白的促结晶作用,为进一步利用甲酸调控丝素蛋白结晶结构提供参考。
1 实 验
1.1 材 料
22.22/24.44 dtex桑蚕生丝(广西融安县金鼎制丝有限责任公司),98%甲酸(国药集团化学试剂有限公司),99.5%无水乙醇(成都市科隆化学品有限公司),96%无水氯化钙、99%无水碳酸钠(西陇科学股份有限公司),≥98%氢氧化钠(天津市大茂化学试剂厂),≥40 units/mg α-糜蛋白酶(上海麦克林生化科技有限公司),上述所用化学试剂与药品均为分析纯;3500 Da透析袋(美国Amresco公司)。
1.2 仪 器
BPG-9240A型精密鼓风干燥箱(上海一恒科学仪器有限公司),101-2B型电热恒温干燥箱(佛山市劲申机电设备有限公司),FJS-6型磁力搅拌水浴锅(金坛市城西富威实验仪器厂),AR224CN型电子天平(奥豪斯仪器(常州)有限公司),RS-201型磁力搅拌器(广东窑声电器股份有限公司),H1850R型离心机(湖南湘仪实验室仪器开发有限公司),DDS-307A型电导率仪(上海雷磁仪器有限公司),TF-FD-1型冷冻干燥机(上海田枫实业有限公司),X’Pert Pro型全自动X-射线衍射仪(荷兰PANalytical公司),NicoLET 5700型傅里叶变换红外光谱仪(美国热电公司)。
1.3 方 法
1.3.1 桑蚕生丝的脱胶
采用碱法对桑蚕生丝进行脱胶,具体流程为:取指定质量的桑蚕生丝,置于含有质量分数为0.5%的碳酸钠水溶液中,沸煮30 min,浴比质1∶200,沸煮结束后,用清水清洗3次。以上步骤重复3次,之后将经过脱胶后的蚕丝晾干,备用。
1.3.2 基于氯化钙-甲酸溶剂体系的再生丝素蛋白膜制备
1)将指定质量的无水氯化钙和98%甲酸置于烧杯中,待无水氯化钙完全溶解后即配置得到质量分数为3%的氯化钙-甲酸溶剂。
2)按照丝素蛋白质量分数为8%,计算并称取一定质量的脱胶蚕丝,置于步骤1所制备的质量分数为3%的氯化钙-甲酸溶剂中,再利用磁力搅拌器持续搅拌约4 h,至脱胶蚕丝完全溶解。
3)将完全溶解的丝素-氯化钙-甲酸溶解液均匀平铺于表面平整的培养皿中,并将其放置在通风橱或干燥阴凉通风口处晾干成膜。之后,将干燥膜浸入去离子水以去除膜中的氯化钙和残留的甲酸,每4 h换一次水,总时长72 h,将泡水去盐后的膜晾干,装入密封袋保存,备测。
1.3.3 基于三元溶剂体系的再生丝素蛋白膜制备
1)取一定质量的脱胶蚕丝,将其置于氯化钙-乙醇-水(摩尔比为1∶2∶8)的三元溶剂中溶解,其中浴比1∶10,温度80 ℃,时间2 h。
2)将制备得到的丝素蛋白溶解液置于分子截取量为3500 Da的透析袋中,再置于流动的去离子水中透析,以去除乙醇和氯化钙,透析时间72 h。透析结束后,将溶液置于离心机以去除凝结物,离心机转速8 000 r/min,时间10 min,离心结束后可得到纯净的丝素蛋白水溶液。经测定,所得丝素蛋白水溶液的质量分数约为2%。
3)取30 mL丝素蛋白水溶液均匀平铺于表面平整的培养皿中,置于阴凉通风处晾干成膜,装入密封袋保存,备用。
1.3.4 利用α-糜蛋白酶降解分离丝素蛋白高结晶部分和低结晶部分
1)基于1.3.3获取质量分数为2%丝素蛋白水溶液,采用氢氧化钠溶液调节其pH值至7.8,之后以50 mL为基本量分别置于不同的烧杯中。
2)取一烧杯,加入15 mg的α-糜蛋白酶,并用0.5 mg的去离子水使其溶解,并搅拌均匀。将溶解的α-糜蛋白酶加入之前所准备的盛有丝素蛋白水溶液的烧杯中,搅拌均匀,再置于38 ℃的恒温箱进行酶解,36 h后取出,将烧杯置于100 ℃沸水中水浴20 min使酶失活。
3)将经酶解的丝素蛋白溶液置于离心机以分离上清液和沉淀物,离心机转速8 000 r/min,时间10 min。
4)将所得上清液再次用滤纸过滤后冷冻干燥,将所得物质(本文将其称为“丝素蛋白低结晶部分”),称重,备用。
5)将所得沉淀物用去离子水清洗,再离心,重复3次,每次所用洗涤的水弃去。最后,将最终的沉淀物烘干(本文将其称为“丝素蛋白高结晶部分”),称重,备用。
1.3.5 基于三元溶剂所制备再生丝素蛋白膜的后处理
1)乙醇后处理:取一定质量再生丝素蛋白膜,置于盛有75%乙醇溶液的烧杯中浸泡,烧杯用保鲜膜封口,浸泡时间 24 h,之后取出晾干,备测。
2)甲酸二次溶解:取一定质量再生丝素蛋白膜,将其再溶于98%的甲酸溶液中,之后用磁力搅拌器搅拌约3 h,直至膜完全溶解后,倒入培养皿中铺膜晾干,备测。
3)乙醇处理后甲酸二次溶解:取一定质量步骤1所述得到的经乙醇后处理的再生丝素蛋白膜,再按照步骤2对其进行二次溶解和铺膜晾干,备测。
1.3.6 丝素高结晶部分和低结晶部分的后处理
1)乙醇处理:烧杯中取适量的高结晶部分或低结晶部分,加入75%乙醇后封口置于阴凉处浸泡24 h,之后烘干,备测。
2)甲酸处理:在烧杯中加入高结晶部分或低结晶部分,取适量98%甲酸进行搅拌以使其完全溶解,之后倒入敞口培养皿中,待甲酸挥发,晾干,备测。
1.3.7 X射线衍射测试(XRD)
用剪刀将待测样品剪成粉末状,采用X’Pert-Pro型X射线衍射仪进行测试,X射线光源为Cu-Kα射线,电压40 kV,电流25 mA,扫描速度10°/min,扫描范围5°~50°。
1.3.8 傅里叶变换红外光谱测试(FTIR)
用剪刀将待测样品剪成粉末状,取适量加入至KBr粉末中,充分搅拌研磨后制成压片,采用NicoLET 5700型傅里叶变换红外光谱仪对其进行测试,范围为400~4 000 cm-1,分辨率为4 cm-1,扫描次数为64次。
1.3.9 FTIR和XRD光谱数据的分峰拟合
1)FTIR光谱数据的分峰拟合:将FTIR透过率谱转换为FTIR吸光度谱,截取1 596~1706 cm-1波数内的数据,采用两端点连直线法去除谱图的基线,再采用fityk软件对所得数据进行分峰拟合,峰形采用面积型高斯函数(GaussianA),所有拟合峰函数均采用相同的半高宽。
2)XRD光谱数据的分峰拟合:采用fityk软件执行分峰拟合,峰形采用面积型高斯函数(GaussianA),拟合后按下式计算结晶度。
式中:Xc为结晶度,Sa为无定形拟合峰的积分面积,S为所有拟合峰的面积之和。
2 结果与分析
2.1 不同方式制备再生丝素蛋白膜的结构对比
2.1.1 FTIR分析
图1为不同方式制备再生丝素蛋白膜的FTIR图谱。图1中,a为脱胶蚕丝样品;b为基于氯化钙-甲酸溶剂体系制备的再生丝素蛋白膜样品;c为基于三元溶剂体系制备的再生丝素蛋白膜样品;d为基于三元溶剂体系制备的再生丝素蛋白膜经75%乙醇后处理的样品;e为基于三元溶剂体系制备的再生丝素蛋白膜经98%甲酸二次溶解制膜的样品;f为基于三元溶剂体系制备的再生丝素蛋白膜先经75%乙醇后处理再经98%甲酸二次溶解制膜的样品。
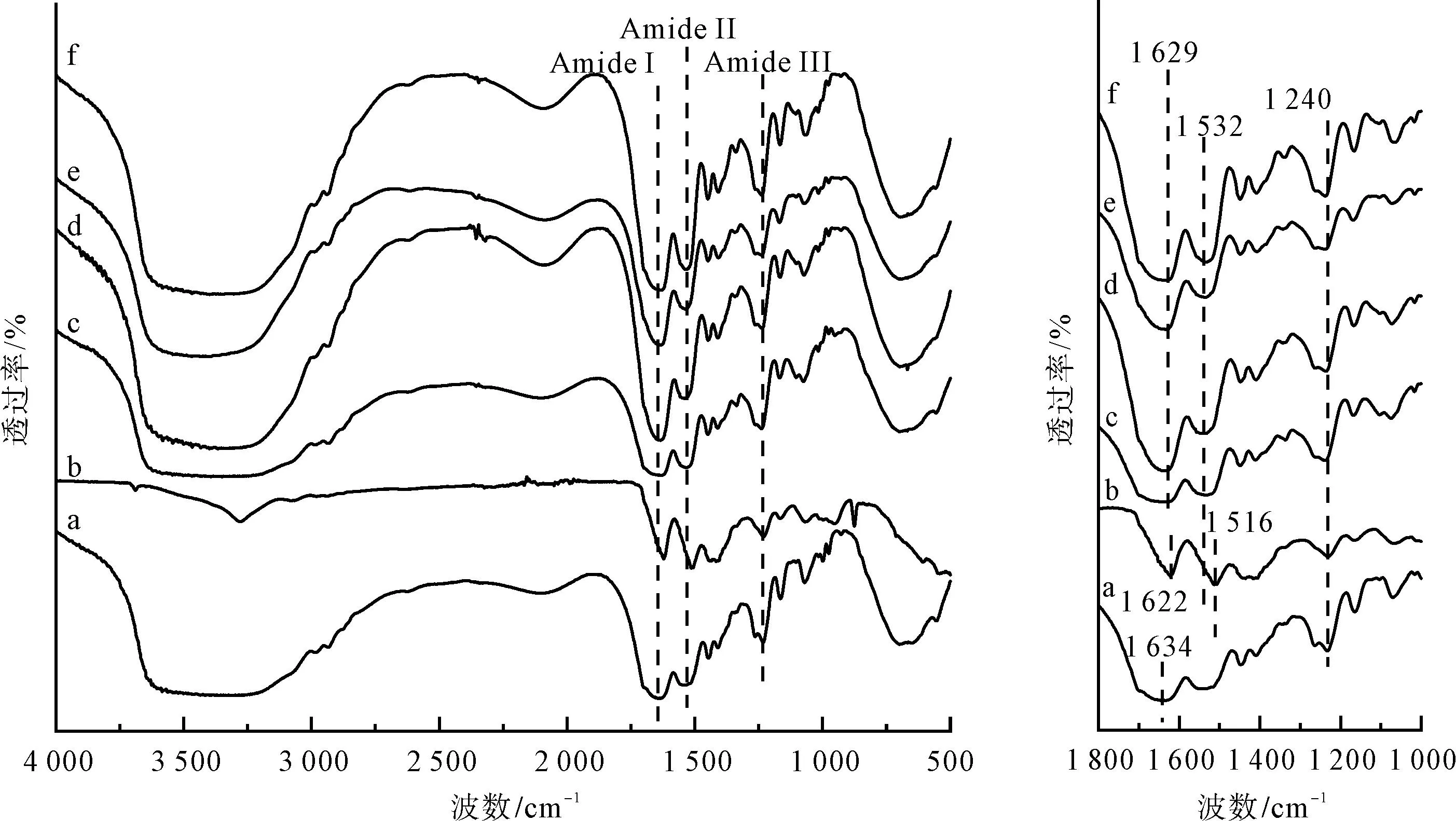
图1 不同方式制备再生丝素蛋白膜的FTIR图谱Fig.1 FTIR spectra of regenerated silk fibroin films prepared via different methods

由图1可看出,相对于脱胶蚕丝(样品a),基于氯化钙-甲酸溶剂体系制备的再生丝素蛋白膜(样品b)在酰胺I区和酰胺II区均出现明显的红移,其峰位出现在1 622 cm-1和1 516 cm-1附近,且峰形较尖锐,这说明基于氯化钙-甲酸溶剂体系制备的再生丝素蛋白膜具有高度的β折叠结构;基于三元溶剂体系制备的再生丝素蛋白膜(样品c)的酰胺I区相对较为扁平;基于三元溶剂体系制备的再生丝素蛋白膜经75%乙醇处理后(样品d)、经98%甲酸二次溶解制膜(样品e)和先经75%乙醇后处理再经98%甲酸二次溶解制膜(样品f)的酰胺I区的峰位略有偏移,从1 634 cm-1偏至1 629 cm-1,这说明丝素蛋白膜中β折叠结构含量提高。
上述直观分析可知,不同方式制备再生丝素蛋白膜具有不同的二级结构含量。为了量化各样品中二级结构的含量,本文对各样品酰胺I区进行分峰拟合[21-23],拟合图谱如图2所示,分析结果如表1所示。
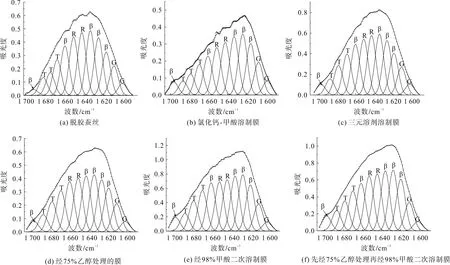
图2 不同方式制备再生丝素蛋白膜酰胺I区的分峰拟合Fig.2 Peak fitting of Amide I of regenerated silk fibroin films prepared via different methods
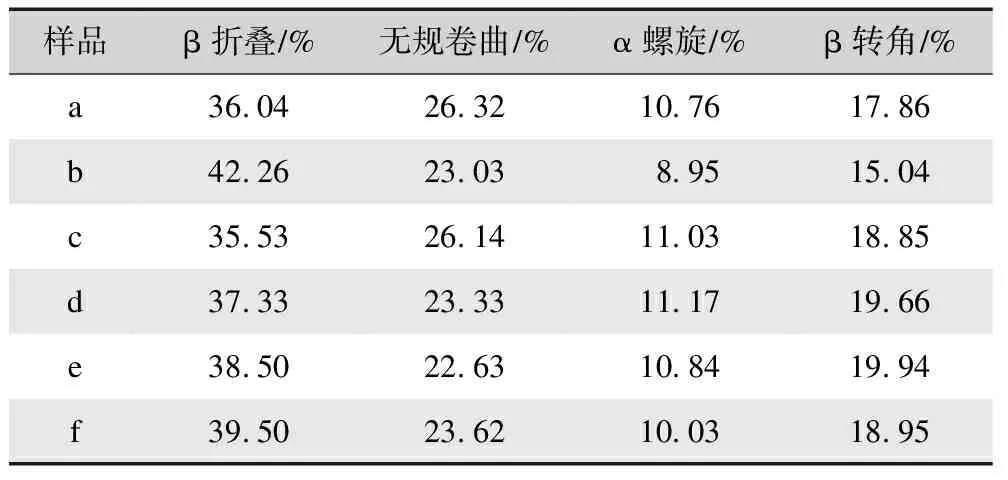
表1 不同方式制备再生丝素蛋白膜的二级结构含量分析Tab.1 Analysis of the secondary structure content of regenerated silk fibroin films prepared via different methods
由表1分析结果可知,基于氯化钙-甲酸溶剂体系制备的再生丝素蛋白膜(样品b)的β折叠含量最高,达到42.26%;其次是基于三元溶剂体系制备的再生丝素蛋白膜经98%甲酸二次溶解制膜(样品e)和先经75%乙醇后处理再经98%甲酸二次溶解制膜,其β折叠含量分别为38.5%和39.5%;最后是基于三元溶剂体系制备的再生丝素蛋白膜(样品c)及其经75%的乙醇后处理膜。这一结果说明甲酸具有更明显的促结晶作用。
2.1.2 XRD分析
图3为不同方式制备再生丝素蛋白膜的XRD图谱。其中,样品标示(a, b, c, d, e, f)的含义与图1相同。

图3 不同方式制备再生丝素蛋白膜的XRD图谱Fig.3 XRD spectra of regenerated silk fibroin films prepared via different methods
由图3可以看出,脱胶蚕丝(样品a)、氯化钙-甲酸溶剂体系制备的再生丝素蛋白膜(样品b)、三元溶剂体系制备的再生丝素蛋白膜经98%甲酸二次溶解制膜(样品e)和三元溶剂体系制备的再生丝素蛋白膜先经75%乙醇后处理再经98%甲酸二次溶解制膜(样品f),均在9.6°(弱)、20.7°(强)、24.6°(强)、39.9°(弱)和44.1°(弱)处存在明显的衍射峰,说明脱胶蚕丝具有高度的Silk II结晶结构[24]。然而基于三元溶剂体系制备的再生丝素蛋白膜(样品c)则仅在12.3°和19.8°处存在峰,这说明其以无定形结构为主,可能存在部分Silk I结晶。基于三元溶剂体系制备的再生丝素蛋白膜75%乙醇后处理后(样品d),除了12.3°处的峰外,其峰位与脱胶蚕丝相似。
针对各样品的XRD图谱进行分峰拟合,结果如图4所示。根据拟合图谱分别计算各样品的结晶度[25-28],结果如表2所示。

图4 不同方式制备再生丝素蛋白膜XRD谱的分峰拟合Fig.4 Peak fitting of XRD spectrum of regenerated silk fibroin films prepared via different methods
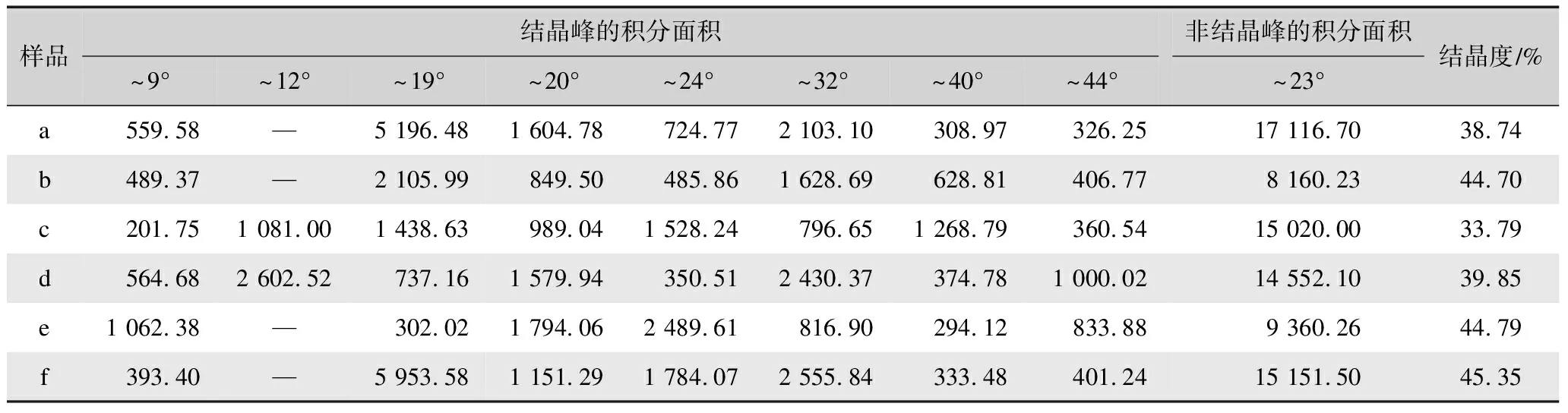
表2 不同方式制备再生丝素蛋白膜XRD谱的分峰拟合面积汇总与结晶度Tab.2 Fitting peak area and crystallinity of XRD spectrum of regenerated silk fibroin films prepared via different methods
由表2可知,脱胶蚕丝(样品a)的分峰拟合计算结晶度为38.74%,基于氯化钙-甲酸溶剂体系制备的再生丝素蛋白膜(样品b)、三元溶剂体系制备的再生丝素蛋白膜经98%甲酸二次溶解制膜(样品e)和三元溶剂体系制备的再生丝素蛋白膜先经75%乙醇后处理再经98%甲酸二次溶解制膜(样品f)的分峰拟合计算结晶度45%左右,而基于三元溶剂体系制备的再生丝素蛋白膜(样品c)和基于三元溶剂体系制备的再生丝素蛋白膜75%乙醇后处理后(样品d)的结晶度较低,分别为33.79%和39.85%。这与FTIR的结果基本一致,进一步说明甲酸具有更明显的促结晶作用。
2.2 α-糜蛋白酶对丝素蛋白高结晶部分和低结晶部 分的分离
基于1.3.4所述的方法,将丝素蛋白分离为丝素蛋白高结晶部分和低结晶部分。依据所得干燥固体产物的质量可估算两者的比例[17],如表3所示。
由表3可见,通过α-糜蛋白酶将丝素蛋白分离为丝素蛋白高结晶部分和低结晶部分的比例为57.75%±0.12%,这与梅士英等[17]的研究基本一致。

表3 丝素蛋白经α-糜蛋白酶降解后的分级物产率及其比例Tab.3 Yields of graded products and their proportions after degradation of fibroin proteins by α-chymotrypsin
2.2.1 丝素蛋白高结晶部分的乙醇或甲酸处理对其结晶结 构的影响
图5为丝素蛋白高结晶部分及其分别经乙醇或甲酸处理后的FTIR图谱。图5中,g为丝素蛋白高结晶部分的样品,h为丝素蛋白高结晶部分经乙醇处理的样品,i为丝素蛋白高结晶部分经甲酸处理的样品。
由图5可见,丝素蛋白高结晶部分(样品g)在酰胺I区的1 626 cm-1处、酰胺Ⅱ区的1 530 cm-1处和酰胺Ⅲ区的 1 235 cm-1处均存在尖峰,这说明其具有高度的β-sheet构象;对丝素蛋白高结晶部分分别进行乙醇或甲酸处理后,其酰胺I区、酰胺Ⅱ区和酰胺Ⅲ区的峰位并未见显著的变化,但曲线的尖锐程度略有下降,这说明丝素蛋白高结晶部分经乙醇或甲酸处理后,其β折叠构象含量出现了下降。
针对图5各样品FTIR谱的酰胺I区分别执行分峰拟合,如图6所示。各样品的二级结构含量分析如表4所示。
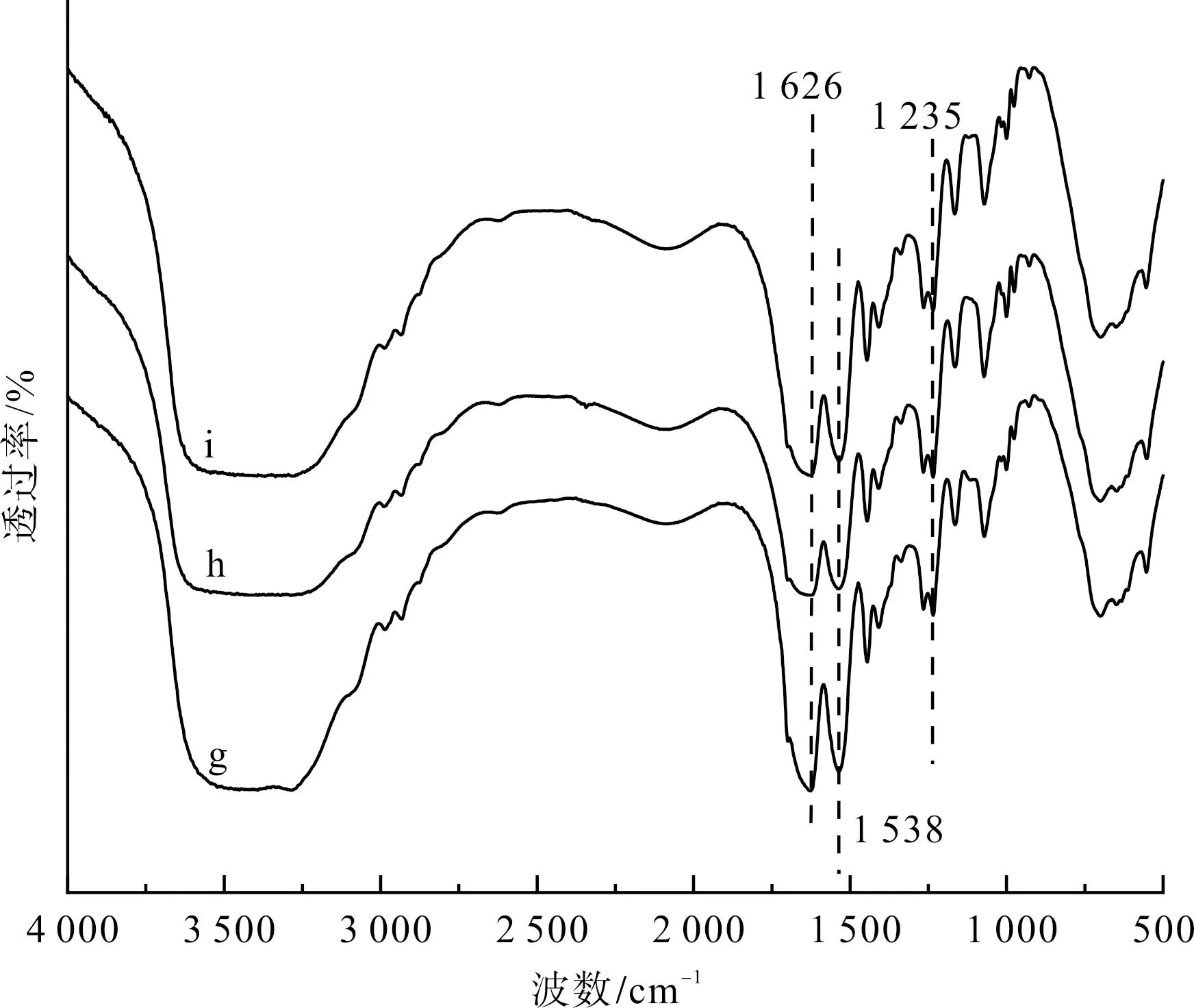
图5 丝素蛋白高结晶部分及其分别经乙醇或甲酸 处理后的FTIR图谱Fig.5 FTIR spectrum of the high-crystalline parts of fibroin protein and its treatment with ethanol or formic acid respectively

图6 丝素蛋白高结晶部分及其分别经乙醇或甲酸处理后所得FTIR谱酰胺I区的分峰拟合Fig.6 Peak fitting to amide I of FTIR spectrum of the high-crystalline parts of fibroin protein and its treatment with ethanol or formic acid respectively
由表4可知,丝素蛋白高结晶部分(样品g)具有高度的β折叠结构,其β折叠含量达到46.35%,远高于脱胶蚕丝(样品a)的36.04%。相对于丝素蛋白高结晶部分(样品g),丝素蛋白高结晶部分经乙醇处理后(样品h),其β折叠含量仅下降了1.64%,而丝素蛋白高结晶部分经甲酸处理后(样品i)的β折叠含量却下降了7%。这说明甲酸处理丝素蛋白高结晶部分时,对其β折叠结构存在破坏作用,且在干燥过程中被破坏的β折叠结构并未完全恢复。
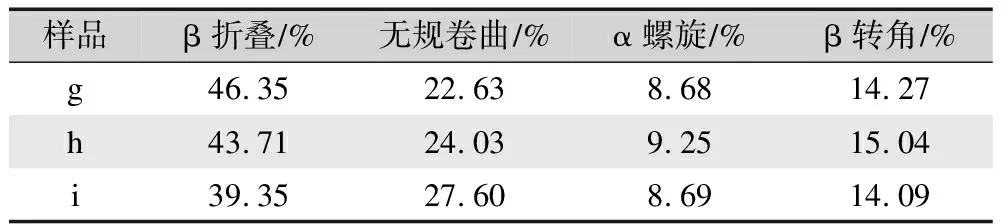
表4 丝素蛋白高结晶部分及其分别经乙醇或甲酸处理后的 二级结构含量分析Tab.4 Analysis of the secondary structure content of the high-crystalline parts of fibroin protein and its treatment with ethanol or formic acid respectively
图7为丝素蛋白高结晶部分及其分别经乙醇或甲酸处理后的XRD图谱。图7中,样品标示(g, h, i)的含义与图5相同。
由图7可见,丝素蛋白高结晶部分(样品g)在9.8°、12.8°、19.45°、20.8°、24.6°、29.5°、32.5°、40.11°和43.9°附近存在衍射峰,其中12.8°、19.45°、29.5°和32.5°归属于Silk I结构,而9.8°、20.8°、24.6°、40.11°和43.9°归属于Silk Ⅱ结构。相对于丝素蛋白高结晶部分(样品g),对丝素蛋白高结晶部分分别进行乙醇处理(样品h)和甲酸处理(样品i)后,其主衍射峰19.15°和20.75°处的强度出现了下降,29.5°和32.5°处的峰强显著减弱,12.8°处的峰位偏移至11.9°,尤其是丝素蛋白高结晶部分经甲酸处理(样品i)后,这种趋势更加明显。这或许可说明:与乙醇后处理不同,甲酸破坏了丝素蛋白高结晶部分中的Silk I结构,而仅利于丝素蛋白Silk Ⅱ结构的再生。
针对图7各样品的XRD谱分别执行分峰拟合,如图8所示。各拟合峰面积汇总与结晶度如表5所示。
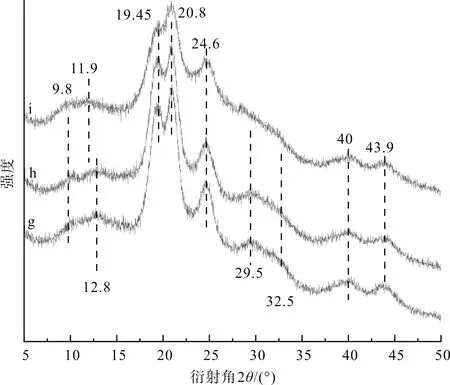
图7 丝素蛋白高结晶部分及其分别经乙醇或甲酸 处理后的XRD图谱Fig.7 XRD spectrum of the high-crystalline parts of fibroin protein and its treatment with ethanol or formic acid respectively

图8 丝素蛋白高结晶部分及其分别经乙醇或甲酸处理后所得XRD谱的分峰拟合Fig.8 Peak fitting to XRD spectrum of the high-crystalline parts of fibroin protein and its treatment with ethanol or formic acid respectively
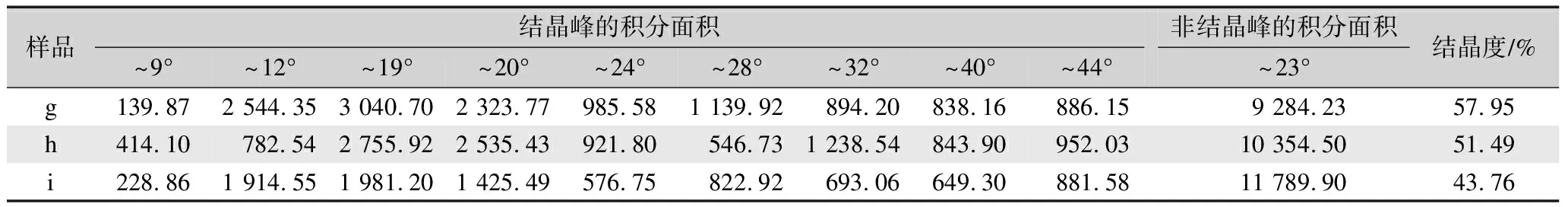
表5 丝素蛋白高结晶部分及其分别经乙醇或甲酸处理后所得XRD谱的拟合峰面积汇总与结晶度Tab.5 Fitting peak area and crystallinity of XRD spectrum of the high-crystalline parts of fibroin protein and its treatment with ethanol or formic acid respectively
由表5可知,丝素蛋白高结晶部分(样品g)的分峰拟合计算结晶度为57.95%,对丝素蛋白的高结晶部分分别进行乙醇处理(样品h)和甲酸处理(样品i)后,其结晶度出现了不同程度的下降,尤其是甲酸处理后(样品i),其分峰拟合计算结晶度相对于丝素蛋白高结晶部分(样品g)下降了14.19%。这进一步印证了FTIR分析的结果,即甲酸处理破坏了丝素蛋白高结晶部分的β折叠结果,使其结晶度下降。
2.2.2 丝素蛋白低结晶部分的乙醇或甲酸处理对其结晶结 构的影响
图9为丝素蛋白低结晶部分及其分别经乙醇或甲酸处理后的FTIR图谱。图9中,j为丝素蛋白低结晶部分的样品,k为丝素蛋白低结晶部分经乙醇处理的样品,l为丝素蛋白低结晶部分经甲酸处理的样品。
由图9可见,丝素蛋白低结晶部分在酰胺I区的峰位于1 652 cm-1处,归属于无规卷曲构象,酰胺II区的峰位于1 553 cm-1处,同样归属于无规卷曲构象;丝素蛋白低结晶部分分别经乙醇或甲酸处理后,两者的酰胺I区峰位于1 626 cm-1处,酰胺Ⅱ区的峰位于1 542 cm-1处,此两处的峰均归属于β折叠构象[20]。这说明乙醇或甲酸处理均可使丝素蛋白低结晶部分从无规卷曲构象转变为β折叠构象。
针对图9各样品FTIR谱的酰胺I区分别执行分峰拟合,如图10所示。各样品的二级结构含量分析如表6所示。

图9 丝素蛋白低结晶部分及其分别经乙醇或甲酸处理后的FTIR图谱Fig.9 FTIR spectrum of the low-crystalline parts of fibroin protein and its treatment with ethanol or formic acid respectively

图10 丝素蛋白低结晶部分及其分别经乙醇或甲酸处理后所得FTIR谱酰胺I区的分峰拟合Fig.10 Peak fitting to amide I of FTIR spectrum of the low-crystalline parts of fibroin protein and its treatment with ethanol or formic acid respectively

表6 丝素蛋白低结晶部分及其分别经乙醇或甲酸处理后的 二级结构含量分析Tab.6 Analysis of the secondary structure content of the low-crystalline parts of fibroin protein and its treatment with ethanol or formic acid respectively
由表6可知,丝素蛋白低结晶部分(样品j)的β折叠含量仅有19.17%,其β转角含量高达33.71%;相对而言,丝素蛋白低结晶部分经乙醇处理后(样品k)的β折叠含量增加至29.23%,相应地,其无规卷曲含量和β转角含量分别下降了2.67%和6.62%;丝素蛋白低结晶部分经甲酸处理后(样品l)的β折叠含量为32.81%,相对丝素蛋白低结晶部分(样品j)增加了13.64%,同样地,其无规卷曲含量和β转角含量分别下降了6.3%和5.12%。这些量化结果说明:对于丝素蛋白低结晶部分,乙醇或甲酸处理可使其无规卷曲和β转角构象转变为β折叠构象,且甲酸的促转变能力显著高于乙醇。
图11为丝素蛋白低结晶部分及其分别经乙醇或甲酸处理后的XRD图谱。图11中,样品标示(j,k,l)的含义与图9相同。
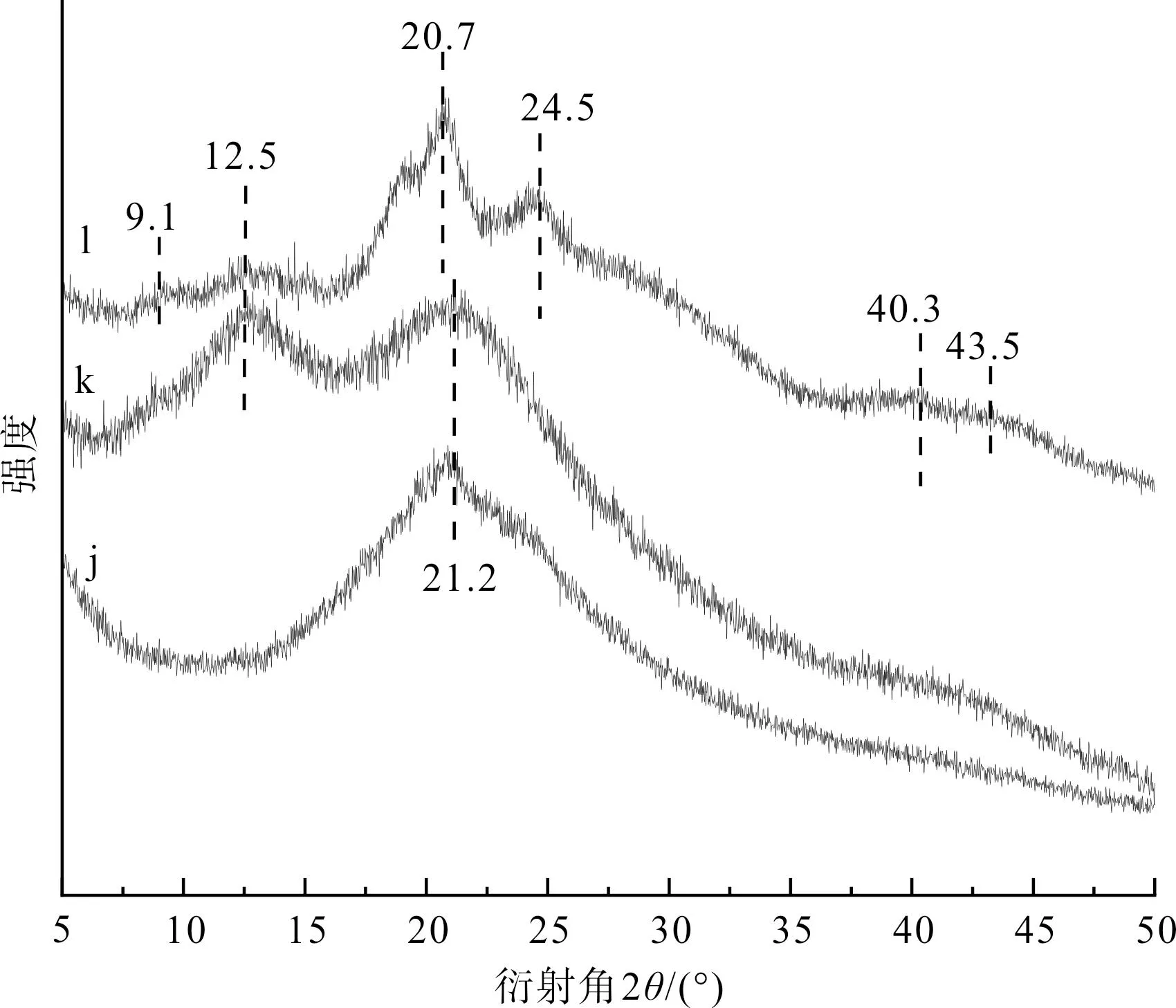
图11 丝素蛋白低结晶部分及其分别经乙醇或甲酸 处理后的XRD图谱Fig.11 XRD spectrum of the low-crystalline parts of fibroin protein and its treatment with ethanol or formic acid respectively
由图11可见,丝素蛋白低结晶部分(样品j)仅在21.2°处出现衍射峰;丝素蛋白低结晶部分经乙醇处理后(样品k),在12.5°和20.7°处出现了衍射峰;丝素蛋白低结晶部分经甲酸处理后(样品l),则在9.1°、12.5°、20.7°、24.5°、40.3°和43.5°附近均出现了衍射峰。这些结果表明:对于丝素蛋白低结晶部分,甲酸具有比乙醇更显著的促结晶能力。
针对图11各样品的XRD谱分别执行分峰拟合,如图12所示。各拟合峰面积汇总与结晶度如表7所示。
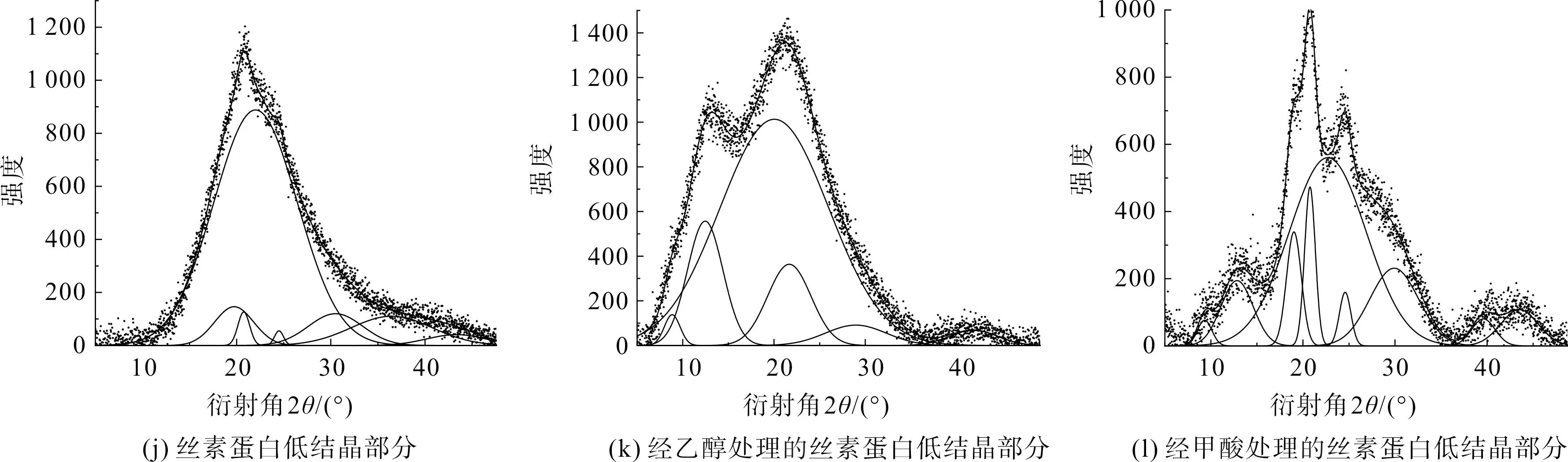
图12 丝素蛋白低结晶部分及其分别经乙醇或甲酸处理后所得XRD谱的分峰拟合Fig.12 Peak fitting to XRD spectrum of the low-crystalline parts of fibroin protein and its treatment with ethanol or formic acid respectively
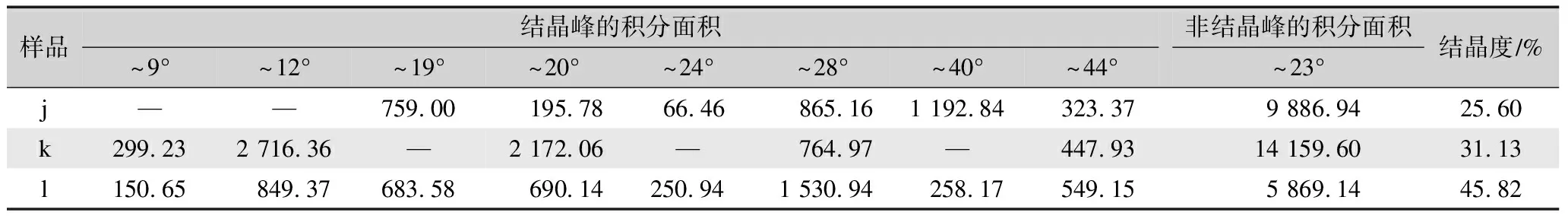
表7 丝素蛋白低结晶部分及其分别经乙醇或甲酸处理后所得XRD谱的拟合峰面积汇总与结晶度Tab.7 Fitting peak area and crystallinity of XRD spectrum of the low-crystalline parts of fibroin protein and its treatment with ethanol or formic acid respectively
由表7可知,丝素蛋白低结晶部分(样品j)的分峰拟合计算结晶度仅有25.6%,相对而言,丝素蛋白低结晶部分经乙醇处理后(样品k)的分峰拟合计算结晶度提高了5.7%,而丝素蛋白低结晶部分经甲酸处理后(样品l)的分峰拟合计算结晶度达到45.82%,提高了20.22%。这些结果进一步地验证了:对于丝素蛋白低结晶部分,甲酸具有比乙醇更显著的促结晶能力。
3 结 论
甲酸作为一种蚕丝的优良溶剂,所制备的丝素蛋白再生材料具有优异的性能,这可能与其具有促丝素蛋白结晶的作用有关。为此,本文首先对比分析了基于氯化钙-甲酸溶剂体系制备丝素蛋白再生膜与基于三元溶剂体系制备丝素蛋白再生膜的结构差异。然后,利用α-糜蛋白酶对基于三元溶剂体系制备的丝素蛋白水溶液进行处理,获得丝素蛋白的高结晶部分和低结晶部分。进一步地,对分离所得的丝素蛋白高结晶部分和低结晶部分分别进行乙醇和甲酸处理,进而借助FTIR和XRD分析了它们的结晶结构转变。结果表明:
1)相对于基于三元溶剂体系制备丝素蛋白再生膜,基于氯化钙-甲酸溶剂体系制备丝素蛋白再生膜中具有更高的β折叠含量,结晶度更高。
2)对于丝素蛋白高结晶部分,乙醇处理并不破坏其Silk I结晶结构,结晶度更高,而甲酸处理可破坏其结晶结构,且其Silk I结晶结构并未完全恢复,致使其结晶度显著下降。
3)对于丝素蛋白低结晶部分,甲酸处理表现出了更加显著的促结晶作用,可使丝素蛋白低结晶部分的结晶结构再生,而乙醇处理的促结晶作用较弱。
通过研究可知,甲酸不仅在溶解丝素蛋白材料时具有破坏其结晶结构的能力,而在基于甲酸溶剂的溶解液的干燥过程中还具有促使丝素蛋白结晶的能力,且这种能力以使丝素蛋白向Silk Ⅱ转变为主。

