静息心率对超高危动脉粥样硬化性心血管疾病患者全因死亡风险的影响
2024-03-07刘士贺韩旭刘倩刘红敏赵海燕陈朔华吴寿岭吴云涛
刘士贺 韩旭 刘倩 刘红敏 赵海燕 陈朔华 吴寿岭 吴云涛
目的:探讨静息心率对超高危动脉粥样硬化性心血管疾病(ASCVD)患者全因死亡风险的影响。
方法:从2006~2020年开滦研究队列中纳入3 645例超高危ASCVD[采用《中国血脂管理指南(2023年)》中的定义]患者,排除602 例静息心率数据缺失者后,最终分析纳入3 043 例患者,根据确诊ASCVD 后首次健康体检时的静息心率四分位水平,将其分为<68 次/min 组(n=744)、68~74 次/min 组(n=786)、75~80 次/min 组(n=760)、≥81 次/min组(n=753)。采用Cox 比例风险回归模型比较不同静息心率水平及静息心率每升高10 次/min 对全因死亡风险的影响。采用限制性立方样条回归模型探讨静息心率与全因死亡风险之间的剂量-反应关系。采用寿命表法计算四组患者中的累积全因死亡率,并通过log-rank 检验进行比较。
结果:中位随访5.81(3.46,9.64)年期间,772 例(25.37%)患者死亡。控制主要混杂因素后,分析结果显示:与静息心率<68 次/min 组患者相比,75~80 次/min 组、≥81 次/min 组患者的全因死亡风险分别增加24%(HR=1.24,95%CI:1.01~1.52,P=0.047)和47%(HR=1.47,95%CI:1.20~1.81,P<0.001),而68~74 次/min 组患者的全因死亡风险差异无统计学意义(HR=1.06,95%CI:0.86~1.31,P=0.625)。此外,静息心率每升高10 次/min,全因死亡风险增加13%(HR=1.13,95%CI:1.07~1.19,P<0.001)。分层分析显示,静息心率每升高10 次/min 时,女性患者的全因死亡风险高于男性患者,<65 岁患者的全因死亡风险高于≥65 岁患者。限制性立方样条分析也显示,静息心率与全因死亡风险呈线性关联(Poverall<0.001,Pnon-linear=0.933),且静息心率>70 次/min 时全因死亡风险显著增加。
结论:静息心率升高与超高危ASCVD 患者全因死亡风险增加相关,且二者呈线性关联。超高危ASCVD 患者静息心率的合适干预切点可能为>75 次/min。
动脉粥样硬化性心血管疾病(ASCVD)是我国人群的首要死亡原因[1]。不同的ASCVD 患者由于心血管危险因素的数目、水平及相关疾病不同,其结局也不同[2]。2020年中华医学会心血管病学分会提出了超高危ASCVD 的概念,将其定义为发生过≥2次严重ASCVD 事件或发生过1 次严重ASCVD 事件且合并≥2 个高危险因素[3]。研究发现,与极高危患者相比,超高危ASCVD 患者的动脉粥样硬化疾病更重,更易复发和死亡[4-5]。证据表明,高脂血症、高血压、高血糖、吸烟等因素与超高危ASCVD 患者的全因死亡风险密切相关[6]。
现有证据表明,在ASCVD 一级和二级预防中,降低静息心率与全因死亡风险降低相关[7-9]。当前指南或共识建议:高血压患者的静息心率控制目标为60~79 次/min,干预切点为>80 次/min[10];心力衰竭患者或冠心病合并缺血性脑卒中患者的静息心率控制目标为60 次/min[11-12];冠心病患者的静息心率合适水平为55~60 次/min,干预切点为>80 次/min[13]。然而,超高危ASCVD 患者的静息心率控制目标及干预切点尚不明确,而且评估ASCVD 患者静息心率与全因死亡风险的相关性研究多采用出院或入院时静息心率[14-15],忽略了患者出院后由于依从性等原因导致长期静息心率与住院时心率存在差异,而发生ASCVD 后健康体检时的静息心率更能反映患者出院后的长期静息心率水平。
本研究基于开滦研究(注册号:ChiCTR-TNRC-11001489),探讨随访期间静息心率与超高危ASCVD 患者全因死亡风险之间的关联,为超高危ASCVD 患者的管理提供参考。
1 资料与方法
1.1 研究对象
本研究依托于开滦研究,从2006~2007年参与第一次健康体检、此后每两年接受一次随访的开滦集团在职及离退休员工中选择2006~2020年随访期间的超高危ASCVD 患者3 645 例作为观察对象,随访内容包括静息心率、全因死亡事件,其中全因死亡事件为每年随访一次。排除静息心率数据缺失者602 例后,最终分析纳入3 043 例超高危ASCVD患者,根据确诊ASCVD 后首次健康体检时的静息心率四分位水平将其分为<68 次/min 组(n=744)、68~74 次/min 组(n=786)、75~80 次/min 组(n=760)、≥81 次/min 组(n=753)。所有研究对象同意参加开滦研究并签署知情同意书。本研究已通过开滦总医院伦理委员会批准([2006]医伦字5 号)。
1.2 资料收集
静息心率检测:确诊ASCVD 后首次健康体检当日行12 导联心电图检查。检查前停止运动、交谈,并排空膀胱,安静环境下至少休息15 min,记录平卧位12 导联心电图,选择Ⅱ导联连续描记5 个以上QRS 波群,计算平均RR 间期得出静息心率,如有心房颤动等异常心电节律,记录1 min 内RR 间期的平均值,并据此计算静息心率[16-17]。
生化指标检测:包括空腹血糖、总胆固醇、甘油三酯、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、尿酸、 高敏C 反应蛋白(hs-CRP)等。
人体测量学指标检测:测量身高、体重,并计算体重指数[体重(kg)/身高(m)2]。
其他资料:吸烟、饮酒、体育锻炼情况、受教育程度、高血压病史、糖尿病病史等情况通过统一的标准化问卷进行收集;服用降压、降糖、降脂药物等信息来源于开滦总医院及其附属医院的慢性病报销数据(自2010年开始收集)。
超高危ASCVD 和全因死亡事件的确定:根据《中国血脂管理指南(2023年)》,超高危ASCVD 定义为发生过≥2 次严重ASCVD 事件或发生过1 次严重ASCVD 事件且合并≥2 个高危险因素[18]。严重ASCVD 事件:心肌梗死或缺血性脑卒中(本研究缺乏家族性高胆固醇血症病史、近期急性冠状动脉综合征病史及周围血管疾病信息)。高危险因素:(1)早发冠心病(男性<55 岁、女性<65 岁);(2)基线LDL-C ≥4.9 mmol/L;(3)既往冠状动脉旁路移植术或经皮冠状动脉介入治疗史;(4)糖尿病;(5)高血压;(6)慢性肾脏病3~4 期;(7)吸烟;(8)LDL-C<1.8 mmol/L,再次发生严重ASCVD 事件(本研究缺乏家族性高胆固醇血症信息)。以严重ASCVD 事件后首次体检为随访起点,以全因死亡或随访结束(2022年12月31日)为随访终点。
1.3 相关定义
高血压:收缩压≥140 mmHg(1 mmHg=0.133 kPa)和(或)舒张压≥90 mmHg,或收缩压<140 mmHg 及舒张压<90 mmHg 但使用降压药物或有高血压病史[19]。糖尿病:空腹血糖≥7.0 mmol/L,或虽然空腹血糖<7.0 mmol/L 但使用降糖药物或有糖尿病病史[20]。吸烟:有吸烟史或当前吸烟。饮酒:有饮酒史或当前饮酒。体育锻炼:锻炼次数≥3 次/周,每次持续时间≥30 min。
1.4 统计学方法
采用SAS 9.4 统计学软件进行数据分析。正态分布的计量资料以±s表示,组间比较采用单因素方差分析;偏态分布的计量资料采用M(Q1,Q3)表示,组间比较采用Kruskal-Wallis 非参数检验;计数资料采用例(%)表示,组间比较采用χ2检验。采用Cox 比例风险回归模型分析不同静息心率水平及静息心率每升高10 次/min 对全因死亡风险的影响。将分组变量作为连续性变量代入Cox 比例风险回归模型进行趋势性检验。采用限制性立方样条回归模型探讨静息心率与全因死亡风险之间的剂量-反应关系。采用寿命表法计算不同分组中的累积全因死亡率,并通过log-rank 检验进行比较。为了验证结果的稳健性,本研究还分别排除随访时间<1年者、有肿瘤病史者、有心房颤动病史者以及根据静息心率不同分位分组后,进行了敏感性分析。P<0.05(双侧检验)为差异有统计学意义。
2 结果
2.1 研究对象的基线特征(表1)
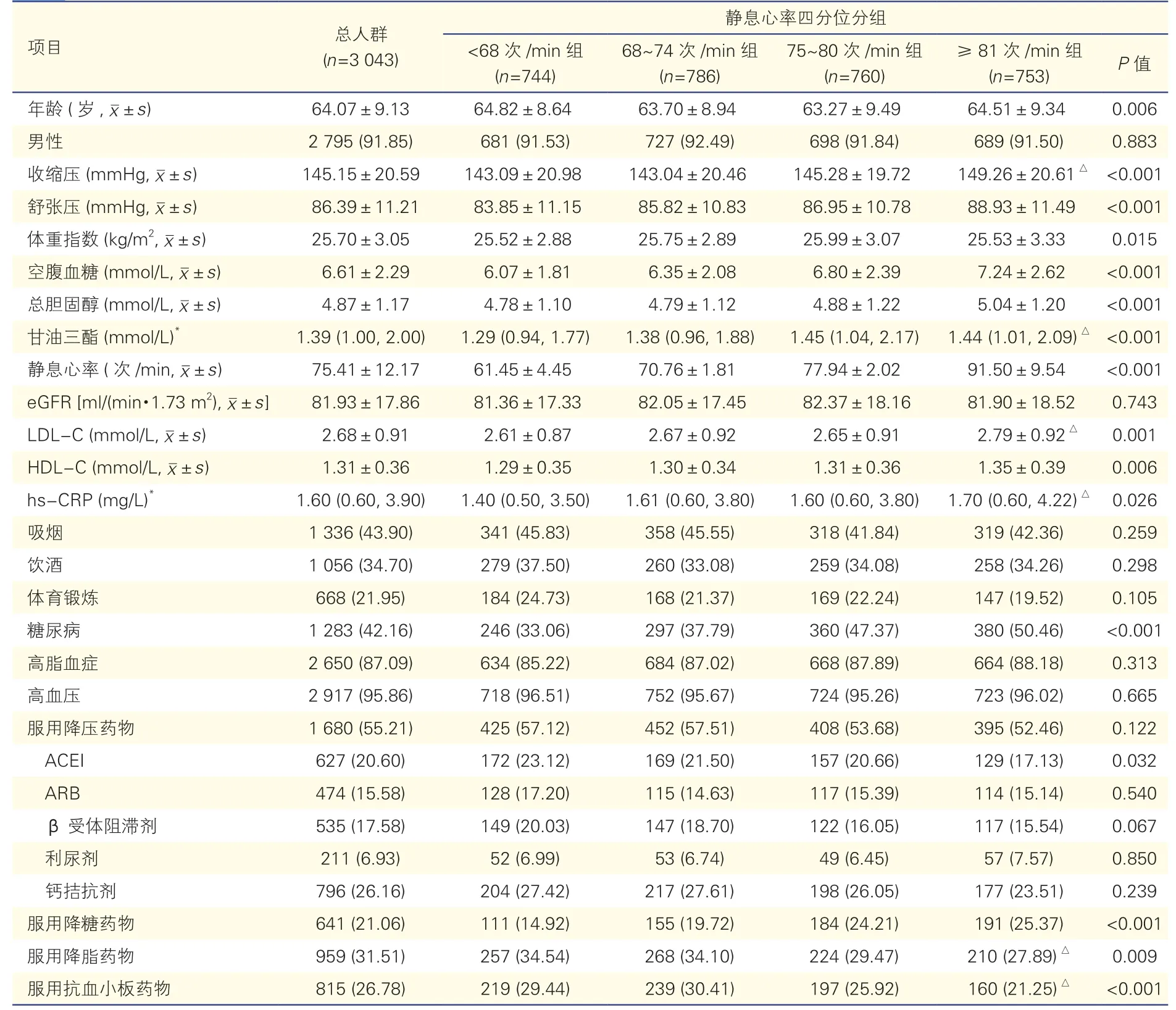
表1 研究对象的基线特征[例(%)]
在最终纳入的3 043 例超高危ASCVD 患者中,男性2 795 例(91.85%),平均年龄(64.07±9.13)岁,平均静息心率(75.41±12.17)次/min。
随着静息心率升高,四组患者的舒张压、空腹血糖、总胆固醇、HDL-C、糖尿病患者比例、服用降糖药物的患者比例均逐渐升高(P均<0.01)。与静息心率<68 次/min 组患者相比,≥81 次/min 组患者的收缩压、甘油三酯、LDL-C、hs-CRP 均较高,但服用降脂药物和抗血小板药物的患者比例均较低,以上差异均有统计学意义(P均<0.01)。
2.2 四组的全因死亡发生密度及累积全因死亡率
中位随访5.81(3.46,9.64)年期间,共772例(25.37%)患者全因死亡,全因死亡的发生密度为37.89/千人年。四组的全因死亡发生密度分别为32.18/ 千人年、33.05/ 千人年、39.04/ 千人年、49.37/千人年,累积全因死亡率分别为41.80%、42.06%、47.85%、53.05%。log-rank 检验显示,四组的累积全因死亡率差异有统计学意义(χ2=26.79,P<0.001),见图1。

图1 四组的累积全因死亡率曲线
2.3 静息心率对超高危ASCVD 患者全因死亡风险的影响
校正性别、年龄、吸烟、饮酒、体育锻炼、体重指数、HDL-C、LDL-C、hs-CRP、甘油三酯、高血压、糖尿病后,Cox 回归分析显示:与静息心率<68 次/min 组患者相比,75~80 次/min 组及≥81 次/min 组患者的全因死亡风险分别增加24%(HR=1.24,95%CI:1.01~1.52,P=0.047)和47%(HR=1.47,95%CI:1.20~1.81,P<0.001),而68~74次/min 组患者的全因死亡风险差异无统计学意义(HR=1.06,95%CI:0.86~1.31,P=0.625);静息心率每升高10 次/min,全因死亡风险增加13%(HR=1.13,95%CI:1.07~1.19,P<0.001),见表2。
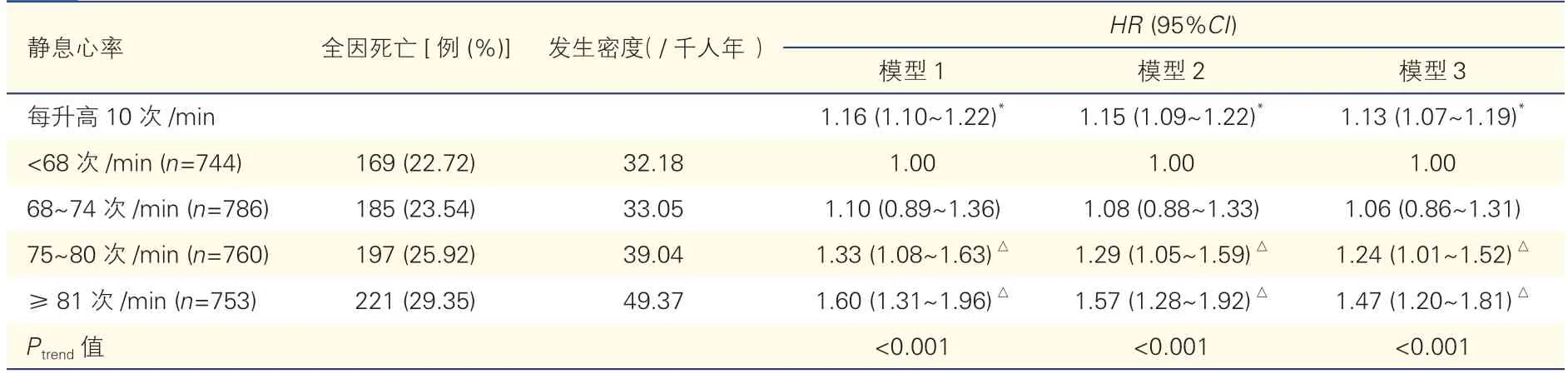
表2 静息心率对超高危ASCVD 患者全因死亡风险影响的Cox 回归分析(n=3 043)
限制性立方样条分析也显示,静息心率与全因死亡风险呈线性关联(Poverall<0.001,Pnon-linear=0.933),且静息心率>70 次/min 时全因死亡风险显著增加。
分层分析显示,在<65 岁和≥65 岁、男性和女性、有和无高血压、有和无糖尿病、服用和未服用β 受体阻滞剂、LDL-C<1.8 mmol/L 和≥1.8 mmol/L 以及LDL-C 未达标的患者中,静息心率每升高10 次/min,全因死亡风险均显著增加,但在LDL-C达标的患者中未观察到这一关联(表3)。尽管在分层分析中未观察到交互作用(Pinteraction均>0.05),但静息心率每升高10 次/min 时,LDL-C<1.8 mmol/L、女性、<65 岁患者的全因死亡风险更高;在男性、未服用β 受体阻滞剂、<65 岁人群中,与静息心率<68 次/min 相比,静息心率为75~80 次/min 时,全因死亡风险均显著增加;在<65 岁和≥65 岁、男性、LDL-C 未达标、LDL-C<1.8 mmol/L 和≥1.8 mmol/L、有高血压、有和无糖尿病、未服用β 受体阻滞剂的患者中,静息心率≥81 次/min 时全因死亡风险均显著增加(表3)。
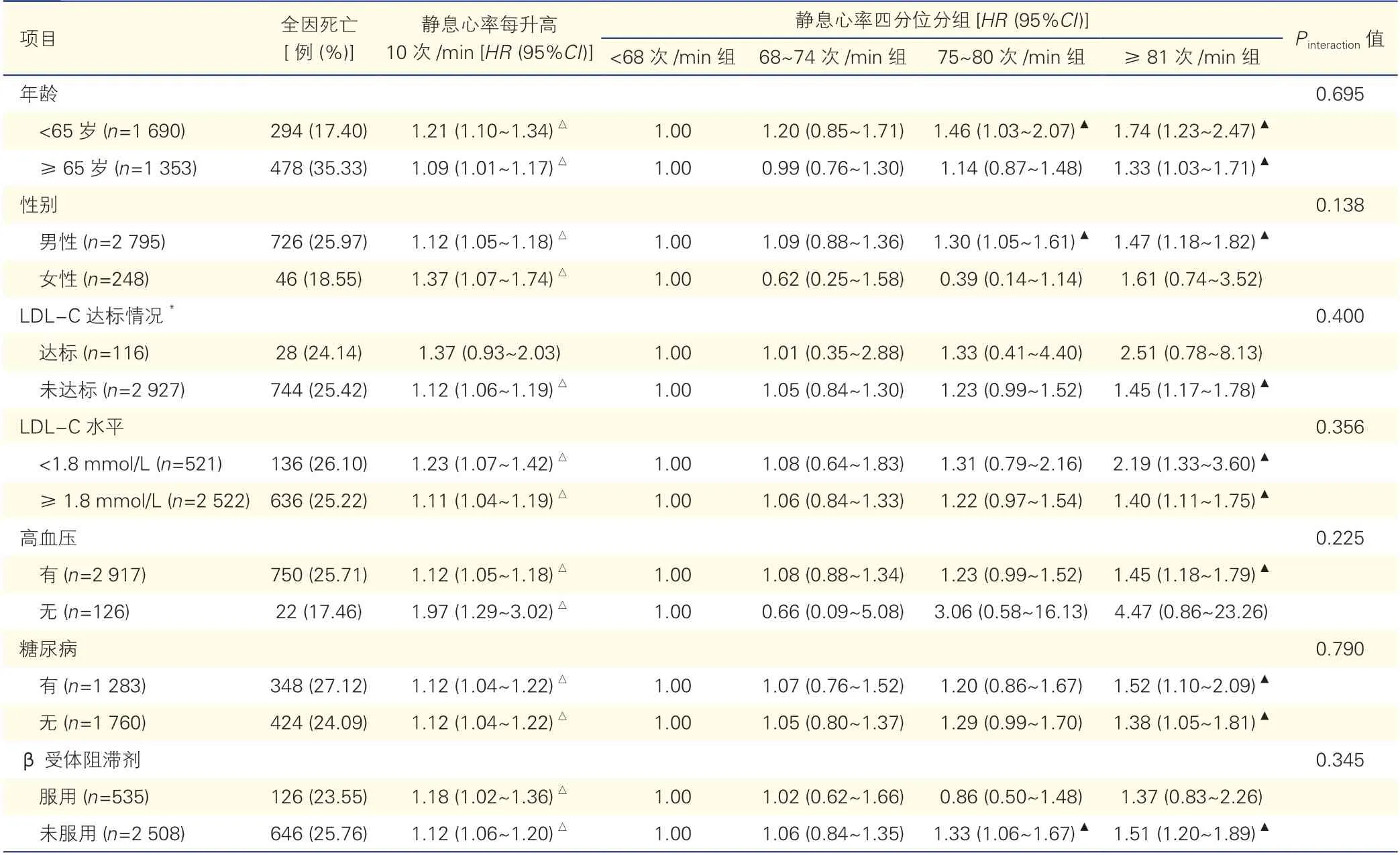
表3 静息心率对超高危ASCVD 患者全因死亡风险影响的分层分析(n=3 043)
2.4 静息心率对超高危ASCVD 患者全因死亡风险影响的敏感性分析(表4)

表4 静息心率对超高危ASCVD 患者全因死亡风险影响的敏感性分析(n=3 043)
分别排除随访时间<1年者、有肿瘤病史者、有心房颤动病史者后,敏感性分析结果与主分析结果相似。根据静息心率二分位分组的敏感性分析结果显示:与<74 次/min 者相比,≥74 次/min 者的全因死亡风险增加31%(HR=1.31,95%CI:1.13~1.52,P<0.001)。当根据静息心率三分位分组时,结果显示:与<70 次/min 者相比,70~79 次/min 者的全因死亡风险并未增加(HR=1.17,95%CI:0.97~1.40,P=0.101),而≥80 次/min 者的全因死亡风险增加了41%(HR=1.41,95%CI:1.17~1.69,P<0.001)。在静息心率五分位分析中,当静息心率≥72 次/min时,全因死亡风险明显增加。另外,根据限制性立方样条图70 次/min 的切点将患者分为两组时,结果显示,与<70 次/min 者相比,≥70 次/min 者的全因死亡风险增加28%(HR=1.28,95%CI:1.09~1.50,P=0.003)。
3 讨论
本研究通过对开滦研究中3 043例超高危ASCVD患者进行5.81(3.46,9.64)年随访后发现:静息心率升高与超高危ASCVD 患者全因死亡风险增加相关,且呈线性关联。Jabre 等[21]在心肌梗死患者中开展的一项研究支持这一结果:与静息心率<60 次/min者相比,静息心率81~90 次/min、≥91 次/min 者的全因死亡风险分别增加59%和61%,但静息心率71~80 次/min 者的全因死亡风险并未增加。
本研究发现,在超高危ASCVD 患者中,与静息心率<68 次/min 组患者相比,68~74 次/min 组患者的全因死亡风险虽有所增加,但无统计学意义(HR=1.06,95%CI:0.86~1.31,P>0.05),75~80 次/min组、≥81 次/min 组患者的全因死亡风险分别增加24%和47%。因此,本研究团队考虑超高危ASCVD患者的静息心率合适干预切点可能为>75 次/min。这与《基层冠心病与缺血性脑卒中共患管理专家共识2022》[12]中建议冠心病合并缺血性脑卒中患者的目标静息心率为60 次/min 有所不同。针对ONTARGET/TRANSCEND 研究的事后分析表明,对于病情稳定的慢性心血管疾病患者,心率每升高10 次/min,全因死亡风险增加15%[22]。与之相似的是,本研究发现,在超高危ASCVD 患者中,静息心率每升高10 次/min,全因死亡风险增加13%;限制性立方样条分析同样显示,静息心率与超高危ASCVD 患者的全因死亡风险呈线性关联。
本研究的分层分析显示,静息心率每升高10次/min 时,女性患者的全因死亡风险高于男性患者,<65 岁患者的全因死亡风险高于≥65 岁患者。而Li 等[23]在一般人群中发现,在≥60 岁人群中静息心率升高与全因死亡风险增加相关,但在<60 岁人群中并未观察到这一关联。Aladin 等[24]在一般人群中发现,静息心率升高与男性全因死亡风险增加相关,而与女性全因死亡风险无关。此外,本研究还发现,静息心率与超高危ASCVD 患者全因死亡风险之间的关联独立于LDL-C 水平:在LDL-C<1.8 mmol/L 和≥1.8 mmol/L 的患者中,静息心率每升高10 次/min,全因死亡风险分别增加23%和11%,提示在LDL-C 较低人群中静息心率升高对全因死亡风险的影响可能更大。本研究在LDL-C 达标的超高危ASCVD 患者中未发现上述关联(HR=1.37,95%CI:0.93~2.03),考虑可能与该亚组样本量较少(116 例)有关,但其风险可能仍高于LDL-C 未达标人群(HR=1.12,95%CI:1.06~1.19)。期待有更大样本量的研究来进一步验证本研究结果。
静息心率升高增加超高危ASCVD 患者全因死亡风险的潜在机制:第一,静息心率升高可降低心肌细胞膜电稳定性及心室颤动阈值,触发恶性心律失常[25];第二,高静息心率与全身炎症反应、内皮功能障碍、动脉僵硬度等密切相关,且静息心率增加易导致冠状动脉斑块破裂[26-28];第三,静息心率升高可增加心肌耗氧量并降低冠状动脉血流灌注[8],从而影响ASCVD 患者的临床结局;第四,高静息心率可能与自主神经系统失衡有关,交感神经活动增强可能激活肾素-血管紧张素系统,从而引起血管紧张素及儿茶酚胺水平升高,导致血管结构发生变化,增加不良结局风险[29-30]。
本研究的优势:首先,本研究在超高危ASCVD患者中探讨静息心率与全因死亡风险之间的关联,样本量较大,随访时间较长;其次,本研究利用发生ASCVD 后首次健康体检时的静息心率进行分析,而不是入院或出院时的静息心率,更能反映患者出院后的长期静息心率水平。
本研究的局限性:(1)本研究尽管对静息心率及全因死亡的多个相关因素进行了校正或进行了敏感性分析,仍不能排除残留的混杂因素,例如缺乏冠状动脉造影病变情况、Gensini 评分、冠状动脉病变范围及冠状动脉开始出现病变至发生ASCVD 的时间等反映病情严重程度的资料,这可能会使静息心率与全因死亡风险之间的关联分析结果出现偏差;(2)约16.5%的超高危ASCVD 患者缺乏静息心率数据而被排除,这从侧面说明本研究的调查质量不够高,希望未来有更多数据质量优异的人群研究来验证本研究结果;(3)本研究基于开滦研究,研究对象为中国北方工业化城市职业人群,不足以代表所有人群,可能存在选择偏倚,其结果有待于在其他人群中进一步进行验证。
总之,本研究表明,在开滦研究队列的超高危ASCVD 患者中,静息心率升高与全因死亡风险增加相关,且二者呈线性关联;超高危ASCVD 患者的静息心率合适干预切点可能为>75 次/min。
利益冲突:所有作者均声明不存在利益冲突
