伴自发性门静脉分流孤立性静脉曲张破裂出血患者临床特点
2024-03-07翁成钊王超张峻林思慧林冲陈世耀蒋炜
翁成钊 王超 张峻 林思慧 林冲 陈世耀 蒋炜
孤立性胃底静脉曲张(isolated gastric varices,IGV-1)破裂出血是肝硬化门静脉高压的严重并发症之一,常合并较大的门体分流道,进行组织黏合剂治疗存在异位栓塞风险,病死率高[1,2]。治疗方案的选择较为困难、且影响治疗预后的因素较为复杂。本研究通过观察伴自发性门体分流(spontaneous portalsystemic shunt,SPSS)的IGV-1破裂出血患者的临床特点,选择最佳治疗策略, 避免并发症发生。
资料与方法
一、研究对象
回顾性分析上海市复旦大学附属中山医院及厦门分院2015年1月至2018年12月收治的伴SPSS的IGV-1型破裂出血患者(自发性分流道最窄部分直径大于4 mm)的临床资料。排除标准:①合并其他器官功能衰竭,如心功能衰竭、慢性阻塞性肺部疾病等;②合并恶性肿瘤;③既往有食管或胃部手术;④孕妇。本研究通过复旦大学附属中山医院及厦门分院伦理委员会批准(B2015-133R, B2019-020), 所有患者均签署手术知情同意书。
二、观察指标
患者一般资料、临床表现、实验室检査,根据CTA检查结果记录门静脉主干直径、自发性分流(脾肾分流、胃肾分流、胃肾分流合并脾肾分流),并记录肝静脉压力梯度(hepatic venous pressure gradient, HVPG)、门静脉有无血栓、Child-Pugh评分、MELD评分、治疗方式。随访3年,记录术后再出血、肝性脑病和存活情况。
三、统计学方法
应用SPSS 17.0统计学软件。计数资料用例数(%)表示,比较采用χ2检验;偏态分布的计量资料用M(P25,P75)表示,比较采用Kruskal-WallisH秩和检验。使用单变量Cox回归对治疗后再出血相关的风险因素进行分析。P<0.05为差异有统计学意义。
结 果
一、一般情况
共纳入IGV-1破裂出血患者37例,15例存在脾肾分流道,14例存在胃肾分流道,8例同时存在脾肾分流和胃肾分流。男性21例(56.8%),年龄为60(50,68)岁,乙肝肝硬化17例(45.9%),腹水20例(54.1%),门静脉血栓(portal vein thrombosis,PVT) 10例(27.0%);根据胃底静脉曲张形态分型,结节隆起型22例(59.5%),葡萄串型9例(24.3%),条索型3例(8.1%),树枝型2例(5.4%),混合型1例(2.7%)。脾肾分流组、胃肾分流组、胃脾肾分流组的血常规、肝功能、凝血功能、门静脉直径、腹水、PVT、Child-Pugh 分级、MELD评分、HVPG的比较差异无统计学意义(P>0.05)。见表1。
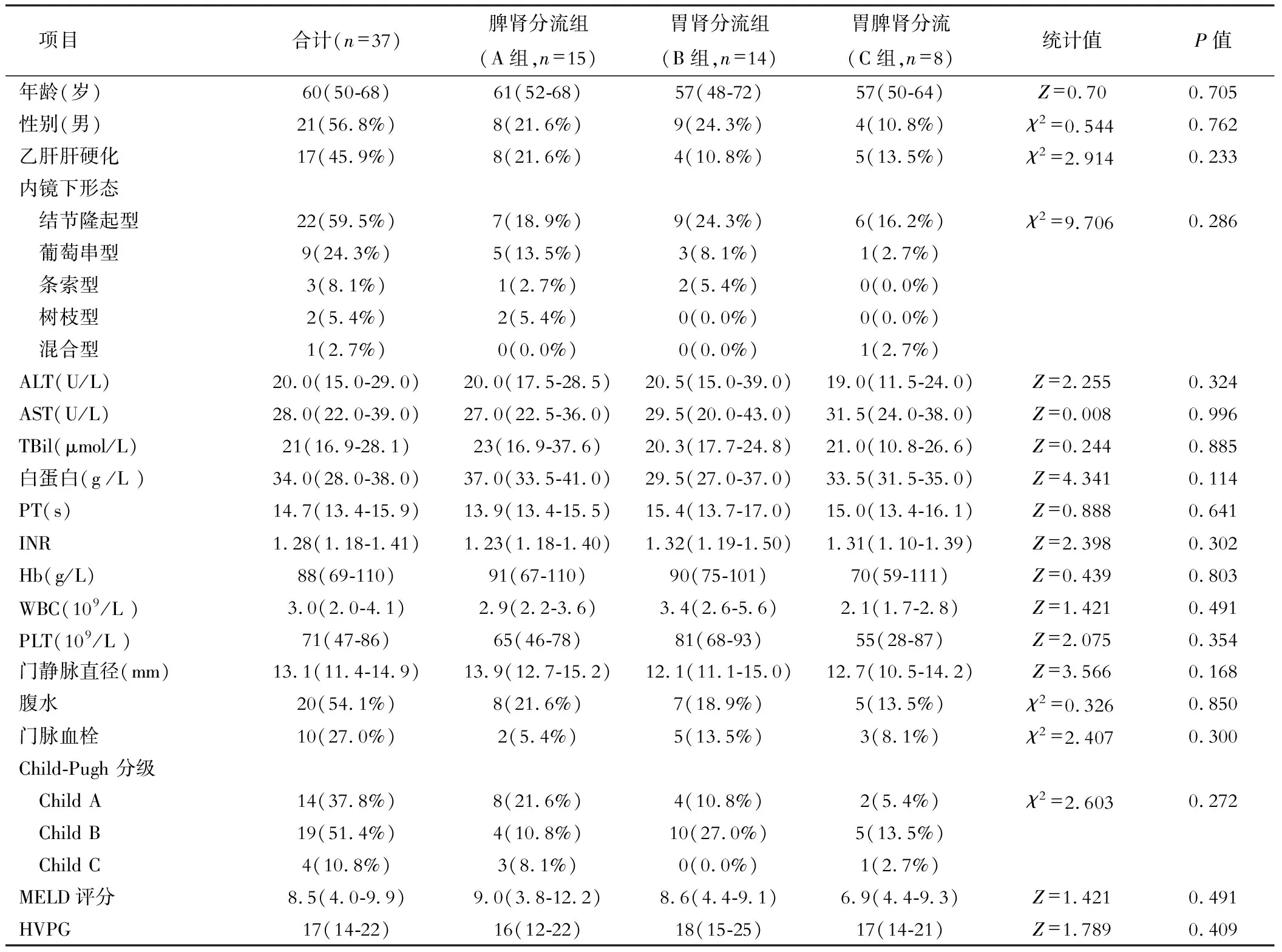
表1 3组患者临床资料比较
二、3组患者治疗方式及预后比较
IGV-1型患者经颈静脉肝内门腔静脉分流术(transjugular intrahepatic portosystemic shunt, TIPS)治疗18例(46.6%),脾肾分流组与胃肾分流组的TIPS治疗方式比较差异有统计学意义(P=0.041);除TIPS治疗外其余治疗方式3组比较差异无统计学意义(P>0.05)。随访3年,出现再出血患者11例(29.7%),肝性脑病5例(13.5%)均发生在胃肾分流组,门静脉高压胃病3例(8.1%),胃溃疡2例(5.4%),死亡3例(8.1%)。三组之间肝性脑病的发生率比较差异有统计学意义(P<0.05),其他随访情况三组比较差异无统计学意义(P>0.05)。见表2。

表2 3组研究对象治疗方式及预后比较(例)
三、不同治疗方式预后比较
不同治疗方式预后比较结果见表3,伴SPSS的IGV-1型破裂出血Tips治疗18例患者随访中出现再出血4例,出现肝性脑病4例,无死亡病例;胃冠状静脉栓塞术联合部分脾栓塞术治疗6例患者随访中出现再出血4例,死亡1例。经内镜治疗患者9例,随访出血再出血3例,组织胶治疗、超声介导弹簧圈联合组织胶治疗、组织胶联合金属夹治疗各出现1例再出血,肝性脑病1例,死亡1例。脾切除术联合贲门周围血管离断术及肝移植术后患者未再出现呕血及肝性脑病,但在随访过程中1例肝移植患者因肺部感染死亡。

表3 不同治疗方式随访3年预后比较
四、再出血的独立影响因素分析
将病因、年龄、性别、实验室指标、有无腹水、PVT、Child-Pugh分级、HVPG和MELD评分等因素纳入分析,单因素Cox回归发现门静脉血栓(OR:4.022, 95%CI:1.276~13.935,P=0.018)和HVPG(OR:1.138, 95%CI:1.021~1.279,P=0.031)是影响患者再出血的危险因素。
讨 论
胃静脉曲张出血占肝硬化静脉曲张出血的20%,病死率45%~55%,2年出血发生率约达25%[3,4]。Sarin根据内镜检査的结果将其分为食管胃静脉曲张(gastroesophageal varices, GOV)1 型 、 GOV2 型、IGV-1 型及 IGV-2 型,其中 GOV1 型临床最为常见, IGV-1型出血概率最高[5]。IGV内镜下形态各异,可呈巨大肿块状或息肉状隆起,亦可为条索状、葡萄串状或树枝状,以结节隆起型居多,表面可伴有糜烂、樱桃红样血斑或红色征。本研究IGV-1患者内镜下形态以结节隆起型、葡萄串型、条索型为主,树枝型及混合型较少。IGV-1以胃后静脉和(或)胃短静脉为主要血供,且多合并SPSS,临床上较常见的为左侧分流如脾肾分流、胃肾分流。肝硬化胃静脉曲张患者常见SPSS,与患者肝功能储备情况密切相关,且会增加肝性脑病、门静脉血栓等并发症。然而SPSS与 EGV、消化道出血、腹水的相关性目前尚无定论。Simón-Talero 等[6]发现 SPSS 患者EGV、消化道出血和腹水的发生率更高。Linpinski等[7]发现SPSS患者EGV发生率更高,但消化道出血和腹水发生率与无SPSS患者差异无统计学意义。本研究发现合并SPSS的IGV-1破裂持续患者门静脉血栓、腹水发生率极高,且Child-Pugh评分及HVPG数值也较高。
IGV-1患者静脉曲张治疗难度大,治疗尚缺乏相关的指南和证据[8]。内镜下套扎治疗IGV-1报道较少,技术难度较大,需要技术经验丰富医师操作。目前国内外指南对于IGV1型胃静脉曲张推荐内镜下组织胶注射(endoscopic cyanoacrylate injection,ECI)治疗[9,12],而因SPSS的存在行ECI治疗可能出现异位栓塞的风险,常见的为肺栓塞、脑栓塞和脾梗死[13,14],因此合并SPSS的IGV-1型更加棘手。伴SPSS的IGV-1患者可采取内镜治疗、介入治疗、外科治疗3种方式。解放军总医院分析了753例接受ECI治疗患者的临床资料,发现异位栓塞发生率为0.7%[13]。伴有SPSS的胃静脉曲张患者发生异位栓塞的风险较大,尤其是伴胃肾分流者[15]。近年来金属夹联合ECI是作为治疗合并SPSS的IGV-1型静脉曲张患者的重要手段,但金属夹可诱发胃静脉曲张大出血的情况,故建议由经验丰富医师操作[16]。EUS引导下弹簧圈置入联合ECI也是近年开展内镜下治疗的术式之一[5,17],目前EUS 引导下弹簧圈联合 ECI 与单纯ECI治疗伴SPSS的胃静脉曲张的对照研究较少。然而内镜下治疗后胃静脉曲张再次出血发生率不低,同时内镜下治疗对脾肿大、脾功能亢进无治疗效果,对于因脾亢导致的血小板降低是相对禁忌证[18]。
TIPS 治疗前顺行栓塞SPSS仍是伴有严重EV、腹水等胃静脉曲张患者的首选治疗手段,但TIPS术前存在SPSS时可增加肝性脑病风险,且较大的横截面积SPSS与难治性肝性脑病存在相关性[19]。 Riggio等[20]认为SPSS与TIPS术后早期发生严重肝性脑病有关,TIPS术中栓塞SPSS可减少术后肝性脑病发生率。
目前国内外各医疗中心对TIPS术中是否栓塞SPSS尚未形成规范,建议TIPS术中发现SPSS可考虑同步行栓塞治疗,但需大样本、多中心对照研究验证。本研究伴SPSS的IGV-1型静脉曲张破裂TIPS治疗18例患者随访中有4例出现肝性脑病,但仅在伴有胃肾分流的患者出现,伴胃肾分流的IGV-1型静脉曲张患者行TIPS并栓塞SPSS的术后肝性脑病风险需要大样本进一步研究。
外科治疗的手段包括肝脏移植术、分流术及断流术[21]。外科分流术通过在肝外人为建立门静脉系统与腔静脉系统之间的分流通道,可降低门静脉压力,联合脾脏切除可解决脾大脾亢,但同样存在肝性脑病、门静脉系统血栓、分流通道血栓等问题。脾切除加贲门周围血管离断术(脾切断流术)应用于肝硬化门静脉高压伴食道胃底静脉曲张破裂出血,但该手术在处理急性胃静脉曲张出血中的作用有限,且大部分IGV-1型静脉曲张患者病情较重,手术风险较大,且脾切除后易出现门静脉系统血栓及肠系膜血栓,可加重门静脉高压,因此术前评估尤其重要[22,23]。对于脾静脉血栓形成引起的左侧或左侧门静脉高压继发急性胃静脉曲张出血的患者,脾切除术或脾动脉栓塞术是有效的治疗手段,脾切除术消除了侧支静脉血流,防止了将来继发于脾静脉血栓形成的胃静脉曲张出血[24]。肝移植术可解决门静脉高压症和肝硬化问题,但由于肝源数量有限及移植费用高、存在术后感染等并发症,所以肝移植术仅少部分患者才能施行[21]。
本研究纳入的患者例数不多,目前伴SPSS的IGV-1型静脉曲张患者治疗方式无统一共识,各治疗方式的优劣无相关对比研究,需要大样本、多中心临床研究进一步探讨。
利益冲突声明:所有作者均声明不存在利益冲突。
