特异质性药物性肝损伤的研究进展
2024-03-07付豪爽谢青
付豪爽 谢青
特异质性药物性肝损伤(drug-induced liver injury, DILI)可由各种处方和非处方药物、COVID疫苗引起,是导致肝脏疾病的重要原因之一。DILI依靠排他性诊断,需要评估常见的肝损伤原因及可疑药物的时间相关性。DILI因果关系评估目前可使用新修订的电子因果关系评估方法(revised electronic causality assessment method, RECAM)。此外,目前已确定了具有药物特异性的人类白细胞抗原(human leukocyte antigen, HLA),可协助个体化诊断。在停止使用可疑药物后,80%的DILI患者可完全恢复,另有10%~15%患者进展至慢性化,而5%~10%患者导致死亡或肝移植,各种预后模型可以帮助识别具有高危死亡风险的DILI患者。对于国际标准化比值(international normalized ratio, INR)升高或伴随精神状态改变的DILI患者,应考虑N-乙酰半胱氨酸治疗或紧急评估进行肝移植。对于伴有嗜酸性粒细胞增多和全身症状,或者肝活检提示表现为自身免疫样的中至重度的DILI患者,可以短期使用皮质类固醇治疗,但仍需探索其最佳适应证和治疗方法。目前仍缺乏可靠的动物模型和客观的生物标志物用以DILI的机制研究和临床管理。综上所述,在过去20年中,DILI领域的研究取得了极大进展,本文将详细阐述DILI近年来的研究进展。
一、药物性肝损伤的流行病学
我国DILI年发病率高于欧洲和美国,约为24人/10万人[1,2]。目前关于宿主年龄、性别和种族与DILI易感性的关系尚不明确。儿童占DILI患者的5%~10%,多见于丙戊酸和米诺环素;而老年人则更常见于异烟肼和阿莫西林-克拉维酸(amoxicillin-clavulanate, AC)[3]。女性的肝毒性易感性高于男性并且更严重,常见于双氯芬酸和干扰素-β1a;而男性则常见于硫唑嘌呤和合成代谢类固醇[4]。中草药和膳食补充剂(herbal and dietary supplements, HDS)是我国DILI的最常见病因(26.61%)[1],西方国家也在逐年增加,约占药物性肝损伤网络(Drug Induced Liver Injury Network, DILIN)的20%。AC是西方国家导致DILI的最常见病因,平均每2500个使用者中便会有一位出现DILI[2]。
绿茶提取物中含有大量的儿茶素,因其具有减肥作用而被大肆宣传,存在于多种HDS中并且无需在产品说明书中标注。绿茶提取物导致的DILI大多表现为急性肝细胞损伤型,严重者可危及生命[5]。而在印度草药中,藤黄果和姜黄同样会导致DILI。此外,合成代谢类固醇常被用以增强肌肉力量,其导致的DILI常表现为胆汁淤积性肝损伤和瘙痒[6]。同时,免疫检查点抑制剂(immune checkpoint inhibitors, ICI)导致的肝毒性逐年增加,其导致30%~50%ICI治疗的患者出现免疫相关不良事件,包括皮炎、结肠炎及肝炎等。ICI导致的DILI主要表现肝细胞性损伤,但也有报道称30%表现为胆汁淤积性/混合性损伤,同时亦有罕见的继发性硬化性胆管炎导致胆道狭窄的报道[7]。
药物诱导的自身免疫样肝炎常见于呋喃妥因和米诺环素等[8]。Khat与Tinospora cordifolia是目前唯一明确证明与自身免疫样DILI相关的HDS[9]。同时COVID-mRNA和腺病毒载体疫苗也可导致自身免疫样DILI[10]。尽管其使用量已超过12亿剂,但仅极少数导致DILI,大多数表现为急性肝细胞性损伤并伴随自身抗体阳性[10]。虽然部分患者具有自身免疫样肝炎特征并需要进行短期激素治疗,但其病死率极低(<1%)。
二、药物性肝损伤的诊断
临床实践指南指出,所有疑似DILI患者均应完善病史、用药史、血液检查和肝脏影像学检查(图1)[4]。鉴于10%~20%的普通人群可有轻微肝酶升高,因此疑似DILI患者应满足最低标准:血清丙氨酸氨基转移酶(alanine aminotransferase, ALT)或谷草转氨酶(aspartate aminotransferase, AST)>5倍正常上限(upper limit of normal, ULN)、碱性磷酸酶(alkaline phosphatase, ALP)>2×ULN或总胆红素(total bilirubin, TBil)>2.5 mg/dL。而计算R值可以进行有效的分型和鉴别诊断。此外,目前建议对疑似DILI患者(包括老年男性和具有疫区旅居史者)进行急性戊型肝炎和丙型肝炎病毒检测。疑似药物与肝损伤应具备时间因果关系。在大多数情况下,DILI潜伏期应小于6个月,但米诺环素和呋喃妥因等引起的DILI可能超过6个月[11]。同时,评估停药后肝损伤的改善对于DILI的诊断尤为重要。
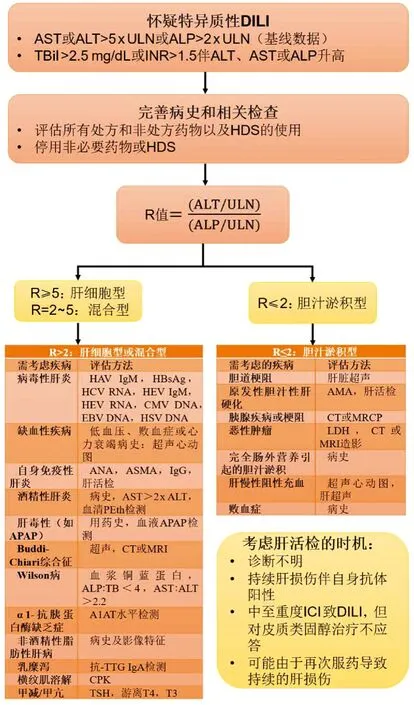
图1 疑似DILI患者的诊断流程
目前鉴别自身免疫性肝炎与具有自身免疫特征的DILI仍然充满挑战。肝活检可有助于识别特异质性DILI的组织学特征,包括混合性/胆汁淤积性肝炎、坏死、嗜酸性粒细胞浸润和肉芽肿,同时与非DILI肝病鉴别[12]。此外,某些药物与特定的组织学表现相关并可通过肝活检确诊。肝活检还可提供预后信息,如坏死、导管反应和肝纤维化程度与不良预后相关。
LiverTox网站对1000多种药物和60种HDS的肝毒性进行了全面审查。在涉及多种可疑药物的诊断中,LiverTox似然量表将单个药物从A到E进行排序,可用于确定最具备因果关系的药物。各个国家的食品药品监督管理局批准的处方药说明书可提供药物肝毒性信息,但可能存在差异。
三、因果关系评估
DILI的因果关系评估常使用基于专家意见的各种量表进行。DILIN专家意见的因果关系量表将药物与肝损伤的因果关系按1级(确定,可能性>95%)到5级(不可能,可能性<25%)排序。专家意见可以解释非典型病例,同时可综合线索并与现有文献比较。然而,其缺乏适用性和足够的专家人数。相比之下,改进的Rousell Uclaf因果关系评估方法(Rousell Uclaf causality assessment method, RUCAM)和RECAM是结构化的因果关系评估工具,其根据肝脏检查、时间相关性和其他临床特征进行综合评分(表1)。相对于RUCAM,RECAM具有排除危险因素、简化评分信息、合并肝活检信息、诊断试验或再挑战信息的优势。然而,仍需要在研究中对其可靠性进行验证[13]。HDS-DILI患者中大多数摄入了多成分HDS,并且产品说明书与其实际成分之间存在差异,导致其因果关系评估存在困难。然而,研究表明,HLA-B*35:01与绿茶提取物、姜黄和何首乌的肝毒性相关[5]。

表1 RUCAM和RECAM因果关系评估工具的详细信息
由于DILI在药物暴露者中的发病率较低(1/100000~1/1000),目前认为DILI易感性与宿主的药物代谢和免疫应答的遗传变异有关。研究表明,PTPN22基因的单个核苷酸多态性是跨药物和患者种族的DILI危险因素[14]。该基因与多种免疫介导疾病相关,但尚不清楚其在DILI发病机制中的作用。此外,在Ⅰ类和Ⅱ类等位基因中已鉴定出多种具有药物特异性的HLA多态性。然而,鉴于其阳性预测值较低,目前尚不建议在服药前检测以预防DILI,不过可用于帮助DILI诊断。
用于早期识别DILI的新型生物标志物的敏感性和特异性可能高于ALT和AST。血清谷氨酸脱氢酶有望成为新型的诊断生物标志物,并且对接受多马珠单抗治疗的肌肉萎缩症患者具有优异的适用性[15]。此外,半胱天冬酶裂解的细胞角蛋白18、巨噬细胞集落刺激因子和miRNA-122有望成为DILI诊断和预后的生物标志物[16]。而目前正在进行的人肝类器官研究,有望成为DILI发病机制研究的新型模型系统。
四、自然史和预后模型
在临床实践中,DILI确诊后的关键措施即停用可疑药物。80%患者在停药后6个月内即可完全恢复,但仍有小部分患者进展至急性肝衰竭(acute liver failure, ALF)甚至死亡。伴有肝细胞损伤和黄疸的DILI患者最有可能进展至不良结局,因而需要住院并动态监测。对于INR升高或伴随精神状态改变者,鉴于其自发恢复的可能性低于30%,需紧急评估进行肝移植[17]。目前已确定了部分与DILI不良结局相关的危险因素,包括女性、高龄、既往有肝病和合并症[18]。
虽然仅以肝酶的升高程度并不足以反映DILI严重程度,但已证明AST>17.1×ULN和TBil>6.6×ULN可用于预测ALF、肝移植和死亡[19]。此外,一些药物(如甲基巴多索龙)可通过诱导ALT产生而使其水平升高,但无任何组织学证据[20]。除此之外,低白蛋白水平被证明是DILI不良预后的独立危险因素[18]。
目前已开发出多种综合评分用于预测DILI患者的不良预后。Hy定律常用于在临床试验中识别肝毒性药物,其指出AST或ALT>3×ULN和TBIL>2×ULN(无胆汁淤积损伤伴ALP水平升高)可预测DILI不良预后[21]。西班牙DILI登记处重新修订了Hy定律(nR Hy定律),其定义为:[(ALT或AST水平更高者/ULN)÷(ALP/ULN)]>5和总胆红素>2×ULN[19]。相较于Hy定律,nR Hy定律可更好地预测DILI相关ALF(AUROC 0.77vs. 0.67)[17]。目前已开发出DILI患者的预后算法,其通过确定AST、TBIL和AST/ALT临界值,可准确预测不良结局。与Hy定律和nR Hy定律相比,该算法在预测ALF方面表现出更好的特异性和AUROC(0.80)[19],但仍需在外部队列进行验证。终末期肝病模型(model for end-stage liver disease, MELD)常用于预测失代偿性肝硬化患者结局,同时其在DILI的预后预测中也有应用。与Hy定律和nR Hy定律相比,MELD>19分可更准确预测DILI患者的死亡结局[17]。
鉴于合并症可导致DILI患者死亡,有研究将Charlson合并症指数、MELD评分和白蛋白水平整合至预后模型中(DILI-CAM)并且表现良好。此外,目前还开发了基于网络的DILI病死率的计算工具,可用于日常实践[18](http://gihep.com/calculators/hepatology/dili-cam/)。
在一项国际性合作研究中,骨桥蛋白与DILI患者的不良预后密切相关(AUROC=0.86)。与单独使用MELD评分≥18分相比,血清细胞角蛋白-20及巨噬细胞集落刺激因子与MELD评分(20~29分)相结合,可提高预测DILI患者不良结局的特异性(89%vs.74%)[15]。
组织学特征同样具有预后价值。现有研究表明,广泛的坏死和导管反应与死亡结局密切相关,而嗜酸性粒细胞浸润和肉芽肿则预示着患者可自发恢复[12]。
肝毒性药物的再次给药(再激发)通常是无意中发生的,主要见于未识别出肝损伤是由药物毒性反应引起。对于必需药物(如抗结核药物和ICI),则可以在临床医师指导下再次服用。值得注意的是,在具有替代疗法时并不鼓励再次给药,以免诱发更快速或更严重的肝毒性反应[4]。
部分DILI患者的肝损伤恢复时间较长,即慢性DILI,其发病率为8%~21%,具体取决于所使用的慢性DILI定义。DILIN将慢性DILI定义为持续6个月的肝脏生化异常;而西班牙DILI登记处的研究表明,将1年作为时间点可能更适用。与慢性DILI相关的危险因素包括高龄、胆汁淤积性肝损害、血脂异常和更严重的DILI。虽然慢性DILI患者很少出现后遗症,但少数可进展至纤维化、肝硬化或门静脉高压。关于慢性DILI的长期随访方案尚不明确,目前推荐患者每半年进行一次实验室检查,每年进行一次肝脏弹性成像。
五、特异质性药物性肝损伤的治疗
停用潜在的可疑致病药物是DILI患者临床管理的关键。现有研究证明,唯一有效的药物治疗是短期皮质类固醇治疗[4,22]。皮质类固醇已被证明对免疫介导的过敏反应有效,包括伴有嗜酸性粒细胞增多和全身症状的药物反应[22]。少数情况下,对于具有自身免疫表型和肝活检显示以浆细胞为主的患者,1~3个月的皮质类固醇治疗可促进肝酶恢复[22]。然而,并非所有患者都应经验性使用皮质类固醇,尤其是胆汁淤积或ALF患者。研究表明,这些患者使用皮质类固醇治疗可能并无益处,甚至存在潜在危害[23]。
近20%~30%使用ICI患者会出现肝损伤。然而,多项研究证明,肝转移肿瘤才是其肝损伤的最常见原因,尤其见于混合性/胆汁淤积性患者[24]。因而对于这些患者,建议使用MRI或CT进行肝脏造影,并在无法确诊时进行肝活检。此外,对于严重的胆汁淤积性肝损伤或进行性黄疸的患者,建议进行MRI胆胰管造影以排除ICI可能引起的继发性硬化性胆管炎,这些患者通常对免疫抑制治疗无应答[7]。幸运的是,50%~70%ICI肝毒性患者表现为肝细胞损伤,但致命性ICI肝毒性十分罕见[24]。对于停药后并无改善的Ⅱ级ICI肝毒性[ALT:(3~5)×ULN和/或总胆红素(1.3~5)×ULN]患者,可以服口服皮质类固醇(0.5~1 mg/kg)[22]。对于Ⅲ级ICI肝毒性患者(ALT>5×ULN联合或不联合胆红素>3×ULN),应永久停用ICI,并且其中许多患者因口服皮质类固醇无反应而需要静脉注射甲泼尼龙治疗。尽管建议在病因不明且肝毒性为Ⅱ~Ⅲ级时进行肝活检,但在临床实践中仅少数患者接受肝活检。目前抗代谢药物(如硫唑嘌呤或麦考酚酯)已用于皮质类固醇治疗3~4周后ALT仍持续升高的患者,但其使用剂量和周期尚未标准化。
N-乙酰半胱氨酸(N-acetylcysteine, NAC)在对乙酰氨基酚(acetaminophen, APAP)导致的DILI及ALF中的作用已得到充分证实[2],但是其在非APAP急性肝损伤中的作用尚不明确。一项基于非APAP导致ALF的研究,患者采用72小时静脉注射NAC治疗,结果显示并无总体生存获益。但在早期肝性脑病中,则显著提高了无移植生存率(27%~58%)[25]。同时静脉注射NAC对于抗结核药物导致的DILI患者可缩短其住院时间,但无生存获益[24]。因此,对于患有早期DILI-ALF的特定患者,可以考虑口服或静脉注射NAC治疗[4]。值得注意的是,一项儿科临床试验证明使用NAC治疗的患儿生存率低于安慰剂组[26]。
熊去氧胆酸已被批准用于原发性胆汁性胆管炎患者和胆汁淤积相关的严重瘙痒DILI患者。熊去氧胆酸有助于缓解瘙痒,但并不会促进患者肝酶恢复正常。现有研究证明,熊去氧胆酸在缓解DILI方面并无总体获益,但其给药安全并且耐受性良好[27]。
左旋肉碱治疗已在丙戊酸肝毒性诱发的高氨血症患儿中进行了试验,结果显示其可降低血氨并促进恢复,但仍需研究以确定治疗剂量和持续时间[28]。胆汁酸螯合剂(如考来烯胺)常用于治疗中至重度瘙痒患者,同时也可用于因半衰期延长和肠肝循环导致的来氟米特肝毒性在停药后仍无改善的患者。去纤维肽可提高造血干细胞移植后严重肝窦阻塞综合征患者的生存率[29]。血浆置换已被用于急性DILI患者,但尚无证据证明其可促进DILI恢复。其他干预措施已被评估是否有助于DILI预防或恢复[30]。尽管观察到的疗效有限,但其安全性表现良好[30]。
对于DILI-ALF患者,支持性药物治疗的自发生存率小于30%,但肝移植是行之有效的治疗措施。因此,建议任何INR升高的DILI患者都应紧急评估进行肝移植[4]。此外,对于慢性DILI尤其是临床和组织学表现为胆管消失综合征或门静脉高压者,同样需要考虑进行肝移植。
利益冲突声明:所有作者均声明不存在利益冲突。
