CircFoxo3调节miR-130a-5p/TEAD1轴对心力衰竭大鼠心肌细胞凋亡影响的实验研究
2024-03-07曹彦花乐金海陈新宇刘建和刘越美
曹彦花, 乐金海, 陈新宇, 刘建和, 刘越美, 李 俊, 李 苏
心力衰竭(heart failure,HF)是一种慢性疾病,其特点是心脏不能向外周组织提供代谢所需的血液和氧气[1]。尽管治疗HF的药物有利尿剂、正性肌力药物、神经体液抑制剂、血管扩张剂和离子通道调节剂等,但其仍然是心血管疾病患者病死的主要原因,给社会带来了巨大的经济负担[2]。针对HF病理、生理及治疗分子机制的研究有助于降低HF患者的发病率,提高患者生活质量[3]。有研究表明,HF会促进心肌细胞凋亡,而心肌细胞凋亡也加速了HF的进展[4]。因此,了解HF心肌细胞凋亡的具体分子机制将有助于开发新的治疗。环状RNA叉头框蛋白O3(circular RNA forkhead box protein O3,CircFoxo3)是一种常规的外显子环状RNA,已被证明与某些人类癌症的特定病理变化有关[5-6]。据报道,敲低CircFoxo3可减轻小鼠心脏移植中发生的缺血再灌注损伤,发挥心肌保护作用[7]。有研究显示,过表达miR-130a-5p可减轻心肌缺血再灌注对小鼠心肌造成的损伤[8];下调TEA域转录因子1(TEA domain transcription factor 1,TEAD1)表达可抑制缺氧引起的心肌细胞损伤[9]。生物信息学分析发现,CircFoxo3与miR-130a-5p、miR-130a-5p与TEAD1存在靶向关系,但CircFoxo3能否通过调节miR-130a-5p/TEAD1轴影响HF大鼠心肌细胞凋亡尚不明确。鉴于此,本研究旨在探究CircFoxo3对HF大鼠心肌细胞凋亡的影响以及其作用机制。
1 材料与方法
1.1实验动物及细胞 选择体质量为250~260 g的7周龄,无特定病原体(specific pathogen free,SPF)级雄性SD大鼠144只,购自长沙市天勤生物技术有限公司,生产许可证号:SCXK(湘)2019-0014。饲养于湖南中医药大学第一附属医院,使用许可证号:SYXK(湘)2020-0010。所有动物实验遵循3R原则,并获得湖南中医药大学第一附属医院伦理委员会批准[批号:(2020)伦审第(228)号]。人胚肾细胞HEK-293T购自武汉普诺赛生命科技有限公司。
1.2主要实验试剂 CircFoxo3干扰载体(si-CircFoxo3)及其阴性对照(si-NC)、miR-130a-5p激动剂(miR-130a-5p agomir)及其阴性对照(agomir NC)、miR-130a-5p拮抗剂(miR-130a-5p antagomir)及其阴性对照(antagomir NC)购自重庆英茂盛业生物科技有限公司。盐酸阿霉素购自美国MCE公司。Trizol试剂购自爱必信(上海)生物科技有限公司。HE染色液购自南京建成生物工程研究所。Masson染色液、脱脂奶粉购自南京森贝伽生物科技有限公司。RIPA裂解液购自金克隆(北京)生物技术有限公司。大鼠人基质裂解素2(human stromelysin-2,ST2)、N端脑钠肽前体(N-terminal pro-brain natriuretic peptide,NT-pro BNP)酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)检测试剂盒购自上海科培瑞生物科技有限公司。TUNEL细胞凋亡检测试剂盒购自北京百奥莱博科技有限公司。TEAD1、B淋巴细胞瘤-2(B cell lymphoma-2,Bcl-2)、Bcl-2相关X蛋白(Bcl-2-associated X protein,Bax)、裂解的天冬氨酸特异性半胱氨酸蛋白酶-3(cleaved aspartate-specific cysteine protease-3,cleaved caspase-3)、GAPDH兔源一抗及辣根过氧化物酶(horseradish peroxidase,HRP)标记的山羊抗兔二抗购自英国Abcam公司。CircFoxo3野生型质粒CircFoxo3-WT和突变型质粒CircFoxo3-MUT购自苏州泓迅生物科技股份有限公司。
1.3HF大鼠模型的构建 通过腹腔注射盐酸阿霉素的方法构建HF大鼠模型。在第1、3、9、11天腹腔注射盐酸阿霉素1 mg/kg,在第5、7、13、15天腹腔注射盐酸阿霉素2 mg/kg。第16天时若观察到大鼠出现体重减轻、精神不佳、运动量减少、毛发无光泽,且左室射血分数(left ventricular ejection fraction,LVEF)<40%则判定HF大鼠模型构建成功[10]。本研究HF大鼠造模成功率为100%。
1.4实验分组及处理方法 采用随机数字表法将SD大鼠分为对照组、HF组、si-NC组、si-CircFoxo3组、agomir NC组、miR-130a-5p agomir组、si-CircFoxo3+antagomir NC组、si-CircFoxo3+miR-130a-5p antagomir组,每组18只。干预方法,(1)si-NC组:按照方法1.3实验步骤成功构建HF大鼠模型后于尾静脉注射si-NC 33.33 μg。(2)si-CircFoxo3组:按照方法1.3实验步骤成功构建HF大鼠模型后于尾静脉注射si-CircFoxo3 33.33 μg。(3)agomir NC组:按照方法1.3实验步骤成功构建HF大鼠模型后于尾静脉按200 nmol/kg注射agomir NC。(4)miR-130a-5p agomir组:按照方法1.3实验步骤成功构建HF大鼠模型后于尾静脉按200 nmol/kg注射miR-130a-5p agomir。(5)si-CircFoxo3+antagomir NC组:按照方法1.3实验步骤成功构建HF大鼠模型后于尾静脉注射33.33 μg si-CircFoxo3,并同时按200 nmol/kg注射antagomir NC。(6)si-CircFoxo3+miR-130a-5p antagomir组:按照方法1.3实验步骤成功构建HF大鼠模型后于尾静脉注射33.33 μg si-CircFoxo3,并按200 nmol/kg注射miR-130a-5p antagomir。(7)对照组:以生理盐水代替阿霉素进行方法1.3中的造模实验操作,模拟造模过程结束后,于尾静脉注射与上述处理组等体积的生理盐水。(8)HF组:按照方法1.3实验步骤构建HF大鼠模型,建模成功后,于尾静脉注射与上述处理组等体积的生理盐水。尾静脉注射生理盐水或药物为每3 d一次,持续3周。
1.5标本收集 于末次干预处理结束后,每组选取6只大鼠,予2%戊巴比妥钠麻醉并处死。收集大鼠的心肌组织用于CircFoxo3、miR-130a-5p表达及TEAD1蛋白表达的检测。对每组剩余的12只大鼠,应用彩色多普勒超声仪检测其左室收缩末期内径(left ventricular end systolic diameter,LVESD)、左室舒张末期内径(left ventricular end diastolic diameter,LVEDD)、LVEF的变化。心功能指标检测结束后,予2%戊巴比妥钠麻醉大鼠,腹主动脉取血,经离心获血清用于ELISA检测。血液收集完毕后,处死所有大鼠,收集大鼠的心肌组织用于HE染色、TUNEL染色及Western blot检测。
1.6检测方法
1.6.1 反转录实时荧光定量聚合酶链式反应(quantitative reverse transcription polymerase chain reaction,qRT-PCR)法检测心肌组织中CircFoxo3、miR-130a-5p表达水平 使用Trizol试剂提取心肌组织匀浆总RNA。将RNA逆转录为cDNA后进行qRT-PCR。反应体系为20 μL:cDNA 2 μL,2×SYBR预混合物10 μL,去离子水7 μL,正、反向引物各0.5 μL。反应程序:95 ℃ 5 min,95 ℃ 30 s,60 ℃ 60 s,扩增38个循环。所用引物序列见表1。以GAPDH、U6为内参,通过2-ΔΔCT法分别计算CircFoxo3、miR-130a-5p的相对表达量。

表1 引物序列
1.6.2 大鼠心功能检测 采用DC-35Pro型彩色多普勒超声仪(南京贝登医疗股份有限公司)检测大鼠LVESD、LVEDD、LVEF水平。
1.6.3 ELISA法检测大鼠血清中ST2、NT-pro BNP水平 严格按照试剂盒说明书步骤检测大鼠血清中ST2、NT-pro BNP水平。
我国电子商务的发展占据了中国经济市场的半壁江山,大数据时代推动着电子商务的经济发展,也衍生出了新的经济模式,其中最新型的模式就是共享经济。我国现存的状态是共享经济市场和租赁服务市场混杂。本文主要研究的是正确了解共享经济以及关于电子商务和共享经济之间的关系。在大数据的环境下,我国电商的现状,以及这种衍生的新经济是否有利于中国经济未来的发展,这是值得我们深思的问题。
1.6.4 HE染色、Masson染色检测大鼠心肌组织病理变化、心肌纤维化 将心肌组织浸入4%多聚甲醛中24 h,然后转移到70%乙醇中,梯度浓度乙醇脱水,石蜡包埋,切成5 μm厚的切片。将切片经二甲苯中脱蜡、梯度乙醇水化、磷酸缓冲盐溶液冲洗后进行HE染色、Masson染色。通过光学显微镜观察心肌组织病理变化、心肌纤维化情况。
1.6.5 TUNEL染色检测心肌细胞凋亡 取心肌组织切片用二甲苯脱蜡,梯度乙醇脱水,磷酸缓冲盐溶液冲洗后,加入蛋白酶K溶液除去组织蛋白,然后用蒸馏水冲洗。根据TUNEL细胞凋亡检测试剂盒的说明书步骤对心肌组织切片进行TUNEL染色,使用光学显微镜观察细胞凋亡。以染色呈棕黄色的细胞为凋亡细胞,细胞核染色呈蓝色的细胞为活细胞。凋亡率(%)=凋亡细胞数/细胞总数×100%。
1.6.6 Western blot法检测大鼠心肌组织TEAD1、Bax、Bcl-2、cleaved caspase-3蛋白表达 取心肌组织制成匀浆后,使用RIPA裂解液裂解心肌组织匀浆以获取总蛋白质,BCA法检测蛋白浓度。取30 μg总蛋白,在94 ℃水浴变性3 min后进行12% SDS-PAGE电泳,将蛋白通过电转法转移到PVDF膜上,用5%脱脂奶粉液封闭处理1 h。在4 ℃下将PVDF膜与一抗液[TEAD1(1∶3 000)、Bax(1∶4 000)、Bcl-2(1∶4 000)、cleaved caspase-3(1∶2 000)、GAPDH(1∶3 000)]孵育过夜。以Tris缓冲盐溶液冲洗膜后,将PVDF膜与二抗液(1∶5 000)共同孵育2 h。再次冲洗膜后在暗室中曝光、显影。应用凝胶成像系统(UVP GelDoc-It型,美国UVP公司)分析各蛋白的灰度值,并以GAPDH为内参计算目标蛋白的相对表达量。
1.6.7 双荧光素酶报告基因实验 分别构建CircFoxo3野生型质粒CircFoxo3-WT和突变型质粒CircFoxo3-MUT。将CircFoxo3-WT和CircFoxo3-MUT分别与mimic NC或miR-130a-5p mimic共转染于HEK-293T细胞,继续培养48 h后通过化学发光多功能酶标仪(LATECH LUMIstar Omega型,德国BMG公司)观察荧光素酶活性变化。
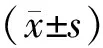
2 结果
2.1沉默CircFoxo3或过表达miR-130a-5p对各组大鼠心肌组织病理变化的影响 HE染色结果显示,对照组大鼠心肌组织完整,心肌纤维排列规律。HF组大鼠心肌组织有严重的病理损伤,如心肌纤维形态紊乱和炎性细胞浸润。与HF组、si-NC组比较,si-CircFoxo3组大鼠心肌组织病理损伤减轻。与HF组、agomir NC组比较,miR-130a-5p agomir组大鼠心肌组织病理损伤有所改善。与si-CircFoxo3组、si-CircFoxo3+antagomir NC组比较,si-CircFoxo3+miR-130a-5p antagomir组大鼠心肌组织病理损伤较重,见图1。
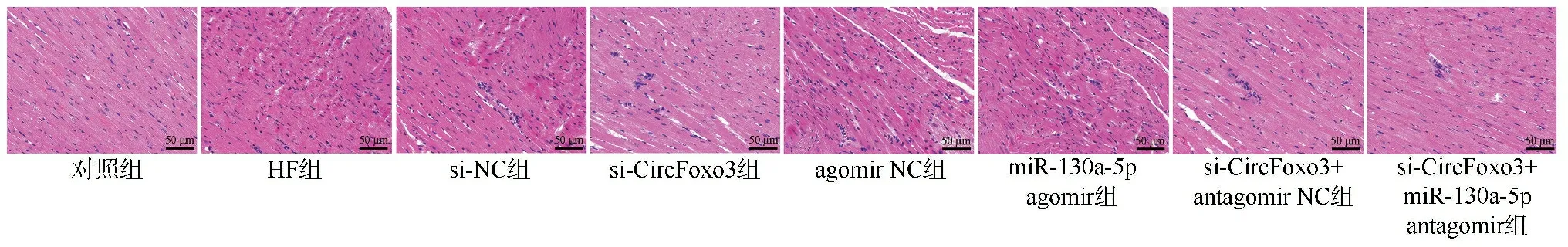
图1 各组大鼠心肌组织的HE染色结果比较图(×200)
2.2沉默CircFoxo3或过表达miR-130a-5p对各组大鼠心肌纤维化的影响比较 Masson染色结果显示,与对照组相比,HF组大鼠心肌组织中有大量呈蓝染的胶原沉积。与HF组、si-NC组比较,si-CircFoxo3组大鼠心肌组织中胶原沉积减少。与HF组、agomir NC组比较,miR-130a-5p agomir组大鼠心肌组织中胶原沉积减少。与si-CircFoxo3组、si-CircFoxo3+antagomir NC组比较,si-CircFoxo3+miR-130a-5p antagomir组大鼠心肌组织中胶原沉积增多,见图2。
2.3沉默CircFoxo3或过表达miR-130a-5p对各组大鼠心肌组织中CircFoxo3、miR-130a-5p表达及TEAD1蛋白表达的影响比较 与对照组比较,HF组大鼠心肌组织CircFoxo3表达及TEAD1蛋白表达水平升高,miR-130a-5p表达水平降低,差异有统计学意义(P<0.05)。与HF组、si-NC组比较,si-CircFoxo3组大鼠心肌组织CircFoxo3、TEAD1蛋白表达水平降低,miR-130a-5p表达水平升高,差异有统计学意义(P<0.05)。与HF组、agomir NC组比较,miR-130a-5p agomir组大鼠心肌组织CircFoxo3表达水平差异无统计学意义(P>0.05),miR-130a-5p表达水平显著升高(P<0.05),TEAD1蛋白表达水平显著降低(P<0.05)。与si-CircFoxo3组、si-CircFoxo3+antagomir NC组比较,si-CircFoxo3+miR-130a-5p antagomir组大鼠心肌组织CircFoxo3表达水平差异无统计学意义(P>0.05),miR-130a-5p表达水平显著降低(P<0.05),TEAD1蛋白表达水平显著升高(P<0.05),见图3。
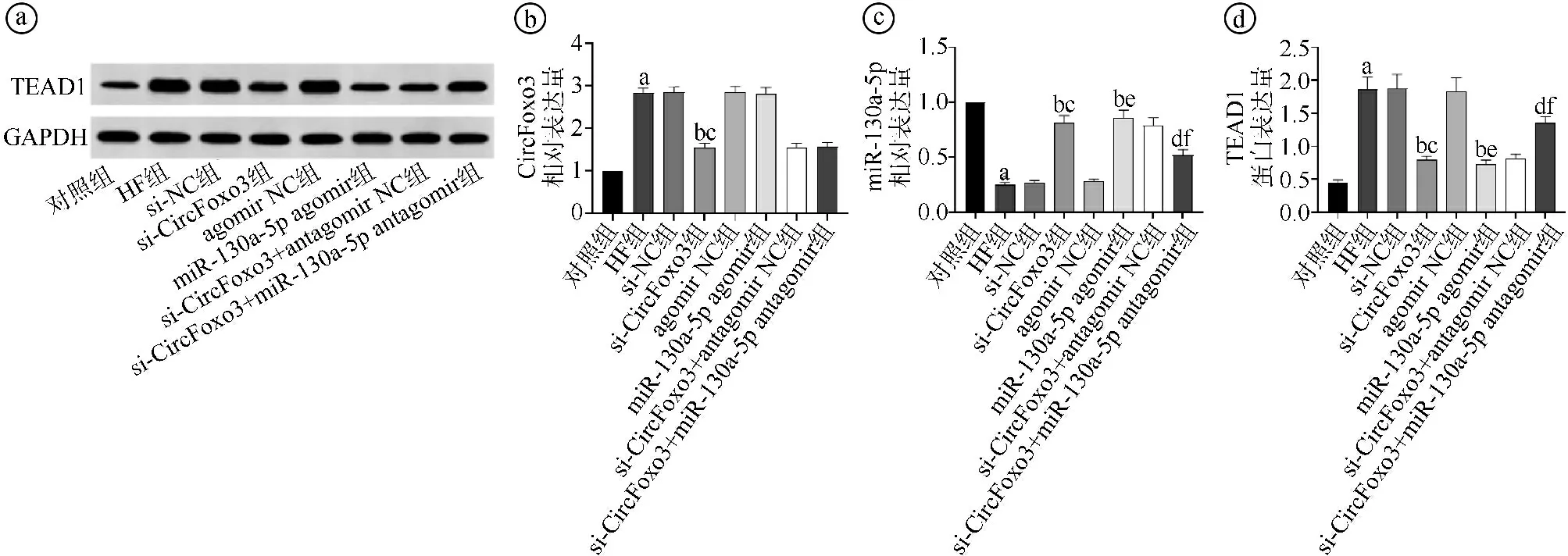
ⓐ为Western blot实验结果图。ⓑ~ⓓ为各组检测指标定量比较结果,与对照组比较,aP<0.05;与HF组比较,bP<0.05;与si-NC组比较,cP<0.05;与si-CircFoxo3组比较,dP<0.05;与agomir NC组比较,eP<0.05;与si-CircFoxo3+antagomir NC组比较,fP<0.05
2.4沉默CircFoxo3或过表达miR-130a-5p对各组大鼠LVESD、LVEDD、LVEF的影响比较 与对照组比较,HF组大鼠LVESD、LVEDD水平升高,LVEF水平降低,差异有统计学意义(P<0.05)。与HF组、si-NC组比较,si-CircFoxo3组大鼠LVESD、LVEDD水平降低,LVEF水平升高,差异有统计学意义(P<0.05)。与HF组、agomir NC组比较,miR-130a-5p agomir组大鼠LVESD、LVEDD水平降低,LVEF水平升高,差异有统计学意义(P<0.05)。与si-CircFoxo3组、si-CircFoxo3+antagomir NC组比较,si-CircFoxo3+miR-130a-5p antagomir组大鼠LVESD、LVEDD水平升高,LVEF水平降低,差异有统计学意义(P<0.05),见图4。
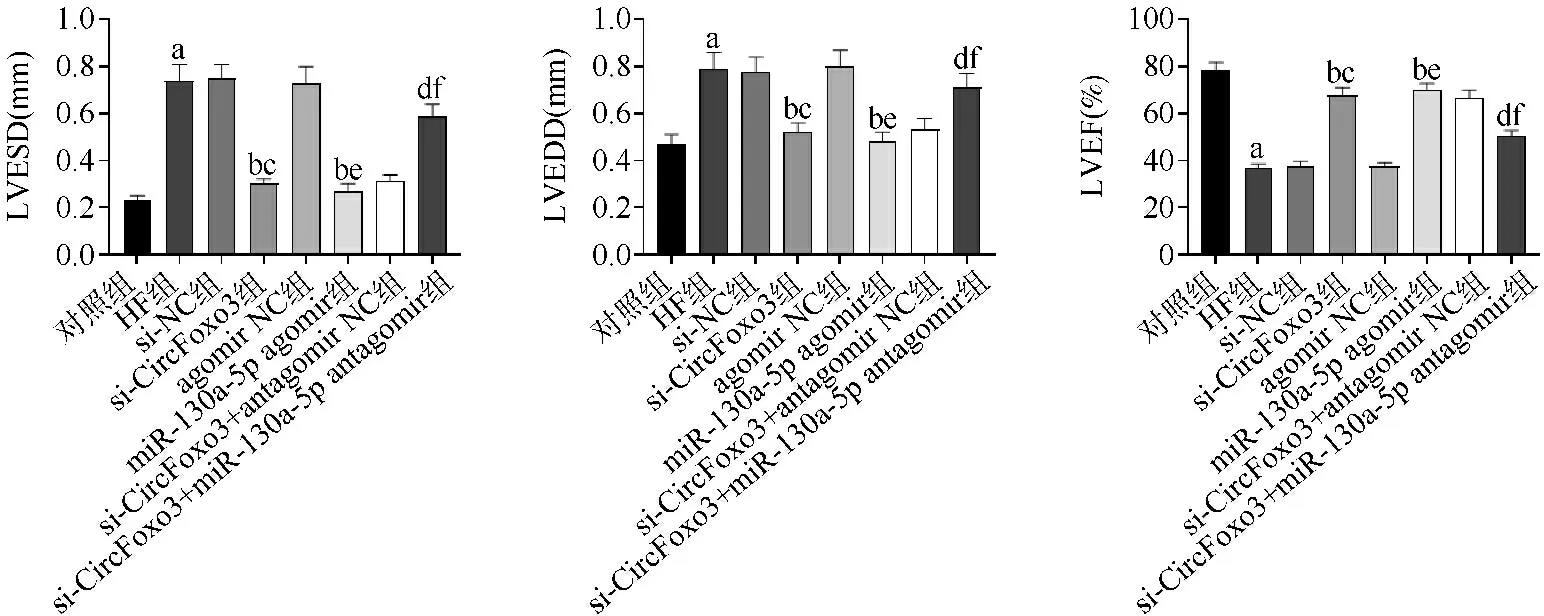
与对照组比较,aP<0.05;与HF组比较,bP<0.05;与si-NC组比较,cP<0.05;与si-CircFoxo3组比较,dP<0.05;与agomir NC组比较,eP<0.05;与si-CircFoxo3+antagomir NC组比较,fP<0.05
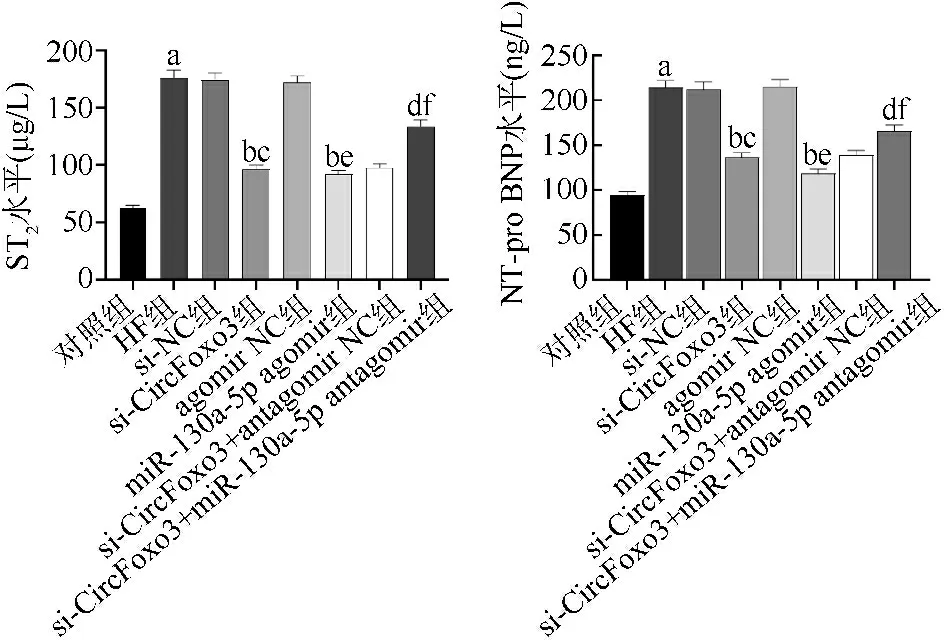
与对照组比较,aP<0.05;与HF组比较,bP<0.05;与si-NC组比较,cP<0.05;与si-CircFoxo3组比较,dP<0.05;与agomir NC组比较,eP<0.05;与si-CircFoxo3+antagomir NC组比较,fP<0.05
2.6沉默CircFoxo3或过表达miR-130a-5p对各组大鼠心肌细胞凋亡的影响比较 与对照组比较,HF组大鼠心肌细胞凋亡率显著升高(P<0.05)。与HF组、si-NC组比较,si-CircFoxo3组大鼠心肌细胞凋亡率显著降低(P<0.05)。与HF组、agomir NC组比较,miR-130a-5p agomir组大鼠心肌细胞凋亡率显著降低(P<0.05)。与si-CircFoxo3组、si-CircFoxo3+antagomir NC组比较,si-CircFoxo3+miR-130a-5p antagomir组大鼠心肌细胞凋亡率显著升高(P<0.05),见图6。
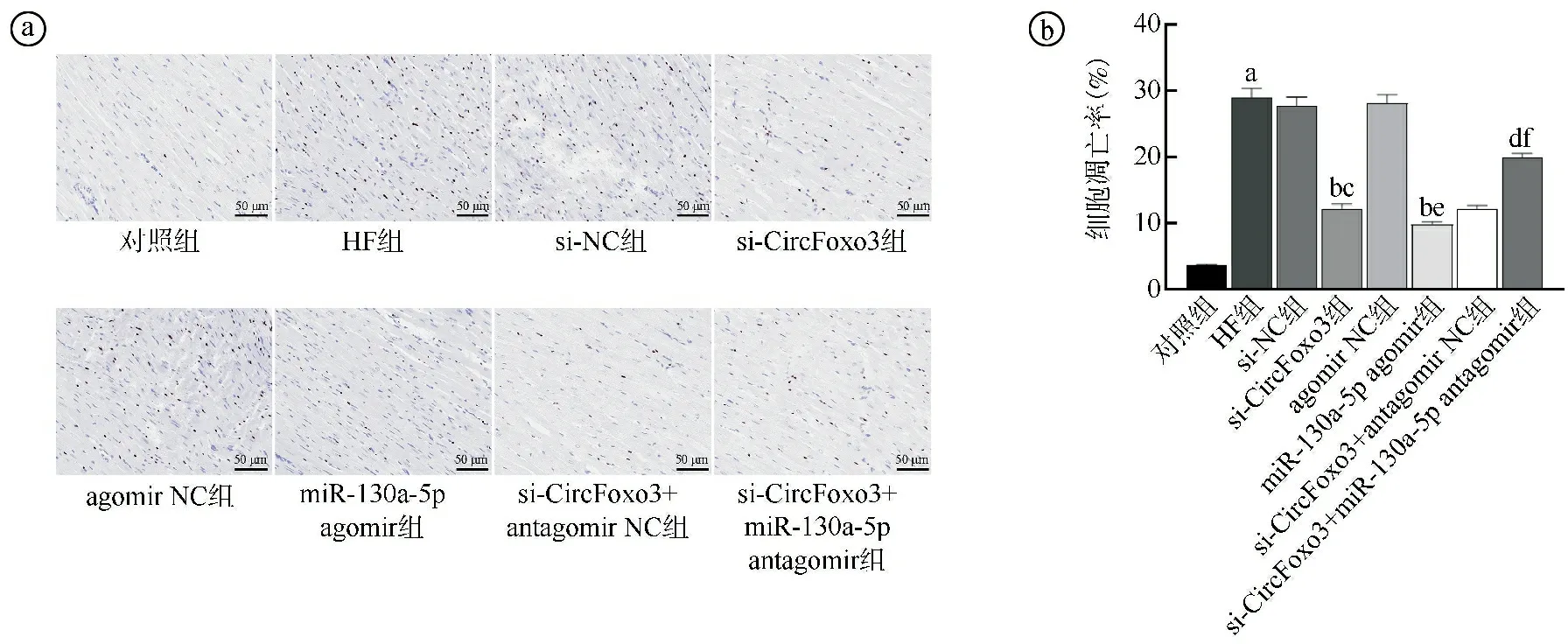
ⓐTUNEL染色结果(×200);ⓑ定量比较结果,与对照组比较,aP<0.05;与HF组比较,bP<0.05;与si-NC组比较,cP<0.05;与si-CircFoxo3组比较,dP<0.05;与agomir NC组比较,eP<0.05;与si-CircFoxo3+antagomir NC组比较,fP<0.05
2.7沉默CircFoxo3或过表达miR-130a-5p对各组大鼠心肌组织中Bax、Bcl-2、cleaved caspase-3蛋白表达的影响比较 与对照组比较,HF组大鼠心肌组织中Bax、cleaved caspase-3蛋白表达水平升高,Bcl-2蛋白表达水平降低(P<0.05)。与HF组、si-NC组比较,si-CircFoxo3组大鼠心肌组织中Bax、cleaved caspase-3蛋白表达水平降低,Bcl-2蛋白表达水平升高(P<0.05)。与HF组、agomir NC组比较,miR-130a-5p agomir组大鼠心肌组织中Bax、cleaved caspase-3蛋白表达水平降低,Bcl-2蛋白表达水平升高(P<0.05)。与si-CircFoxo3组、si-CircFoxo3+antagomir NC组比较,si-CircFoxo3+miR-130a-5p antagomir组大鼠心肌组织中Bax、cleaved caspase-3蛋白表达水平升高,Bcl-2蛋白表达水平降低(P<0.05),见图7。
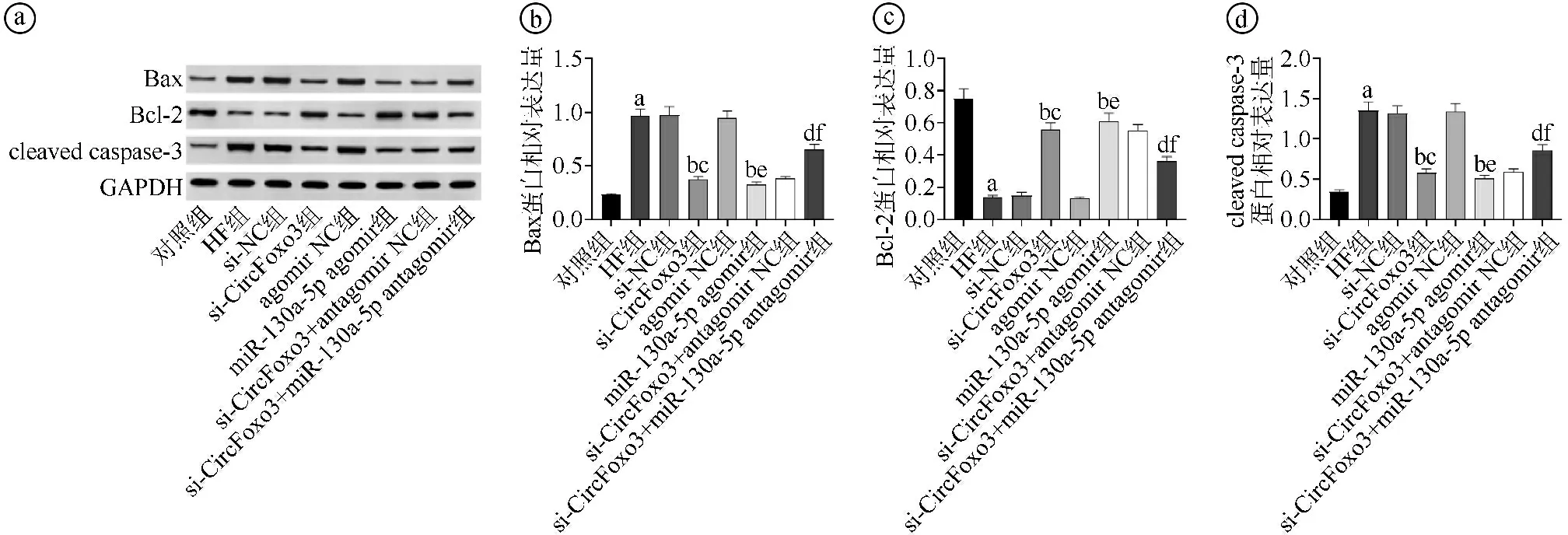
ⓐ为Western blot实验结果图。ⓑ~ⓓ为各组检测指标定量比较结果,与对照组比较,aP<0.05;与HF组比较,bP<0.05;与si-NC组比较,cP<0.05;与si-CircFoxo3组比较,dP<0.05;与agomir NC组比较,eP<0.05;与si-CircFoxo3+antagomir NC组比较,fP<0.05
2.8CircFoxo3调控miR-130a-5p/TEAD1轴的验证结果 Starbase网站预测CircFoxo3与miR-130a-5p、miR-130a-5p与TEAD1的结合位点,见图8。与mimic NC和CircFoxo3-WT共转染组比较,miR-130a-5p mimic和CircFoxo3-WT共转染组HEK-293T细胞的荧光素酶活性显著降低(P<0.05)。与mimic NC和CircFoxo3-MUT共转染组比较,miR-130a-5p mimic和CircFoxo3-MUT共转染组HEK-293T细胞的荧光素酶活性差异无统计学意义(P>0.05)。与mimic NC和TEAD1-WT共转染组比较,miR-130a-5p mimic和TEAD1-WT共转染组HEK-293T细胞的荧光素酶活性显著降低(P<0.05)。与mimic NC和TEAD1-MUT共转染组比较,miR-130a-5p mimic和TEAD1-MUT共转染组HEK-293T细胞的荧光素酶活性差异无统计学意义(P>0.05),见图9。
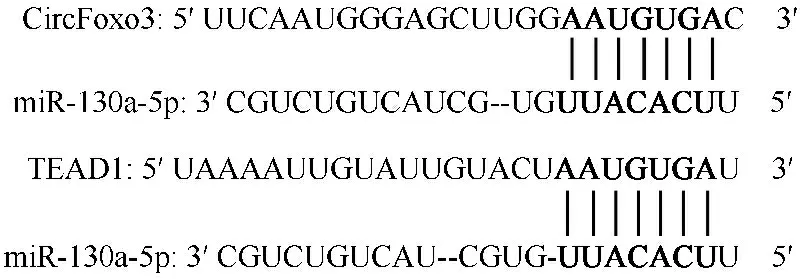
图8 Starbase网站预测CircFoxo3与miR-130a-5p、miR-130a-5p与TEAD1的结合位点图
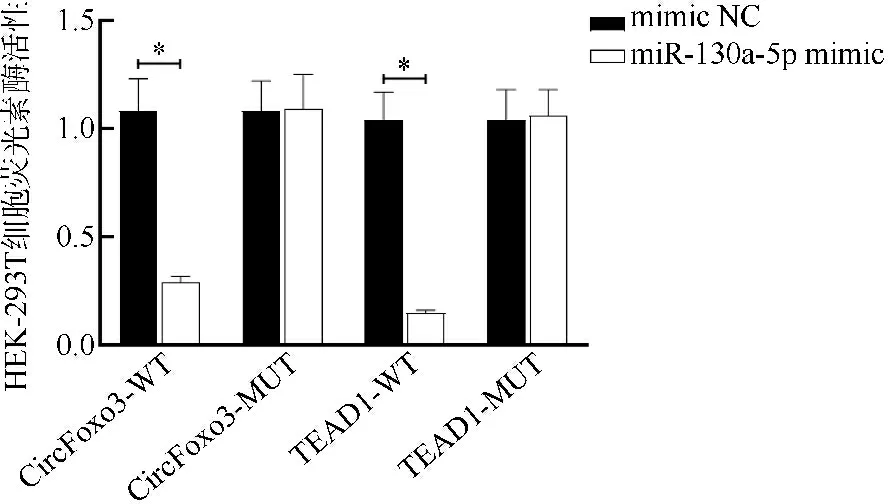
图9 各组HEK-293T细胞荧光素酶活性比较图(*P<0.05)
3 讨论
3.1HF通常是心血管疾病逐渐演变的终点,其中心脏的长期代偿活动最终导致心脏舒张和收缩功能障碍[11]。此外,HF过程中由于体内水液滞留,造成循环机械应力传导至心肌细胞,促使ST2大量产生,ST2可作为HF的标志物[12]。NT-pro BNP也称为氨基末端脑利钠肽前体,心脏处于衰竭状态时可引起NT-pro BNP升高[13]。本研究通过腹腔注射盐酸阿霉素的方法构建了HF大鼠模型,结果显示,与对照组比较,HF组大鼠心功能指标LVESD、LVEDD升高,LVEF降低,血清ST2、NT-pro BNP水平升高,符合HF的特征。
3.2CircFoxo3是一种新发现的环状RNA,来源于亲本FOXO3,可参与细胞凋亡和细胞周期的调节[14]。已有研究报道,沉默CircFoxo3可抑制氧化应激下的颗粒细胞凋亡[15]。心肌缺血再灌注损伤过程心肌组织中高表达的CircFoxo3能够促进心肌细胞凋亡[16]。本研究显示,CircFoxo3在HF大鼠心肌组织中高表达,沉默CircFoxo3可抑制HF大鼠心肌细胞凋亡,提示CircFoxo3可能成为治疗HF的潜在有效靶点。CircRNA可通过充当miRNA的海绵在HF进展中发挥作用[17]。为了进一步探究沉默CircFoxo3抑制HF大鼠心肌细胞凋亡的分子机制,本研究通过生物信息学分析及双荧光素酶报告基因实验证实miR-130a-5p为CircFoxo3的靶基因。miR-130a-5p作为众多miRNAs中的一种,过表达miR-130a-5p可对HF大鼠心脏重塑产生有益影响[18]。本研究结果也显示,miR-130a-5p在HF大鼠心肌组织中低表达,过表达miR-130a-5p可抑制HF大鼠心肌细胞凋亡,且沉默CircFoxo3后HF大鼠心肌组织中miR-130a-5p表达上调,推测沉默CircFoxo3可能通过上调miR-130a-5p表达抑制HF大鼠心肌细胞凋亡。为了验证该推测,本研究在沉默CircFoxo3的基础上再加上miR-130a-5p antagomir来对HF大鼠进行干预,结果显示,miR-130a-5p antagomir减弱了沉默CircFoxo3对HF大鼠心肌细胞凋亡的抑制作用,即认为沉默CircFoxo3可能通过上调miR-130a-5p表达抑制HF大鼠心肌细胞凋亡。
3.3为了进一步探究CircFoxo3/miR-130a-5p轴影响HF大鼠心肌细胞凋亡的分子机制,本研究通过生物信息学分析及双荧光素酶报告基因实验证实TEAD1与miR-130a-5p存在靶向关系。TEAD1是一种在心血管发育中起着至关重要作用的因子[19]。据报道,上调TEAD1可促进急性心肌梗死模型大鼠心肌细胞凋亡[20]。本研究也发现,TEAD1蛋白在HF大鼠心肌组织中高表达,沉默CircFoxo3后HF大鼠心肌组织中miR-130a-5p表达上调,TEAD1蛋白表达下调,且miR-130a-5p antagomir减弱了沉默CircFoxo3对HF大鼠心肌组织中TEAD1蛋白表达的抑制作用。证实了沉默CircFoxo3可能通过调控miR-130a-5p/TEAD1轴抑制HF大鼠心肌细胞凋亡。
3.4近年来,细胞凋亡一直是HF研究的热点。研究表明细胞凋亡与HF的严重程度之间存在正相关关系[21]。Bcl-2是抗凋亡蛋白,而Bax是促凋亡蛋白,在持续压力超负荷引起的HF过程中,Bcl-2蛋白参与抑制心肌细胞凋亡,Bax蛋白仅参与心肌细胞凋亡的启动[22]。作为细胞凋亡的最终执行者,天冬氨酸特异性半胱氨酸蛋白酶-3(aspartate-specific cysteine protease-3,caspase-3)通常以无活性酶原的形式存在,一旦发生凋亡级联反应,caspase-3被裂解并活化为cleaved caspase-3,因此抑制cleaved caspase-3也可以抑制细胞凋亡[23]。本研究显示,与对照组比较,HF组大鼠心肌细胞凋亡率和心肌组织中Bax、cleaved caspase-3蛋白表达水平升高,Bcl-2蛋白表达水平降低,且心肌组织病理损伤及心肌纤维化严重,表明HF引起的心肌细胞凋亡会加重心肌组织损伤,提示抑制心肌细胞凋亡可能成为改善HF的有效策略之一。本研究结果显示,沉默CircFoxo3后,大鼠心肌组织中Bax、cleaved caspase-3蛋白表达水平降低,Bcl-2蛋白表达水平升高,提示沉默CircFoxo3可能通过调控miR-130a-5p/TEAD1轴影响凋亡相关基因表达进而抑制HF大鼠心肌细胞凋亡。
综上所述,沉默CircFoxo3可能通过上调miR-130a-5p来抑制TEAD1表达,进而抑制HF大鼠心肌细胞凋亡。CircFoxo3/miR-130a-5p/TEAD1轴可能成为治疗HF的潜在有效靶点。
