老年急性脑梗死患者血清NLR、hs-CRP、CHI3L1水平与卒中相关性肺炎的关联性研究
2024-03-07于百洋
于百洋, 徐 武
急性脑梗死(acute cerebral infarction,ACI)是我国居民致残和致死的主要原因之一[1]。ACI多发生于老年人群,可伴有吞咽障碍、意识障碍、肢体瘫痪,且存在免疫抑制,具有卒中相关性肺炎(stroke-associated pneumonia,SAP)发生的病理条件。临床研究显示,SAP是ACI的最主要并发症之一[2],且SAP与ACI患者残疾或病死密切相关[3]。因此,早期精准预测ACI患者的SAP发生情况将有助于改善其预后。超敏C反应蛋白(hypersensitive C-reactive protein,hs-CRP)是一种非特异的急性时相反应蛋白,其水平可反映机体炎症反应程度。有研究发现,hs-CRP水平可预测接受静脉溶栓治疗患者发生SAP[4]。中性粒细胞/淋巴细胞比值(neutrophil-to-lymphocyte ratio,NLR)是体内炎症状态与免疫反应相结合的综合性指标。近年来,越来越多的研究关注到NLR在ACI进展中的重要性,高水平的NLR与ACI患者梗死体积增大、出血转化、早期神经功能恶化及临床转归不良相关[5-6],也有研究提示NLR可有效预测SAP的发生[7]。几丁质酶3样蛋白1(chitinase-3-like protein 1,CHI3L1)是一种新型炎症标志物,对以炎症、纤维化和组织重塑为特征的疾病具有良好的预测价值[8]。本课题组的前期研究显示,高水平的CHI3L1是缺血性卒中患者SAP的独立影响因子[9]。但单一炎症标志物预测SAP的灵敏度和特异度尚有待提高。鉴于此,本研究旨在探讨联合检测血清NLR、hs-CRP、CHI3L1水平预测老年ACI患者发生SAP的应用价值,为SAP的早期诊治提供参考。
1 对象与方法
1.1研究对象 招募2020年8月至2022年3月泰兴市人民医院收治的487例老年ACI患者。纳入标准:(1)年龄≥60岁;(2)符合《中国急性缺血性脑卒中诊治指南2018》[10]中关于ACI的诊断标准,且经头颅CT或MRI检查证实;(3)发病至入院时间<48 h。排除标准:(1)ACI发病前存在感染或正服用抗生素;(2)合并自身免疫疾病、血液系统疾病、严重肝肾功能不全;(3)既往存在吞咽障碍;(4)临床资料不完整。本研究获泰兴市人民医院伦理委员会批准(伦理号:LSLW2020006),所有研究对象签署知情同意书。
1.2SAP诊断标准及治疗 SAP定义为ACI患者在发病7 d内新出现的肺炎,诊断标准参照《卒中相关性肺炎诊治中国专家共识(2019更新版)》[11]。本研究由2名主治医师职称以上神经内科医师对研究对象的SAP发生情况进行评判,若2名医师对SAP诊断存在争议,则由上级神经内科主任医师作出最终判定。本研究中139例患者发生SAP(SAP组),348例患者未发生SAP(非SAP组)。对于SAP患者,根据《卒中相关性肺炎诊治中国专家共识(2019更新版)》[11]并结合临床经验或药敏结果进行抗感染治疗。
1.3观察指标 (1)一般资料:年龄、性别、既往史、吸烟史、饮酒史、基线收缩压(systolic blood pressure,SBP)、基线舒张压(diastolic blood pressure,DBP)、发病至入院时间、基线美国国立卫生研究院卒中量表(National Institutes of Health Stroke Scale,NIHSS)评分、脑卒中病因学分型(TOAST分型),以及吞咽困难、气管插管、机械通气、静脉溶栓情况等资料。(2)实验室检验指标:总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)、高密度脂蛋白(high-density lipoprotein,HDL)、低密度脂蛋白(low-density lipoprotein,LDL)、空腹血糖(fasting blood glucose,FBG)、hs-CRP、CHI3L1以及血常规指标等。所有患者在入院次日空腹采集外周肘静脉血4~5 mL,使用全自动血液分析仪(Sysmex XN9000)检测血常规,采用葡萄糖氧化酶法检测FBG水平,使用全自动生化分析仪(奥林巴斯AU5800)检测TC、TG、HDL、LDL、hs-CRP水平。通过酶联免疫吸附法(enzyme-linked immunosorbent assay,ELISA)检测CHI3L1水平,试剂盒购自Abcam公司。NLR为中性粒细胞与淋巴细胞绝对值的比值。

2 结果
2.1两组临床资料比较 与非SAP组相比,SAP组患者年龄更大,心房颤动、吞咽困难、气管插管或机械通气的人数比例及基线NIHSS评分更高,饮酒的人数比例以及基线SBP、DBP水平更低,差异有统计学意义(P<0.05),见表1。

表1 两组临床资料比较
2.2两组实验室检验指标比较 与非SAP组相比,SAP组FBG、NLR、hs-CRP、CHI3L1水平更高,差异有统计学意义(P<0.05),见表2。
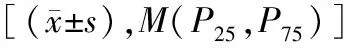
表2 两组实验室检验指标比较
2.3影响ACI患者发生SAP的多因素logistic回归分析结果 以ACI患者发生SAP情况为因变量(发生=1,未发生=0),以表1、表2中有统计学意义的指标为自变量纳入多因素logistic回归,分析结果显示较高水平的基线NIHSS评分、NLR、hs-CRP、CHI3L1和发生吞咽困难是促进ACI患者发生SAP的独立危险因素(P<0.05),较高的基线DBP水平是抑制ACI患者发生SAP的保护因素(P<0.05),见表3。

表3 影响ACI患者发生SAP的多因素logistic回归分析结果
2.4血清NLR、hs-CRP、CHI3L1水平对ACI患者发生SAP的预测价值 ROC曲线分析结果显示,血清NLR、hs-CRP、CHI3L1水平均可有效预测ACI患者发生SAP(P<0.05),且三指标联合检测可进一步提高预测效能[AUC(95%CI)=0.825(0.783~0.868),P<0.001],灵敏度和特异度分别为77.04%、78.28%,见表4,图1。
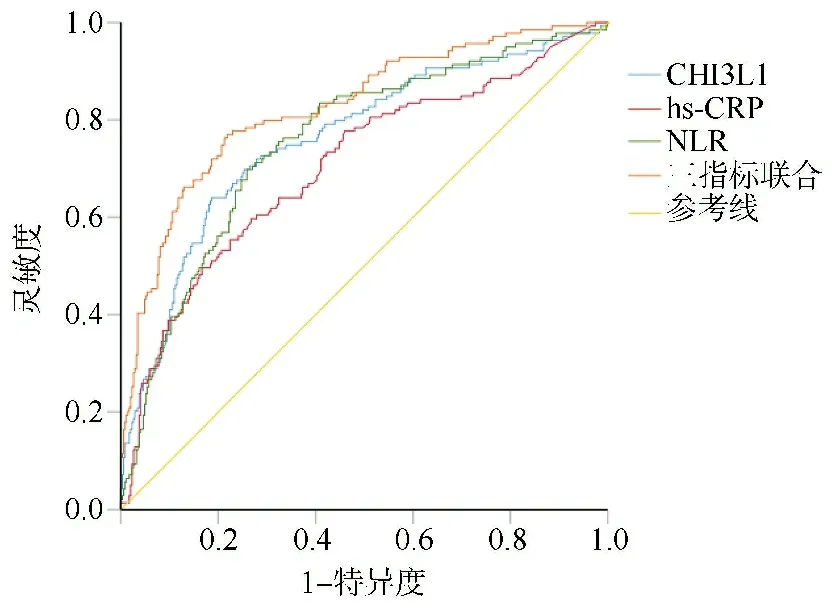
图1 血清NLR、hs-CRP、CHI3L1预测ACI患者发生SAP的ROC曲线图

表4 NLR、hs-CRP、CHI3L1预测ACI患者发生SAP的ROC曲线分析结果
3 讨论
3.1SAP是ACI患者最常见的感染性并发症,其发生机制是多因素、多途径共同参与的复杂过程,与ACI引起的意识障碍、吞咽困难、咳嗽反射减弱、肢体瘫痪、长期卧床等临床症状密切相关[11]。目前认为其主要机制为ACI后免疫抑制引起的炎症反应和ACI后意识下降及吞咽障碍造成的误吸[12]。早期对ACI后SAP进行防治,有助于改善患者预后和提高生活质量。因此,寻找能够及早预测SAP的生物标志物具有重要临床意义。
3.2研究表明,炎症反应在ACI发生及发展过程中起到不容忽视的作用[13]。ACI发生后,中性粒细胞是率先侵入缺血性脑组织的关键因子,通过释放促炎因子、自由基、趋化因子和各种蛋白酶,造成氧化应激损伤、血脑屏障破坏[14]。进而,促炎介质通过血脑屏障进入外周血,引起全身系统性炎症级联反应[15]。同时,由于卒中后的免疫抑制及机体急性应激反应,激活下丘脑-垂体-肾上腺轴,释放糖皮质激素和儿茶酚胺等,诱导淋巴细胞活性降低甚至凋亡[16],机体免疫力下降,抗炎能力减弱,感染机会增加[17]。中性粒细胞主要参与非特异性炎症反应,淋巴细胞主要参与适应性免疫反应,两者通过不同的机制介导ACI后的炎症过程,NLR是两者的结合指标,较单一指标更能体现机体免疫活性及炎症状态。当NLR水平较高时,提示中性粒细胞较高或淋巴细胞较低,此时全身系统性炎症反应增强,机体免疫力下降,SAP发生风险增加。Nam等[7]的研究显示,较高水平的NLR是ACI患者发生SAP的独立影响因素。本研究结果显示,SAP患者入院时NLR水平明显增高,ROC曲线分析结果显示,NLR能有效预测ACI患者发生SAP,当NLR>4.49时,其预测的灵敏度为69.81%,特异度为74.13%。
3.3hs-CRP是一种主要由肝细胞产生的急性时相反应蛋白,当机体处于炎症状态时,hs-CRP水平显著上升。检测hs-CRP水平可帮助判断感染性疾病的严重程度,也是评估ACI患者预后的重要指标[18]。ACI发生后,缺血性脑损伤部位释放大量炎症介质和趋化因子,诱导产生hs-CRP,通过直接及间接途径增加血管内皮通透性和破坏血脑屏障,加重缺血性脑组织损伤[19-20]。王蒙等[4]的研究发现,hs-CRP可作为接受静脉溶栓治疗ACI患者发生SAP的独立预测指标。但是,hs-CRP是一种非特异性的全身炎症标志物,预测SAP的灵敏度及特异度均不高,故其单独用于预测SAP存在一定的局限性。
3.4CHI3L1作为一种新型的炎症标志物,是机体在炎症或感染状态下由中性粒细胞和巨噬细胞分泌产生的糖蛋白[8],因此与肺炎的发生密切相关。此外,在ACI的病理生理进程中,包括梗死发生前的动脉硬化以及梗死后的脑组织损伤,神经炎症反应均起着至关重要的作用[13]。CHI3L1是目前公认的神经炎症介质之一。一方面,CHI3L1可以激活血管内皮细胞,释放细胞间黏附分子-1和血管黏附分子-1,这两个因子进一步损害血管内皮细胞,促进血管平滑肌细胞活化,加剧动脉粥样硬化的发展[21]。另一方面,ACI缺血半暗带区合成分泌促炎因子,如白细胞介素-6、白细胞介素-1β和肿瘤坏死因子-α,这些促炎因子均可刺激CHI3L1的表达和分泌[22-23]。目前研究多侧重于CHI3L1与ACI患者病情严重程度及短期预后的相关性[24-25],尚鲜有研究探讨CHI3L1与SAP的关联性。本研究结果显示,较高的CHI3L1水平是促进ACI患者发生SAP的独立危险因素,且ROC曲线分析结果显示其预测SAP发生的灵敏度和特异度均高于单一的NLR和hs-CRP指标。然而,由于ACI后机体存在各种病理生理变化,单一的炎症标志物易受影响,NLR、hs-CRP和CHI3L1三种炎症标志物通过不同途径参与了SAP的发生、发展,三指标联合检测可以更全面地反映ACI患者的免疫活性及炎症状态,对ACI患者发生SAP有着更精确的预测作用。本研究结果显示,三指标联合预测SAP的效能较任一单项炎症标志物更高,具有更好的临床指导价值。
3.5本项研究结果还显示心房颤动、吞咽困难、气管插管或机械通气、饮酒史、基线SBP、基线DBP、基线NIHSS评分及FBG与ACI患者发生SAP具有关联性,且基线NIHSS评分、吞咽功能及基线DBP是SAP发生的独立影响因素,与既往报道[26]相似。考虑原因有以下几个方面:(1)高NIHSS评分者常因全身应激反应重、交感神经兴奋、儿茶酚胺含量升高而致血管收缩,肺淤血加重,增加肺部感染的风险。有研究表明,NIHSS评分≥10分者发生SAP的概率约是<10分者的5倍[27]。(2)吞咽功能障碍的患者气道敏感度降低,保护性反射减弱,易使口腔和食管内的分泌物进入肺部和气管从而造成误吸,导致肺部感染的风险增大。包龙梅等[28]研究表明,吞咽困难程度与吸入性肺炎发生率呈正相关,与本研究结果一致。(3)高基线SBP和DBP有利于保证脑血流量和脑组织功能的恢复[29]。这可以部分解释高基线DBP是抑制ACI患者发生SAP的保护性因素。
综上所述,ACI患者SAP总体发生率较高,炎症标志物NLR、hs-CRP、CHI3L1的血清水平升高均与SAP的发生密切相关,三指标联合检测可有效预测SAP发生,有助于临床早期识别高危患者并予以适当的干预治疗,以改善ACI患者的预后。
