ELMO3在胰腺癌中的表达及临床意义研究
2024-03-07贾富鑫郭彩茹刘萌萌刘江伟任国印
贾富鑫, 郭彩茹, 刘萌萌, 刘江伟, 任国印
胰腺癌是消化系统常见的恶性肿瘤,病死率居所有肿瘤的前5位[1],手术治疗是患者获得治愈机会的唯一方式[2-3]。但由于胰腺和周围器官及血管关系密切,肿瘤细胞易出现局部浸润和远端转移,大部分胰腺癌在明确诊断时已丧失手术切除的时机[4-6]。随着外科技术的不断进步,肿瘤根治性切除率也在不断提高,但其诊治现状仍不乐观,患者的预后未得到明显改善[5]。目前,对于胰腺癌的筛查和评估预后尚缺乏特异度或敏感度较高的生物标志物[7]。肿瘤转移相关的吞噬和运动蛋白(engulfment and cell mobility,ELMO)3可激活Ras相关的C3肉毒杆菌毒素底物(Ras-related C3 botulinum toxin substrate,RAC)蛋白,进而促进肌动蛋白丝生长,参与细胞骨架重排,促进肿瘤细胞趋化迁移和侵袭[8]。有研究发现,ELMO3在一些肿瘤中可促进肿瘤细胞增殖、侵袭和转移[9-10]。然而,ELMO3在胰腺癌中的表达水平及临床意义鲜有研究报道。本研究检测ELMO3在胰腺癌中的表达水平,以探讨其与患者临床病理指标及生存预后的关系,现报道如下。
1 资料与方法
1.1临床资料 收集2000年1月至2007年12月于新疆军区总医院(63例)及郑州大学附属洛阳中心医院(65例)经胰腺癌切除术获得的标本128例,另取癌旁(约3 cm)正常胰腺组织标本11例作为对照。纳入标准:(1)术前未接受放、化疗及其他治疗;(2)无相关肿瘤史;(3)经病理学检查确诊为原发性胰腺导管腺癌;(4)癌旁正常胰腺组织经病理检查证实无癌细胞;(5)临床及病理资料完整。排除非原发于胰腺的转移癌及多发癌。通过电话、门诊复诊等方式进行随访,获取患者生存预后信息,随访时间截至2013年12月。本研究获郑州大学附属洛阳中心医院医学伦理委员会批准(批号:LWLL-2023-11-17-1)。
1.2主要试剂与设备 羊抗人多克隆ELMO3抗体购自美国Sigma-Aldrich公司。全蛋白提取试剂盒、5×蛋白上样缓冲液、BCA蛋白浓度测定试剂盒、磷酸缓冲盐溶液(phosphate buffer saline,PBS)购自北京索莱宝科技有限公司。GAPDH抗体、TBST溶液、辣根过氧化物酶标记的羊抗兔IgG H&L、10% SDS-聚丙烯酰胺预制胶、ECL化学发光检测试剂盒购自上海碧云天生物技术股份有限公司。PVDF膜购自Millipore公司。兔二步法染色试剂盒、山羊血清、二氨基联苯胺(diaminobenzidine,DAB)试剂套装、苏木素购自北京中杉金桥生物技术有限公司。PerkinElmer酶标仪(型号:VICTOR X3);Bio-Rad蛋白转印仪(型号:Bio-Rad Mini Trans-Blot);Bio-Rad电泳仪(型号:Bio-Rad Mini-PROTEAN Tetra Systems);荧光显微镜(徕卡,型号:DMI4000B);上海天能凝胶成像仪(型号:Tanon 5200 Multi)。
1.3Western blot法检测ELMO3水平 组织标本经研磨后应用全蛋白提取试剂盒提取总蛋白,离心后取上清液并使用BCA蛋白浓度测定试剂盒测定蛋白浓度。调整各组蛋白浓度一致后取相同总量蛋白,然后加入等体积5×蛋白上样缓冲液,经10 min煮沸变性处理。通过10% SDS-聚丙烯酰胺凝胶电泳(80~120 V)分离蛋白,在300 mA条件下将蛋白转印到PVDF膜上。室温下以5%脱脂奶粉液封闭处理PVDF膜1 h后加入一抗液(ELMO3,1∶1 000;GAPDH,1∶4 000),4 ℃孵育过夜后用TBST溶液洗膜3次,10 min/次。予二抗液孵育1 h后用TBST溶液洗膜3次,10 min/次。通过ECL化学发光法显影,在凝胶成像仪下进行拍照。以GAPDH为内参,使用Image J软件对蛋白条带进行定量分析。重复3次独立实验。
1.4免疫组织化学染色检查及结果判断 严格按照免疫组织化学PV法染色试剂盒说明书进行操作。以石蜡标本制作4 μm切片,置于恒温干燥箱内过夜,经二甲苯和梯度酒精脱蜡至水、抗原修复,3% H2O2去离子水封闭内源性过氧化物酶活性,置于37 ℃水浴箱内孵育10 min,PBS清洗3遍。以非免疫山羊血清封闭非特异性抗原,37 ℃水浴箱内孵育10 min。滴加ELMO3抗体稀释液(1∶100),37 ℃水浴箱内孵育2 h,PBS清洗3遍。滴加二抗液,37 ℃水浴箱内孵育20 min,PBS清洗3次。DAB显色液后予苏木素复染,梯度酒精脱水及中性树胶封片后行镜下观察。在200倍镜下,每张切片随机选取5个视野进行观察,由2位病理科医师独立观片。结合细胞染色程度和阳性细胞百分率进行综合评定,阳性细胞以细胞内出现棕黄色颗粒为标准。依据阳性细胞所占比例计分:≤5%,0分;6%~25%,1分;26%~50%,2分;51%~75%,3分;>75%,4分。根据染色程度计分:淡黄色,1分;黄色或深黄色,2分;褐色或棕褐色,3分。将每个组织染色程度与阳性细胞百分率得分相乘,乘积>1者判定为阳性[11]。
1.5统计学方法 应用SPSS 25.0统计软件进行数据分析。计数资料以例数(百分率)[n(%)]表示,组间比较采用χ2检验。计量资料的组间比较采用成组t检验。采用Kaplan-Meier法绘制生存曲线,以log-rank检验进行组间比较。采用Cox回归分析探讨影响胰腺癌患者预后的因素。P<0.05为差异有统计学意义。
2 结果
2.1胰腺癌组织中的ELMO3表达情况 免疫组织化学染色结果显示,胰腺癌组织中ELMO3主要表达于细胞质中,少数病例出现细胞膜及细胞质同时着色。128例患者的癌组织中ELMO3阳性率为83.59%(107/128),而在癌旁正常胰腺组织中ELMO3阳性率为27.27%(3/11),差异有统计学意义(χ2=16.199,P<0.001),见图1。Western blot检测结果显示,胰腺癌组织ELMO3表达水平显著高于癌旁正常胰腺组织(t=1.205,P=0.001),见图2。

ⓐ胰腺癌组织中ELMO3阳性表达;ⓑ癌旁正常胰腺组织中ELMO3阴性表达
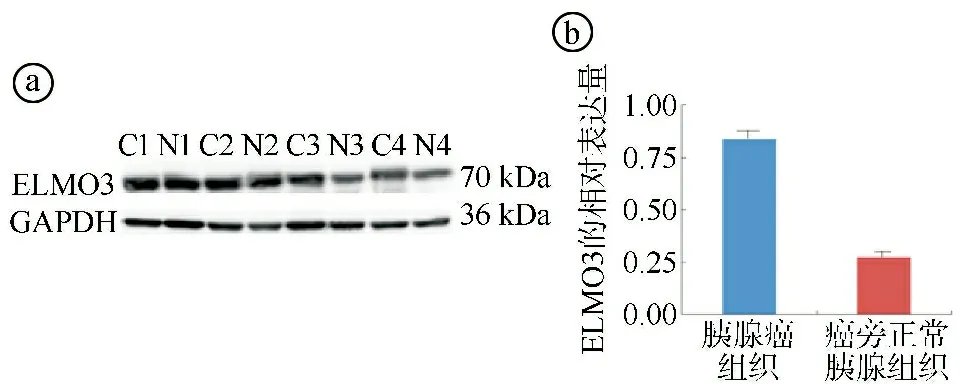
ⓐWestern blot实验结果图(C表示胰腺癌组织,N表示癌旁正常胰腺组织);ⓑ两组ELMO3相对表达量水平比较
2.2胰腺癌患者ELMO3表达情况与临床病理指标的关联性分析结果 ELMO3表达与肿瘤直径、分化程度、TNM分期及淋巴结转移存在显著关联(P<0.05),而与性别、年龄、肿瘤部位及远处转移无显著关联(P>0.05),见表1。
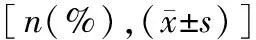
表1 胰腺癌患者ELMO3表达情况与临床病理指标的关联性分析结果
2.3ELMO3表达与患者预后的关系 本组病例随访时间为4~36个月,中位随访时间为18个月,失访8例(其中ELMO3阳性组1例,ELMO3阴性组7例),120例胰腺癌患者获得随访,其中位生存时间为12个月,1年累计生存率为43.3%。ELMO3阳性组中位生存时间短于ELMO3阴性组(11个月 vs 35个月)。ELMO3阴性组生存预后优于ELMO3阳性组(log-rank检验:χ2=58.602,P<0.001),见图3。

图3 ELMO3阳性组和ELMO3阴性组生存曲线图
2.4影响胰腺癌患者生存预后的Cox回归分析结果
单因素Cox回归分析结果显示,肿瘤直径、远处转移、淋巴结转移、分化程度、TNM分期和ELMO3表达情况与患者生存预后存在显著关联(P<0.05)。进一步的多因素Cox回归分析结果显示,ELMO3阳性表达、远处转移以及TNM分期为Ⅲ/Ⅳ期是胰腺癌患者生存预后不佳的独立危险因素(P<0.05),见表2。
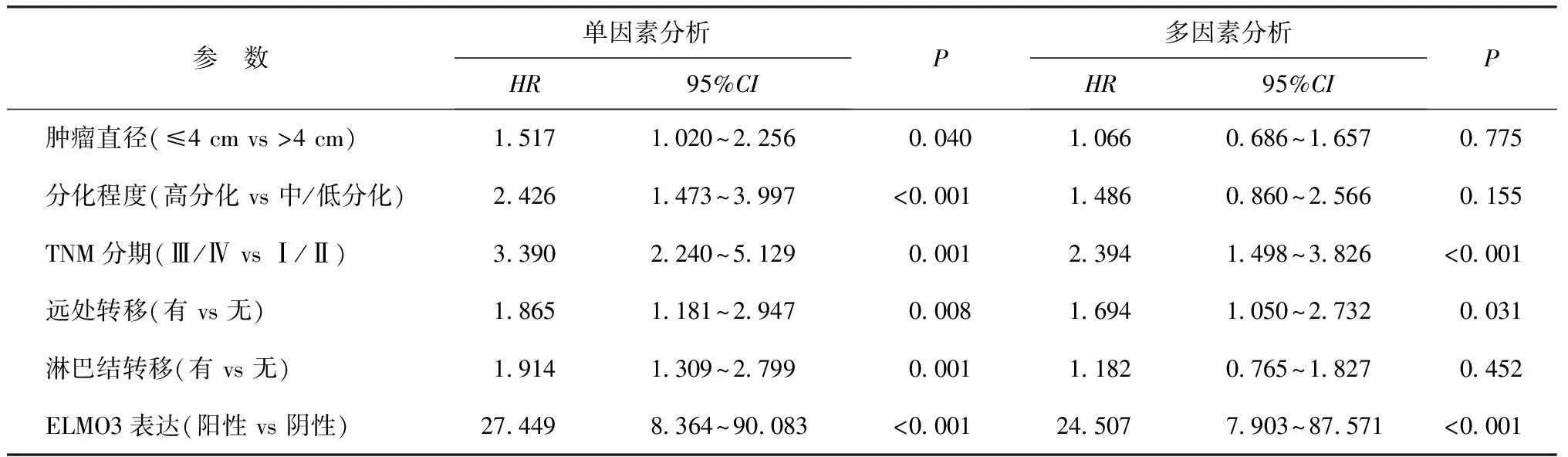
表2 影响胰腺癌患者生存预后的Cox回归分析结果
3 讨论
3.1胰腺癌因早期确诊困难、多耐药性及易转移等因素,患者预后往往较差[5,12],深入探讨胰腺癌的发病机理,寻找其致病规律及关键基因,对胰腺癌的早期诊治和预后评估意义重大。另外,术前新辅助治疗作为胰腺癌治疗新方向,被证实可提高患者根治性切除术后的生存率,有效的肿瘤标志物有助于胰腺癌早期检测及新辅助治疗反应评估,可为患者提供个性化治疗策略并改善肿瘤学结局[13]。
3.2研究发现,由主要结构相似的ELMO1、ELMO2和ELMO3组成的ELMO家族广泛分布于哺乳动物体内,其在细胞骨架重塑和促进肿瘤细胞的运动中起重要作用[14-16]。既往研究大多关注ELMO1和EMLO2的功能,而对ELMO3的研究较少。近年有研究发现ELMO3在一些肿瘤组织中表达上调。Pan等[17]通过黏附和跨孔实验发现ELMO3的小干扰RNA可以通过抑制Lewis肺癌细胞的上皮-间质转化而抑制细胞的侵袭和迁移。Peng等[18]研究发现敲除ELMO3基因可抑制结直肠癌发展和转移。Michaelsen等[10]研究指出,ELMO3在胶质瘤的肿瘤侵袭区域高表达,其在调控RAC1激活、促进肿瘤细胞迁移中发挥关键作用。因此,ELMO3可能是肿瘤侵袭转移的直接驱动因素。Kotowski等[19]研究显示,ELMO3在唾液腺癌组织中高表达,且与患者无病生存率和疾病复发率相关,其可作为评估患者预后的指标。在乳腺癌患者中亦观察到ELMO3高表达与疾病进展及不良预后有关[20]。Hu等[21]认为低ELMO3表达可显著抑制细胞的增殖、侵袭转移、细胞周期调节和F-肌动蛋白聚合过程,可能为胃癌诊断和评估预后的潜在分子标志物。
3.3目前,关于ELMO家族与胰腺癌关系的研究少有报道,且纳入病例数相对较少[22-23]。本研究采用免疫组织化学染色及Western blot法检测ELMO3在128例胰腺癌组织中的表达情况,结果显示ELMO3在胰腺癌组织中呈高表达,提示ELMO3可能是胰腺癌的促癌因子。此外,本研究发现ELMO3与肿瘤直径、分化程度、TNM分期及淋巴结转移存在关联性,提示ELMO3可能与胰腺癌的发生发展有关,这与其在非小细胞肺癌及大肠癌中的研究结果一致[18,24]。生存分析结果显示,ELMO3阳性组中位生存时间短于ELMO3阴性组,ELMO3阳性表达是胰腺癌患者预后不佳的独立危险因素,提示ELMO3可能是胰腺癌早期诊断和预后评估的有效分子标志物,有助于临床医师对患者进行分层管理,改善预后。
综上所述,ELMO3在胰腺癌中呈高表达,其表达与肿瘤直径、淋巴结转移、分化程度及TNM分期等临床病理指标存在关联。ELMO3可能参与了胰腺癌的恶性演变过程及侵袭转移调控,其表达情况与患者生存预后相关。但是,ELMO3在胰腺癌发生发展中的具体细胞功能及分子机制仍待进一步探讨。
