炎症、营养指标与AECOPD患者合并低蛋白血症的相关性分析*
2024-03-06刘海月林益华王佳怡杨菀臻郑怡萱甘仲霖
李 凤,刘海月,林益华,王佳怡,杨菀臻,郑怡萱,甘仲霖△
(1.西南医科大学公共卫生学院,四川泸州 646099;2.厦门大学附属第一医院检验科,福建厦门361000;3.厦门大学附属第一医院呼吸与危重症医学科,福建厦门 361000;4.厦门大学公共卫生学院,福建厦门 361000)
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是以持续气流受限和慢性气道炎症为特征的慢性呼吸系统疾病,有较高的发病率和死亡率,预计到2040年将成为全球主要疾病的死亡原因之一[1-2]。慢性阻塞性肺疾病急性加重期(acute exacerbation of chronic obstructive pulmonary disease,AECOPD)COPD患者短期内临床症状出现持续加重和恶化,给患者家庭及社会经济带来了较大的负担[3-4]。已有研究表明,AECOPD患者低蛋白血症的发生率可达50%以上[5],血清白蛋白(ALB)水平与组织修复、抗感染能力有关,还与临床疾病严重程度、预后、死亡率等相关[6-8]。ALB是由肝细胞合成,常用于评估肝脏功能、渗透压、炎症反应及营养状态的重要指标[9-10]。因此,本研究分析炎症、营养指标与AECOPD患者合并低蛋白血症的相关性,以期能够更精准、高效地为临床治疗和预防提供参考。
1 资料与方法
1.1 一般资料
选取2020年1月至2022年9月于厦门大学附属第一医院呼吸与危重症医学科住院的AECOPD患者214例为研究对象,其中男209例,女5例,年龄50~90岁,平均(71.44±9.00)岁。纳入标准:(1)符合慢性阻塞性肺疾病全球倡议(GOLD)关于《慢性阻塞性肺疾病诊治指南(2021 年修订版)》中AECOPD的诊断标准[11];(2)年龄40岁以上,男女不限。排除标准:(1)伴有严重的自身免疫系统疾病、器官功能障碍、重度感染性疾病;(2)合并恶性肿瘤、肺部手术;(3)实验室检查数据不完整。本研究已取得厦门大学附属第一医院医学伦理委员会批准(2022-067)。
1.2 方法
通过电子病历系统查阅并收集AECOPD患者的年龄、性别、住院时间、过去1年内住院次数、身高、体重,以及有无糖尿病、高血压、冠心病等临床基本资料。临床实验室指标主要收集血常规:血红蛋白、白细胞计数、中性粒细胞计数、淋巴细胞计数、血小板计数等;生化指标:总蛋白、ALB;炎症指标:C反应蛋白、降钙素原、白细胞介素(interleukin,IL)-1β、IL-4、IL-5、IL-6、IL-17A等。计算体重指数(body mass index,BMI)、中性粒细胞与白蛋白比值(neutrophil to albumin ratio,NAR)、中性粒细胞与淋巴细胞比值(neutrophil to lymphocyte ratio,NLR)、血小板与淋巴细胞比值(platelet to lymphocyte ratio,PLR)、全身免疫炎症指数(systemic immune inflammatory index,SII)、预后营养指数(prognostic nutritional index,PNI)。根据AECOPD患者ALB水平分为低蛋白血症组(ALB<35 g/L,n=73)和非低蛋白血症组(ALB≥35 g/L,n=141)。
1.3 统计学处理
2 结 果
2.1 基线资料
两组患者年龄、住院时间、体重比较差异均有统计学意义(P<0.05),而性别、过去1年内住院次数、身高,以及合并糖尿病、高血压、冠心病比例比较差异均无统计学意义(P>0.05),见表1。
2.2 炎症指标
低蛋白血症组C反应蛋白、NAR、NLR、PLR、SII水平明显高于非低蛋白血症组(P<0.05),降钙素原、白细胞计数、IL-1β、IL-5、IL-17A、IL-4、IL-6水平比较差异均无统计学意义(P>0.05),见表2。
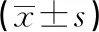
表2 两组炎症指标比较
2.3 营养指标
低蛋白血症组BMI、血红蛋白、总蛋白、PNI水平均明显低于非低蛋白血症组(P<0.05),见表3。

表3 两组营养指标比较

表4 AECOPD患者合并低蛋白血症影响因素的二元logistic回归分析
2.4 炎症指标与营养指标的相关性分析
体重(r=-0.190,P=0.006)、BMI(r=-0.210,P=0.002)、血红蛋白(r=-0.251,P<0.001)、总蛋白(r=-0.456,P<0.001)、PNI(r=-0.475,P<0.001)与AECOPD患者合并低蛋白血症呈负相关,而年龄(r=0.186,P=0.006)、住院时间(r=0.260,P<0.001)、C反应蛋白(r=0.246,P<0.001)、NAR(r=0.508,P<0.001)、NLR(r=0.322,P<0.001)、PLR(r=0.308,P<0.001)、SII(r=0.322,P<0.001)与AECOPD患者合并低蛋白血症呈正相关。
2.5 二元logistic回归分析AECOPD患者合并低蛋白血症的影响因素
将P<0.05的指标作为自变量进行二元logistic回归分析,结果显示PNI、SII、NLR 是AECOPD患者合并低蛋白血症的独立影响因素(P<0.05),见表 4。
3 讨 论
AECOPD是呼吸系统常见的炎症性疾病,炎症反应加速耗能,导致营养状况下降,促使患者肺部、呼吸道感染加重。C反应蛋白属于急性期反应蛋白,正常情况下血清C反应蛋白水平较低,当机体发生感染时会引起C反应蛋白水平迅速升高[12],是临床判定早期炎症的可靠指标[13]。NAR、NLR、PLR、SII是综合中性粒细胞、淋巴细胞、血小板及ALB的新型指标[14-15],能够较好地反映机体炎症与免疫之间的关系,是预测疾病严重程度的新型指标,具有操作方便、稳定性好、易获得等优点。本研究结果显示,低蛋白血症组的C反应蛋白、NAR、NLR、PLR、SII水平明显高于非低蛋白血症组,提示低蛋白血症组较非低蛋白血症组炎症反应重,低蛋白血症组患者住院时间更长,间接说明了低蛋白血症组病情更重。同时,对上述指标进行Spearman相关分析发现,C反应蛋白、NAR、NLR、PLR、SII与AECOPD患者合并低蛋白血症呈正相关,即炎症反应与营养不良互为因果关系。进一步二元logistic回归分析结果发现,SII、NLR是AECOPD患者合并低蛋白血症的影响因素。提示在感染应激状态下,ALB半衰期缩短、分解加速,进一步加重低蛋白血症状态。有研究指出,低蛋白血症的程度反映了机体炎症损伤的程度及死亡风险的大小[16]。因此,ALB水平升高或降低与临床状态改善或恶化有一定的关系。有文献报道炎性因子可通过改变血管的通透性和肌肉代谢来降低ALB水平[17]。本研究结果显示,低蛋白血症组与非低蛋白血症组的炎性因子IL-1β、IL-5、IL-17A、IL-4、IL-6水平并无明显差异,与文献报道不一致,考虑可能与临床检测的样本量小有关,在今后的研究中需要进一步的分析。
由于基础代谢率增加、饮食摄入减少、消化吸收功能障碍、炎症、缺氧和药物使用等因素[18],AECOPD患者的营养不良发生率较高(25%~65%)[13],导致患者生活质量下降、住院时间延长、再住院风险和病死率增加等不良健康事件[19-20]。PNI是一项同时包含ALB和淋巴细胞的免疫-营养学指标,当PNI<45时,提示机体处于营养不良、免疫功能低下的状态[21-22]。BMI、血红蛋白、总蛋白也是临床上判断患者营养状况的重要指标。本研究结果显示,低蛋白血症组的PNI、BMI、血红蛋白、总蛋白水平明显低于非低蛋白血症组。Spearman相关分析结果显示,PNI、BMI、血红蛋白、总蛋白与AECOPD患者合并低蛋白血症呈负相关,这与大多数的研究结果一致[23-25]。二元logistic回归分析发现,PNI是AECOPD患者合并低蛋白血症的影响因素。分析其可能机制:当机体处于营养不良时,免疫细胞、免疫蛋白的合成与代谢受到影响,继而导致免疫功能的下降,感染风险的增加和营养指标的下降[4]。本研究进一步证实了营养状况与AECOPD患者合并低蛋白血症的相关性,即营养不良可能是影响患者疾病进展、急性加重的重要因素。除此以外,长期的营养消耗和应激状态,更容易使患者炎症和低蛋白血症的风险增加,进而影响患者的生存质量。因此,结合本研究,临床上针对AECOPD患者合并低蛋白血症需全面综合的评估营养状况,积极而科学地进行个性化的营养干预,改善患者的营养状态和免疫水平。
综上所述,当AECOPD患者处于低蛋白血症时应注意全面评估患者的炎症指标和营养状态,尽早加强营养干预和支持,及时控制炎症和低蛋白血症状态,提高机体免疫功能,从而改善患者预后、缩短住院时间、减少不良健康事件的发生,提高生活质量。由于本研究为单中心、回顾性、观察性研究,存在一定局限性,未来还需要更多大样本量、多中心联合前瞻性随机研究进行论证。
