放疗在急性白血病合并髓外浸润的疗效和预后分析*
2024-03-06雷文彬卢英豪王凌云王季石
雷文彬,刘 麾,张 燕,卢英豪,黄 懿,陈 莹,高 睿,柴 笑, 詹 云,熊 杰,王凌云,刘 蕾,王季石,赵 鹏△
(1.贵州医科大学,贵阳 550004;2.贵州医科大学附属医院血液科,贵阳 550004;3.贵阳市第一人民医院血液肿瘤科,贵阳550002)
白血病髓外浸润是急性白血病的一种罕见发病形式,其特征为白血病细胞向骨髓以外的组织浸润引起髓外组织白血病细胞异常增殖。白血病髓外浸润可形成实体瘤[1],也可呈弥漫性病变[2],最常见的髓外表现形式包括中枢神经系统白血病(central nervous system leukemia,CNSL)、髓系肉瘤(myeloid sarcoma,MS)、皮肤白血病(leukemia cutis,LC)和睾丸白血病。CNSL是白血病细胞浸润至脑膜或脑实质,使患者表现出相应的神经和/或精神症状,可见于急性白血病病程的任何阶段,预后较差[3-5]。白血病髓外浸润向邻近组织、器官播散、压迫[6],可造成局部症状。全身化疗对髓外病灶效果欠佳,最终会导致骨髓复发[7-9],因此治疗上需要采用局部处理并尽快桥接全身化疗、造血干细胞移植、免疫治疗或靶向药物等联合治疗方法[10]。放疗可对急性白血病的髓外病灶起到较好的控制效果[11],但目前缺乏大规模临床数据支持放疗对于急性白血病合并髓外浸润患者预后的价值。本研究旨在对贵州医科大学附属医院血液科收治的急性白血病合并髓外浸润患者临床资料进行回顾性分析,进一步研究急性白血病合并髓外浸润的临床特点、治疗方案及预后,从而探讨改善此类患者的治疗方法。
1 资料与方法
1.1 一般资料
本研究为单中心回顾性研究。本研究已经得到医院伦理委员会批准(2023伦审第733号),治疗前根据《赫尔辛基宣言》获得了患者的知情同意。选取贵州医科大学附属医院2014年4月至2023年4月经病理组织活检、免疫组织化学、脑脊液细胞学、流式细胞学和影像学综合检查确诊的急性白血病合并髓外浸润的患者。符合以下纳入标准:(1)年龄<65岁;(2)性别不限;(3)急性白血病处于缓解期或髓外浸润确诊时骨髓中未发现白血病细胞,髓外浸润经病理或影像学证实有白血病细胞浸润;(4)中性粒细胞绝对值≥1×109/L,血小板≥50×109/L。排除标准:(1)髓外浸润确诊时骨髓原始细胞>5%;(2)中性粒细胞绝对值<1×109/L,血小板<50×109/L;(3)伴严重心脏功能不全,美国纽约心脏病协会(New York Heart Association,NYHA)分级标准心功能不全Ⅱ级以上,心脏射血分数<45%,伴严重心律失常;(4)伴严重肺功能不全(阻塞性和/或限制性通气障碍);(5)伴严重肝功能受损,肝功能指标(丙氨酸氨基转移酶、总胆红素)>正常值上限(upper limits of normal,ULN)3倍以上;(6)伴严重肾功能不全,肾功能指标肌酐>2倍ULN以上,或24 h尿肌酐清除率<50 mL/min;(7)严重活动性感染;(8)伴精神性疾病不能理解或遵从治疗方案;(9)无法在贵州医科大学附属医院进行系统诊疗和定期随诊。最终符合纳入排除标准的患者共47例,男30例,女17例,男女比例为1.8∶1.0;年龄13~61岁,中位年龄30岁;其中急性髓系白血病(acute myeloid leukemia,AML)26例、急性淋巴细胞白血病(acute lymphoblastic leukemia,ALL)18例、髓系肉瘤2例、浆细胞性白血病(plasma cell leukemia,PCL)1例;髓外浸润的部位中,中枢神经系统(central nervous system,CNS)浸润25例、骨骼及软组织13例、皮肤2例、乳腺2例、肝脏1例、肠道1例、淋巴结1例、卵巢1例、腹部浆膜腔1例。
1.2 方法
1.2.1诊断方法
所有患者在诊断髓外浸润时均完善了骨髓细胞形态学、流式细胞学、遗传学、融合基因及分子生物学检查,针对髓外病灶均进行了局部病灶的细胞学、流式细胞学、病理免疫组织化学检查。根据浸润的不同部位进行CT和/或磁共振成像(magnetic resonance imaging,MRI)和/或正电子发射计算机断层显像(positron emission tomography,PET)/CT评估髓外浸润部位及全身组织受累情况和缓解情况。对有CNS症状的患者行头颅增强核磁共振,以及腰椎穿刺脑脊液常规、生化、流式细胞学及脱落细胞学检查。CNS分级[12]:(1)CNS-1,脑脊液中没有原始细胞或白细胞;(2)CNS-2,脑脊液中存在原始细胞,WBC<5 μL;(3)CNS-3,脑脊液中存在原始细胞且WBC>5 μL,或临床上有CNS受累的体征。
1.2.2治疗方法
根据是否接受过放疗将47例急性白血病合并髓外浸润的患者分为放疗组(23例)和未放疗组(24例)。移植前合并髓外浸润的患者29例,根据移植前采取的减瘤方式分为移植前放疗组(13例)和移植前未放疗组(16例);移植后出现孤立髓外复发的患者18例,根据移植后采取的减瘤方式分为移植后放疗组(10例)和移植后未放疗组(8例)。47例急性白血病合并髓外浸润患者中CNSL 25例,其中单纯接受鞘内注射12例,鞘内注射联合放疗13例,据此分为鞘内注射组与鞘内注射联合放疗组。
放疗组和未放疗组患者均接受了化疗、造血干细胞移植、嵌合抗原受体T细胞免疫治疗(chimeric antigen receptor T-cell immunotherapy,CAR-T)或供者淋巴细胞输注。放疗组的放射中位剂量为24 Gy(16.2~51.7 Gy),放射中位次数为12次(9~31次),两例髓外浸润患者放疗靶区影像见图1。在接受放/化疗时,对出现粒细胞缺乏的患者给予中性粒细胞集落刺激因子支持治疗;发热患者给予经验性抗感染治疗,并根据后续血培养结果调整抗生素或抗真菌药物(部分患者需给予特殊级抗菌药物,即具有作用力强、抗菌谱广,但是不良反应较多且较严重、价格昂贵,长期应用容易导致病原菌产生耐药性的抗菌药物[13]);在治疗过程中对出现血红蛋白<60 g/L的患者,输注去白细胞悬浮红细胞;对出现血小板<20×109/L的患者,输注浓缩血小板。

A:CNSL(处方剂量为24 Gy/12f);B:髓系肉瘤(处方剂量为40 Gy/16f);不同颜色代表目标区域不同的放射剂量。
1.3 随访与观察指标
1.3.1生存指标
总生存时间(overall survival,OS):从髓外浸润确诊之日至死亡之日或末次随访的时间;无进展生存时间(progression-free survival,PFS):从开始针对髓外浸润的治疗之日起至出现经病理确诊新的髓外浸润或急性白血病复发的时间或末次随访的时间或任何原因死亡的时间;无事件生存时间(event-free survival,EFS):从开始针对髓外浸润的治疗之日起至发生严重感染、治疗失败、移植物抗宿主病(graft versus host disease,GVHD)、血液学复发、出现新的髓外浸润、开始新的抗肿瘤治疗、失访或任何原因的死亡之日的时间。
1.3.2缓解标准
CNSL缓解指标[14-15]:(1)缓解,脑脊液中无原始细胞;(2)未缓解,脑脊液中仍存在原始细胞。其他髓外浸润部位缓解指标[16]:(1)完全缓解,通过体格检查、MRI 或 CT 辅助评估局部浸润病灶完全消失;(2)部分缓解,局部浸润病灶较前缩小30%以上或临床症状减轻、缓解(骨骼);(3)未缓解,局部浸润病灶较前无明显缩小,且临床症状无减轻。
1.3.3毒副反应
观察放疗组和未放疗组患者治疗过程中出现的血液学毒性和感染情况。血液学毒性反应发生情况以治疗开始直至末次治疗结束期间血常规检查结果中中性粒细胞绝对值、血小板为依据,判断标准参照WHO的血液学急性、亚急性毒性反应分度标准[17]。成分输血量(U):放疗、化疗期间使用的去白细胞悬浮红细胞与浓缩血小板的数量。粒细胞集落刺激因子使用剂量(μg):放疗或化疗期间,为促进造血重建而使用的粒细胞集落刺激因子剂量。中性粒细胞缺乏时间(d):从放疗或化疗开始至治疗中断或结束后,中性粒细胞绝对值<0.5×109/L的时间。抗生素使用时间(d):放疗组和未放疗组患者治疗后使用抗生素或抗真菌药物的时间。
1.4 统计学处理
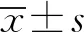
2 结 果
2.1 临床信息
本研究随访截止日期为2023年4月30日,患者中位随访时间7个月(1~36个月)。放疗组与未放疗组患者年龄、性别、民族、初诊时原始细胞计数、疾病诊断、危险分层、髓外浸润部位、CNS分级、移植前有无髓外浸润及是否接受移植相比,差异均无统计学意义(P>0.05),具有可比性,见表1。
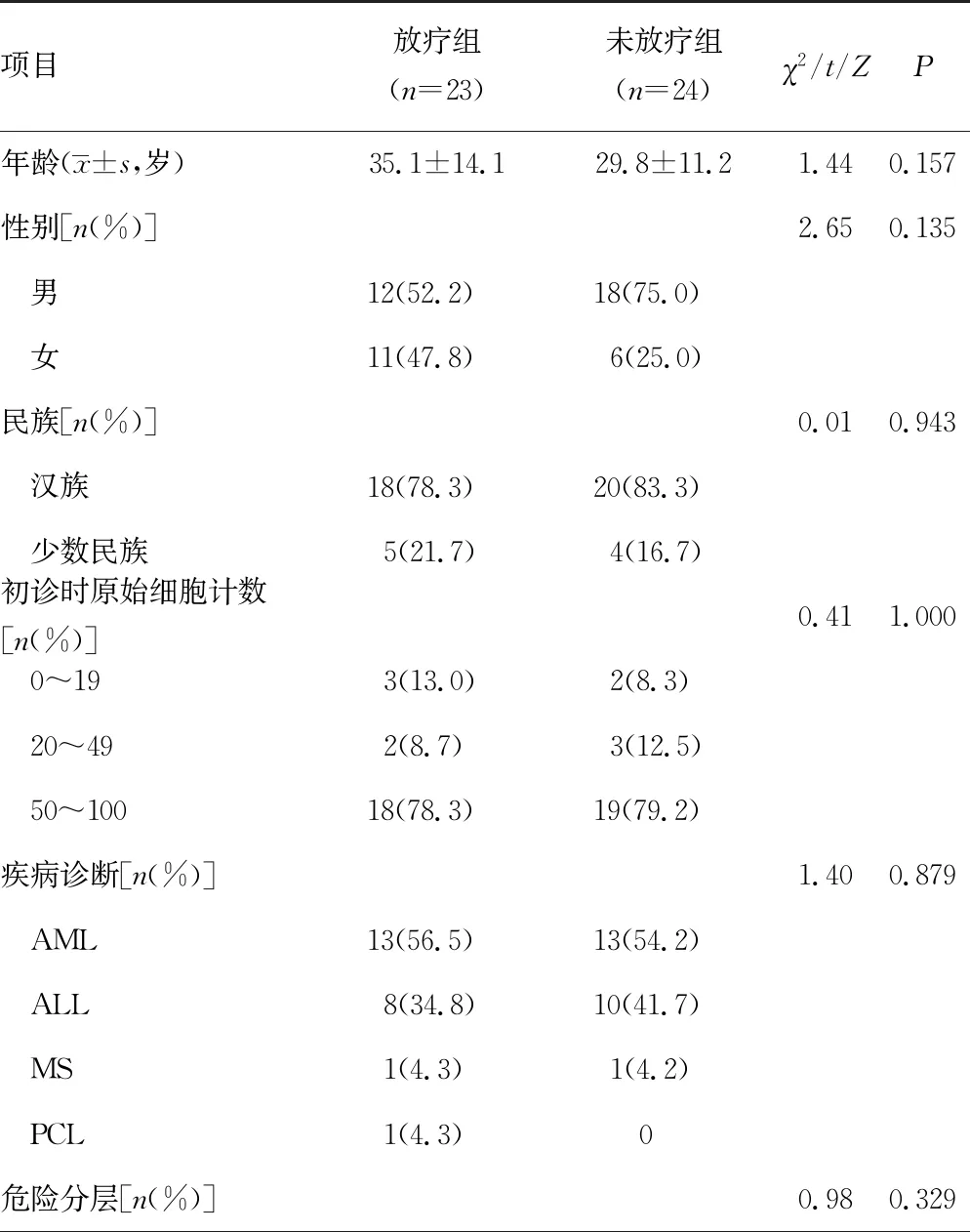
表1 患者临床基本信息及生存状况
2.2 生存分析
2.2.1OS
急性白血病合并髓外浸润患者6个月存活率为56%,1年存活率为38%,至随访结束有16例患者存活,见图2。放疗组OS优于未放疗组(中位OS: 706 dvs.151 d,P=0.015),见图3A。进一步对移植前放疗组与移植前未放疗组、移植后放疗组与移植后未放疗组进行生存分析:移植前放疗组OS优于移植前未放疗组(中位OS:592 dvs.386 d,P=0.035),见图3B;移植后放疗组与移植后未放疗组OS无明显差异(中位OS:252 dvs.112 d,P=0.119),见图3C;移植前放疗组与移植后放疗组OS无明显差异(中位OS:592 dvs.252 d,P=0.128),见图3D。CNSL患者中,鞘内注射联合放疗组OS优于鞘内注射组(中位OS:547 dvs.388 d,P=0.045),见图4。
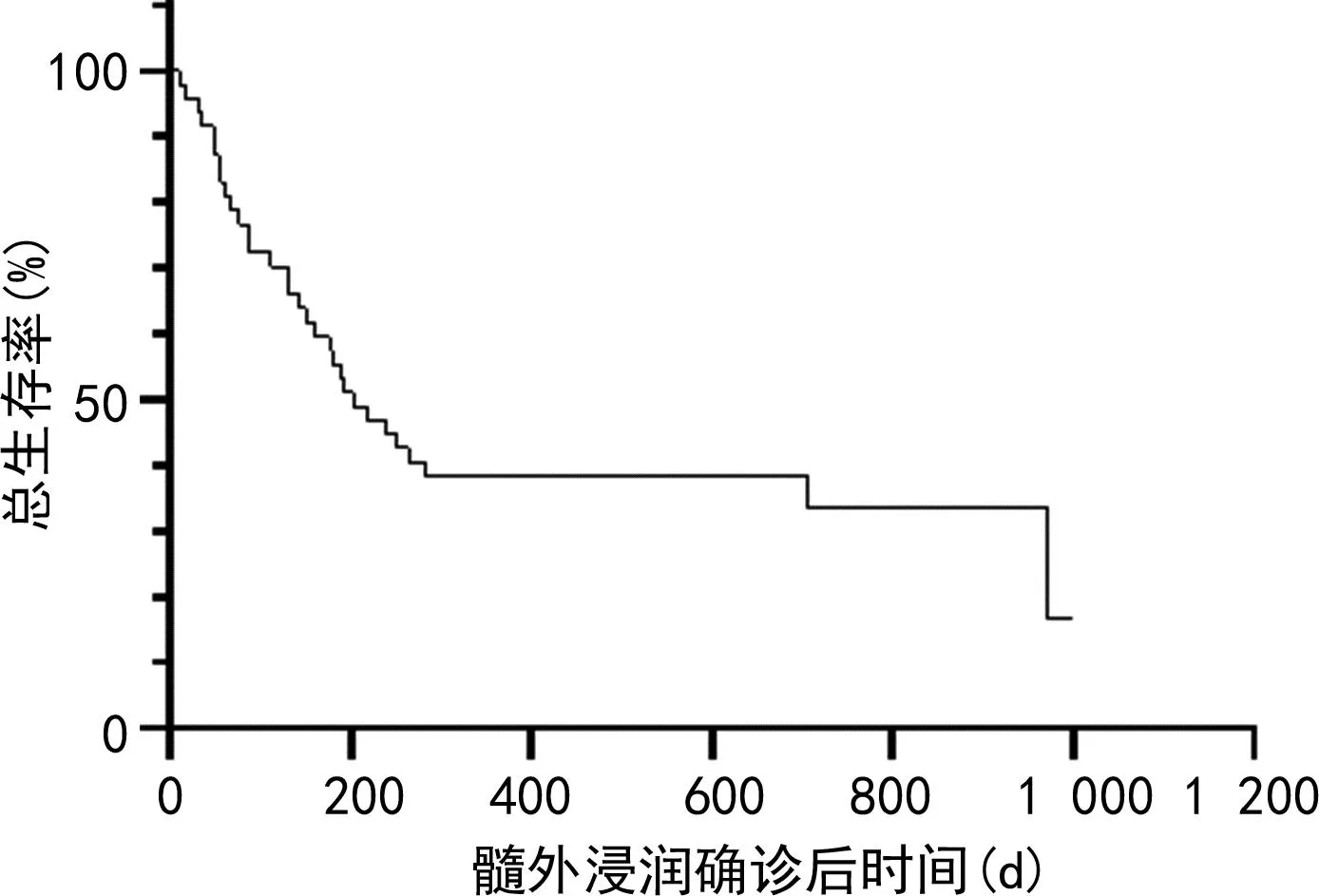
图2 47例急性白血病合并髓外浸润患者OS

A :放疗组与未放疗组OS;B:移植前放疗组与移植前未放疗组OS;C:移植后放疗组与移植后未放疗组OS;D:移植前放疗组与移植后放疗组OS。

图4 CNSL患者OS
2.2.2EFS与PFS
放疗组EFS优于未放疗组(中位EFS:175 dvs.50 d,P=0.005),见图5A;放疗组与未放疗组PFS无明显差异(中位PFS:264 dvs.129 d,P=0.058),见图5B。CNSL患者中,鞘内注射联合放疗组EFS优于鞘内注射组(中位EFS:206 dvs.48 d,P=0.015),见图6A;鞘内注射联合放疗组与鞘内注射组PFS无明显差异(中位PFS:501 dvs.129 d,P=0.087),见图6B。

A:放疗组和未放疗组EFS;B:放疗组和未放疗组PFS。
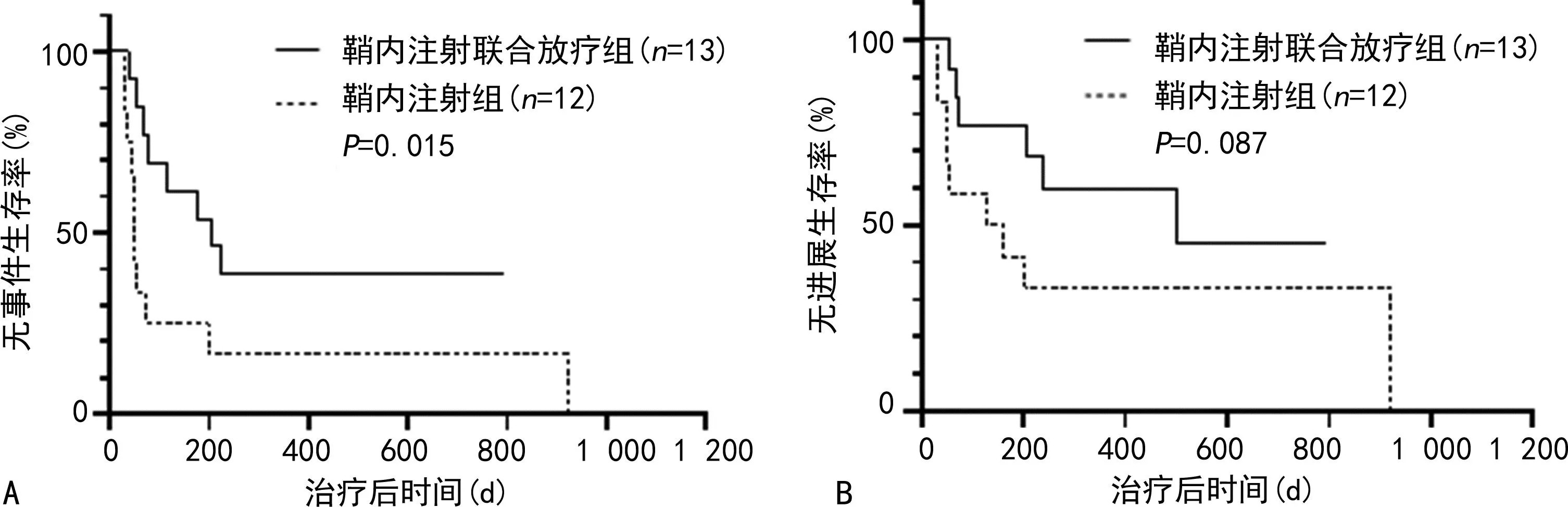
A:鞘内注射联合放疗组与鞘内注射组EFS;B:鞘内注射联合放疗组与鞘内注射组PFS。
2.2.3COX比例风险模型
在移植前放疗组与移植前未放疗组结局事件(OS)的单因素COX比例风险模型中,将治疗方法和患者基线数据各变量分别纳入分析,其中治疗方法的模型系数Omnibus检验P=0.035,成功构建单因素COX比例风险模型。结果发现:治疗方法对OS有明显影响(HR=3.231,95%CI:1.021~10.227,P=0.046),与移植前放疗组相比,移植前未放疗组死亡风险增加2.231倍。年龄、性别、民族、初诊时原始细胞计数、疾病诊断、危险分层、髓外浸润部位、移植前有无髓外浸润、是否接受移植无法构建单因素COX比例风险模型(P>0.05)。
2.3 缓解情况
CNSL患者中,13例接受了鞘内注射联合放疗,均完全缓解;12例仅接受鞘内注射治疗,6例完全缓解,6例未缓解;鞘内注射联合放疗组局部浸润缓解率高于鞘内注射组,差异有统计学意义(100.0%vs.50.0%,χ2=8.55,P=0.005)。其他髓外浸润部位患者,10例接受放疗,其中9例部分缓解,1例未缓解;12例未接受放疗患者,其中2例完全缓解,2例部分缓解,8例未缓解;其他部位浸润患者放疗组局部浸润缓解率高于未放疗组,差异有统计学意义(90.0%vs.33.3%,χ2=11.27,P=0.003)。
2.4 毒副反应
根据放疗组与未放疗组治疗过程中发生的血液学毒性,通过患者实验室指标、成分输血量、中性粒细胞缺乏时间、粒细胞集落刺激因子使用剂量、治疗过程中感染情况、抗生素使用时间、特殊级抗菌药物使用情况进行综合分析:放疗组的血液学毒性程度低于未放疗组,粒细胞集落刺激因子使用剂量、成分输血量少于未放疗组,中性粒细胞缺乏时间、抗生素使用时间短于未放疗组,治疗过程中的感染率、特殊级抗菌药物使用率低于未放疗组,差异均有统计学意义(P<0.05),见表2。

表2 放疗组与未放疗组的血液学毒性管理及抗生素使用情况
3 讨 论
急性白血病合并髓外浸润的治疗策略在很大程度上取决于髓外浸润的部位、有无压迫症状、是否同时伴骨髓原始细胞增多及出现髓外浸润时的疾病状态,放疗对不同髓外浸润部位效果亦不相同。TSIMBERIDOU等[18]在长达12年的回顾性研究中发现,放疗联合化疗能延长髓外急性白血病患者的PFS,但5年生存率没有明显差异。WU等[12]认为放疗对局部病灶通常是有益的,特别是对于化疗难以缓解的患者,与同样接受放疗的患者相比,仅接受化疗的患者5年总存活率明显降低。本研究结果显示,接受过放疗的急性白血病合并髓外浸润患者的局部缓解率明显高于未接受过放疗的患者,OS优于未接受过放疗的患者,且CNSL患者中鞘内注射联合放疗组OS、EFS均优于鞘内注射组,与上述文献结果类似。COX比例风险模型也显示,相较于移植前先进行放疗的患者,移植前针对髓外病灶采用化疗、手术、造血干细胞移植、CART或靶向药物等治疗方式而未接受放疗患者死亡风险增加了2.231倍。本研究所定义的EFS中“事件”以感染、GVHD、疾病复发和死亡最常见,其中感染与血液学毒性反应关系密切,而疾病的复发受局部治疗和全身治疗的效果影响。放疗组的EFS优于未放疗组,表明放疗具有更低的血液学毒性、较低的感染风险和更好的局部病灶控制效果。放疗组与未放疗组PFS无明显差异,分析其可能原因:(1)放射剂量的选择尚无统一标准;(2)放疗后的桥接治疗方法尚未统一;(3)髓外浸润患者本身预后较差,无标准治疗手段。根据国际淋巴瘤放射肿瘤学小组的指南建议[11],本研究中大多数患者采用的放疗总剂量为24 Gy,单次剂量为2 Gy,分12次进行放疗,在控制局部病灶的同时毒副作用也较小。HOELZER等[19]认为髓外浸润复发率高的原因可能是治疗强度较低,即与放射剂量不足有关。DABAJA等[20]报道的19例纵隔浸润患者予以26~39 Gy剂量放疗,未发现复发。因此,更高强度的局部治疗可获得更好的疾病控制效果,这一观点部分解释了为何本研究中接受放疗的急性白血病合并髓外浸润患者与未接受放疗的患者PFS无明显差异。因此,髓外浸润的放疗剂量有待进一步扩大样本量、根据不同髓外浸润部位的性质来决定。
随着急性白血病疗效的提高,接受移植患者比例的增加,移植预后的改善,治疗的毒副反应成为值得关注的重点。血液学毒性反应是放疗与化疗的主要毒副作用之一,中性粒细胞减少、血小板减少是最常见的血液学不良事件[21],其减少程度和持续时间与患者感染、出血甚至死亡风险密切相关[22]。在本研究中,约95%(42/44)的患者在接受了化疗或放疗后出现不同程度的血液学毒性,与文献报道一致[23-24]。并且,放疗组患者的血液学毒性程度低于未放疗组患者,放疗组患者的成分输血量和粒细胞集落刺激因子使用剂量也更少。此外,感染也是影响急性白血病合并髓外浸润患者预后的危险因素[25],放疗组患者的治疗过程中感染率和特殊级抗菌药物使用率也更低,抗生素使用时间更短。相比化疗,放疗患者具有更低的血液学毒性反应、感染和出血风险,这不但有利于减少患者在疾病治疗过程中的住院时间、感染风险,也会降低患者的经济负担,有助于提高患者诊疗的依从性。
由于急性白血病合并髓外浸润罕见,关于髓外浸润患者治疗和预后的队列研究很少,放疗对OS的积极作用仍存在争议。故本研究存在以下不足:(1)病源少,病例收集时间跨度大,治疗方案随时代更迭可能会导致患者的预后分析存在偏倚;(2)本研究治疗组分配不是随机,不同类型急性白血病和不同部位的髓外浸润部位具有异质性,部分患者在放疗后桥接造血干细胞移植等治疗,放疗对生存获益的结果可能存在偏倚,因此有待继续扩大样本量,根据不同的急性白血病类型、不同浸润部位进行亚组分析;(3)本研究为单中心回顾性研究,有待积累更大规模数据,开展多中心的随机对照研究,增加放疗改善髓外浸润患者预后的可信度。
综上所述,放疗可迅速缓解急性白血病合并髓外浸润患者的局部症状,且血液学毒性、感染和死亡风险较低。早期放疗的介入,可短期内降低局部肿瘤负荷,为后续桥接如化疗、靶向治疗、造血干细胞移植、CAR-T等挽救治疗争取宝贵时间。
