氮掺杂碳包覆的氧化镍和钼酸镍复合材料用于尿素氧化电催化
2024-03-05徐立强张玉冰王新星
徐立强,杨 星,张玉冰*,王新星*
(1.青岛科技大学 化学与分子工程学院,山东 青岛 266042;2.贵州红星发展股份有限公司,贵州 安顺 561206)
随着传统化石燃料的消耗,能源危机日益加剧,发展新能源以及能源转化技术变得越来越重要。由于尿素具有稳定性好、能量密度高以及来源丰富等优点,基于尿素的能量转化技术,如尿素电解制氢和尿素燃料电池等,近年来引起了人们的关注[1-4]。尿素氧化反应(UOR)是上述能量转化技术中的一个核心反应。与传统电解水所用的析氧反应(OER,1.23 V)相比,UOR 的理论电位仅为0.37 V 。此外,将其作为阳极构成直接尿素燃料电池,理论电位为1.15 V,非常接近氢燃料电池的理论开路电压(1.23 V)。而且,尿素在污水中的含量高,利用电解法去除废水中的尿素可有效避免尿素分解释放氨造成环境污染。因此,发展基于尿素的能量转化技术既能提高能量转率又能净化污水,一举两得。然而,UOR的6电子转移过程(CO(NH2)2+6OH-=N2+5H2O+CO2+6e-)造成自身动力学缓慢,限制了其实际应用[5-10]。因此需要研发高催化活性和高稳定性的催化剂材料。
贵金属材料虽然显示出了不错的催化性能,但是稀缺性和高成本严重限制了其在实际生产中的应用。BOTTE等[11-13]证明了镍(Ni)在碱性环境中表现出比一些贵金属(如铂、铱和铑)更好的UOR 催化性能。从那时起,大量的Ni基材料被开发和研究用于碱性介质中UOR 的高效电催化。此外,他还提出了Ni基催化剂的UOR 催化机理(间接电化学-化学机理):金属Ni或Ni氢氧化物(氧化物)首先被氧化成Ni3+OOH 中间体,然后该中间体与尿素反应生成CO2和N2,同时Ni3+OOH 中间体被还原成Ni2+或金属态。在此过程中,Ni3+OOH 中间体作为催化UOR 的活性物质[14-17]。目前,LaNiO3[18-20]、NiMoO4、NiMnO4[21-25]和Ni(OH)2等Ni基材料已被研究用于催化UOR。但是很多催化剂都存在稳定性和导电性差的问题,极大限制了其实际的应用。因此,需要研制具有高导电性和稳定性的新型UOR 催化剂。
氮掺杂可以优化反应中间体的吸附能,削弱CO2和活性位点之间的结合强度,从而减轻CO2中毒;同时,也可以促进活性Ni3+的原位转化,从而提高UOR 催化活性。碳包覆结构可以阻止电活性材料的浸出和聚集,保留电化学活性位点,且能够提高催化剂的毒化中间体去除效率,从而提高催化剂稳定性。NiO 和NiMoO4的协同效应提高了催化剂的电催化活性。几方面共同作用,协同提高了催化剂的UOR 电催化效果。本工作通过分步水热以及退火的方法合成了氮掺杂碳包覆的NiO 和Ni-MoO4复合材料(C-N@NiO-NiMoO4),并将其负载于泡沫镍(NF)上用作UOR 电催化剂。
1 实验部分
1.1 试剂与仪器
二水合钼酸钠,麦克林生化科技有限公司;2-甲基咪唑、六水合硝酸镍(Ⅱ)、尿素、氢氧化钾,国药集团化学试剂有限公司。
X 射线衍射仪,D-MAX 2500/PC 型,日本理学公司;激光显微拉曼光谱仪,inVia型,英国雷尼绍公司;透射电子显微镜,JEM-2100PLUS型,日本电子公司;X 射线光电子能谱仪,ESCALAB XI+型,赛默飞(中国)。
1.2 C-N@NiO 的制备
将六水合硝酸镍(Ⅱ)(109 mg,0.375 mmol)溶解在3 mL 超纯水中,并缓慢滴加到溶有2-甲基咪唑(123 mg,1.5 mmol)的7 mL 水溶液中,持续搅拌10 min。将上述溶液转移至反应釜中,然后在160 ℃下加热6 h,得到的产品用超纯水和乙醇分别洗涤两次并真空干燥,干燥产物记为NiMOF。将NiMOF置于管式炉中,在氮气氛围下以600 ℃的温度退火2 h。得到的产物记为C-N@NiO。
1.3 NiMoO4 的制备
将六水合硝酸镍(Ⅱ)(109 mg,0.375 mmol)溶解在3 mL超纯水中,并缓慢滴加到溶有二水合钼酸钠(91 mg,0.375 mmol)的7 mL 水溶液中。其余制备过程与C-N@NiO 的制备过程相同,最后得到的退火产物记为NiMoO4。
1.4 C-N@NiO-NiMoO4 的制备
首先,称取50 mg NiMoO4加入到溶有2-甲基咪唑(123 mg,1.5 mmol)的7 mL水溶液中并超声分散。然后,将六水合硝酸镍(Ⅱ)(109 mg,0.375 mmol)溶解在3 mL 超纯水中,并将其滴加到上述含有NiMoO4的水溶液中并持续搅拌10 min。后续水热及退火过程与C-N@NiO 的相同。最后得到的产物记为C-N@NiO-NiMoO4。
1.5 工作电极的制备
泡沫镍(NF)的前处理:依次用3 mol·L-1盐酸溶液、去离子水和无水乙醇超声清洗NF(1 cm ×1 cm)各10 min,然后真空干燥。
将含有催化剂材料的分散液滴涂在NF上用于制备工作电极进行电化学测试。具体做法为:称取5 mg的催化剂粉末加入到由400 μL 乙醇、80 μL超纯水和20 μL Nafion组成的混合溶液中,超声处理10 min,以获得高分散的催化剂分散液。然后,将上述分散液(200 μL)滴加到1 cm × 1 cm 的NF上,干燥后的负载量为(2.2±0.3) mg·cm-2。根据滴涂的催化剂材料的不同,将电极分别记为C-N@NiO/NF、NiMoO4/NF和C-N@NiO-NiMoO4/NF。
1.6 电化学测试
所有的电化学测试均由CHI 660E 电化学工作站采用标准三电极系统进行,其中载有活性物质的NF直接作为工作电极,铂片(1 cm × 1 cm)电极作为对电极,Hg/HgO 电极作为参比电极。电极电位通过能斯特方程:ERHE=EHg/HgO+0.059 × pH 转换为相对于可逆氢电极(RHE)的电位。在测试之前,每个工作电极均在1.01~1.86 V 的电位区间内以100 mV·s-1的扫速活化至性能稳定。线性扫描伏安法(LSV)曲线是在电解质溶液中以20 mV·s-1的扫速测试得到的。所有电化学测试曲线均未进行iR 补偿处理。交流阻抗谱图(EIS)是在1.36 V 下测量的,频率范围从100 kHz到0.01 Hz,振幅为5 mV。长期稳定性采用计时电位法测试。双电层电容(Cdl)是根据不同扫速(10、20、30、40 和50 mV·s-1)下非法拉第区域的循环伏安(CV)曲线计算得到(1.01 V)。
2 结果与讨论
2.1 材料表征
通过TEM 对C-N@NiO-NiMoO4的形貌进行了表征。图1 显示C-N@NiO-NiMoO4复合材料是由NiO 纳米颗粒和NiMoO4纳米线组成[26-27]。NiO 纳米颗粒和NiMoO4纳米线的尺寸分别为65和5 nm 左右。HR-TEM 图(图2(a))中显示出清晰的晶格条纹,晶面间距为0.235和0.360 nm,分别与NiO 的(1 1 1)晶面和NiMoO4的(-1 1 2)晶面很好地匹配。这表明NiO 和NiMoO4被成功制备并良好地复合。图2(b)的HR-TEM 图中可以观察到NiO 纳米颗粒表面的石墨层结构[24],证明了碳包覆结构的存在。

图1 C-N@NiO-NiMoO4 的TEM 照片Fig.1 TEM images of C-N@NiO-NiMoO4

图2 C-N@NiO-NiMoO4 的HR-TEM 照片Fig.2 HR-TEM image of C-N@NiO-NiMoO4
采用XRD 技术对3种催化剂的晶体结构进行了表征,见图3。如图3所示,对于C-N@NiO,其在37.25°、43.29°、62.90°、75.39°以及79.47°的衍射峰分别对应于NiO 的(1 1 1)、(2 0 0)、(2 2 0)、(3 1 1)和(2 2 2)晶面(ICDD00-004-0835)。Ni-MoO4在14.34°、24.02°、25.40°、28.91°、43.97°以及47.51°的衍射峰分别对应于α-NiMoO4(PDF#86-0361)的(1 1 0)、(0 2 1)、(-1 1 2)、(2 2 0)、(3 3 0)和(-2 0 4)晶面。C-N@NiO-NiMoO4显示出C-N@NiO 和NiMoO4具有的所有特征峰,这说明通过该制备方法可以成功将C-N@NiO 和Ni-MoO4复合。此外,3种材料均显示出尖锐的峰形,表明材料具有良好的结晶度。图4为C-N@NiONiMoO4的拉曼光谱。如图4所示,在1 365 cm-1以及1 560 cm-1处显示了石墨碳的特征D 带和G带,说明C-N@NiO-NiMoO4材料具有石墨碳层结构。这与图2(b)的结果一致,再次证明了碳包覆结构的存在。这种石墨碳包覆结构有助于提高材料的导电性,加快电子转移并能防止电活性材料的浸出和聚集,保留电化学活性位点以增加耐久性。

图3 C-N@NiO、NiMoO4 和C-N@NiO-NiMoO4 的XRD谱图Fig.3 XRD patterns of C-N@NiO,NiMoO4 and C-N@NiO-NiMoO4

图4 C-N@NiO-NiMoO4 的拉曼光谱Fig.4 Raman spectrum of C-N@NiO-NiMoO4
为了进一步研究C-N@NiO-NiMoO4的组成和元素化学态,采用XPS技术进行了表征,见图5。如图5(a)所示,C-N@NiO-NiMoO4的表面由C、N、O、Ni和Mo元素组成。其中,在C 1s的XPS谱图中,284.8、286.1 和288.7 eV 的峰分别对应于C-C sp2、C-C sp3和C-N 的组合以及NO 中存在的C(图5(b)所示)[27],这表明C-N@NiO-Ni-MoO4中存在氮掺杂。从图5(c)所示的Mo 3d谱图中可以观察到位于231.4 和234.5 eV 的Mo4+3d5/2和Mo4+3d3/2峰以及位于233.0和236.2 eV的Mo6+3d5/2和Mo6+3d3/2峰[26]。Ni 2p 的XPS谱图(图5(d))显示,其在856.4和 874.3 eV 处有两个特征峰,分别对应于Ni2+2p3/2和 Ni2+2p1/2自旋轨道[32]。它们的卫星峰在862.9和880.7 eV 被观察到。此外,在853.4 和871.5 eV 处还观察到Ni02p3/2和 Ni02p1/2的特征峰[27]。少量的Ni0为碳化期间产生。通过上述分析,可以进一步确定该复合材料是由氮掺杂碳包覆的NiO和NiMoO4组成。
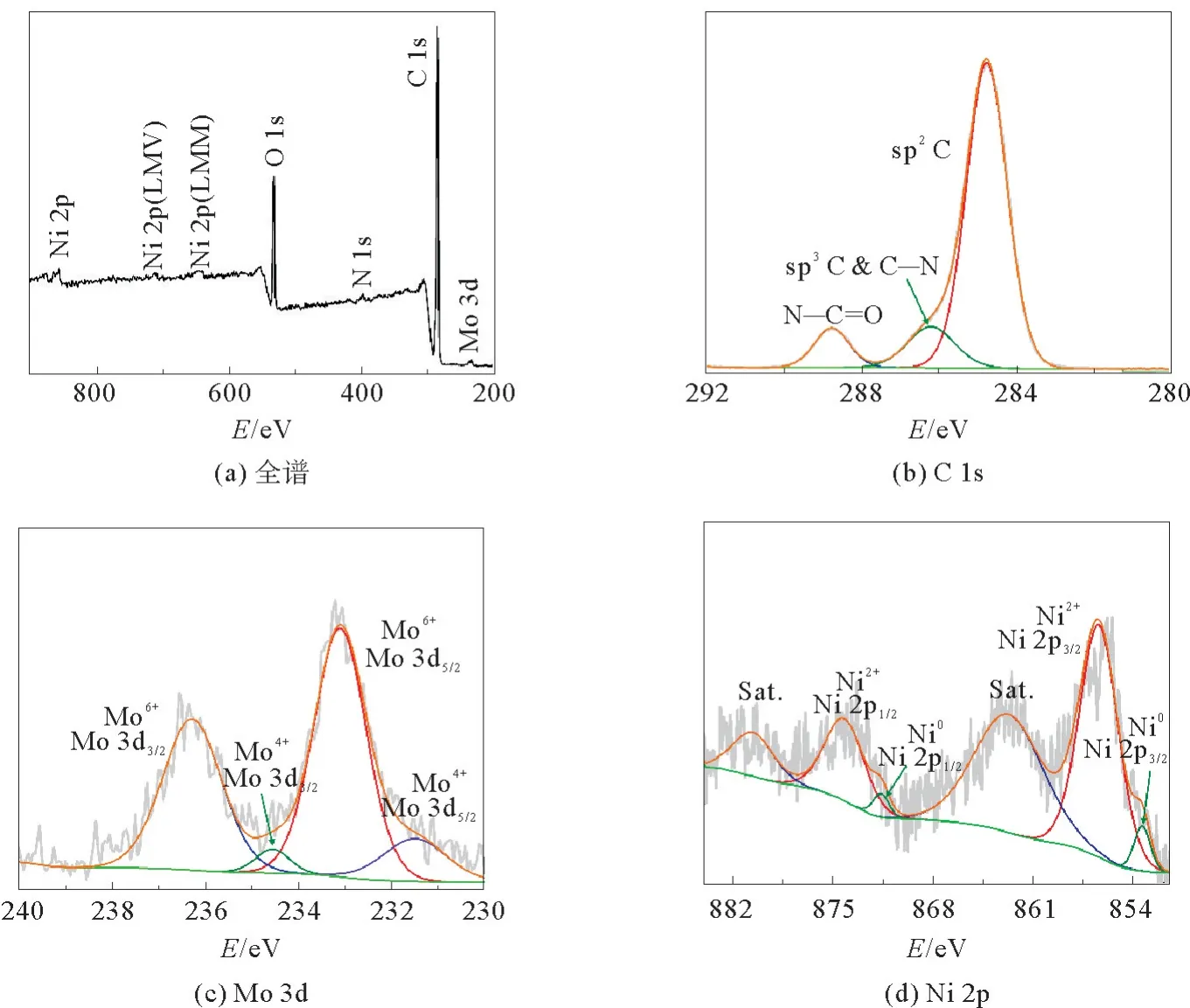
图5 C-N@NiO-NiMoO4 的XPS全谱谱图和C 1s,Mo 3d,Ni 2p XPS高分辨谱图Fig.5 Full XPS spectra and high-resolution C 1s,Mo 3d and Ni 2p XPS spectra of C-N@NiO-NiMoO4
2.2 UOR电催化表现
采用LSV 测试技术对C-N@NiO-NiMoO4/NF的UOR 催化表现进行了评估,见图6。如图6所示,在1.0 mol L-1KOH 溶液中,C-N@NiO-Ni-MoO4/NF的LSV 曲线在1.375 V 出现了一个氧化峰,该峰对应于反应NiO+OH-→ NiOOH +e-,表明有活性位点NiOOH 形成[27-32]。尿素分子被加入KOH 溶液后,电流密度从1.332 V 开始迅速增大,这说明尿素分子被氧化。因为电流密度显著增强,NiO → NiOOH 的氧化峰被掩盖。UOR 的起始电位(1.332 V)与NiOOH 开始形成的电位重合,这进一步证明了NiOOH 是催化UOR 反应的活性位点[33]。此外,可以看到,在1.718 V 处电流密度开始下降,这是由于活性位点被形成的尿素氧化中间产物(CO 或CO2)毒化所致。所形成的峰被称为尿素氧化的阳极峰,阳极峰电位为1.718 V。根据文献报道[33],高的阳极峰电位表明催化剂具有较高的抗中毒性,而阳极峰电流密度的增加表明催化剂具有更高的催化活性。图7 对C-N@NiO/NF、NiMoO4/NF 和C-N@NiO-NiMoO4/NF 在 含有0.33 mol L-1尿素的1.0 mol L-1KOH 溶液中的LSV 曲线进行了比较。如图所示,3 个电极的LSV 曲线中均显示出尿素氧化的阳极峰。其中,CN@NiO-NiMoO4/NF具有最高的阳极峰电流密度和最大的峰电位。C-N@NiO/NF、NiMoO4/NF和C-N@NiO-NiMoO4/NF的阳极峰电流密度分别为21.62、96.38和155.46 mA·cm-2,峰电位分别为1.528、1.633和1.718 V。该结果表明,C-N@NiONiMoO4/NF具有较C-N@NiO/NF和NiMoO4/NF更高的催化活性和更优的抗中毒性。另外,C-N@NiO-NiMoO4/NF达到50 mA·cm-2的电流密度时需要的电位为1.450 V,显著低于NiMoO4/NF(1.477 V)和C-N@NiO/NF(电流密度未达到50 mA·cm-2)。这进一步证明C-N@NiO-Ni-MoO4/NF具有最佳的催化性能。
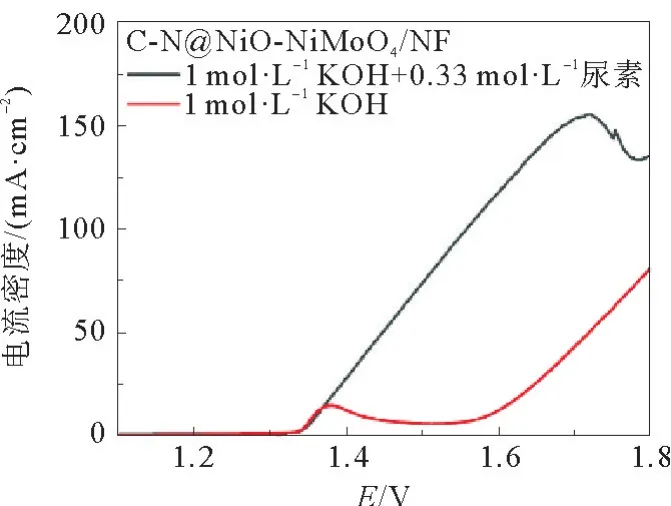
图6 C-N@NiO-NiMoO4/NF在含有和不含有0.33 mol·L-1尿素的1.0 mol·L-1 KOH 溶液中的LSV曲线Fig.6 LSV curves of C-N@NiO-NiMoO4/NF in 1.0 mol·L-1 KOH solution with and without 0.33 mol·L-1 urea

图7 C-N@NiO/NF、NiMoO4/NF和C-N@NiO-NiMoO4/NF在含有0.33 mol·L-1 尿素的1.0 mol·L-1 KOH 溶液中的LSV曲线Fig.7 LSV curves of C-N@NiO/NF,NiMoO4/NF,and C-N@NiO-NiMoO4/NF in 1.0 mol·L-1 KOH solution containing 0.33 mol·L-1 urea
图8为C-N@NiO/NF、NiMoO4/NF和C-N@NiO-NiMoO4/NF在含有0.33 mol·L-1尿素的1.0 mol·L-1KOH 溶液中以100 mV·s-1扫速扫描获得的CV 曲线。各CV 曲线图中,正向扫描时得到的阳极峰为尿素的氧化峰,反向扫描得到的阳极峰为吸附在催化剂表面的尿素氧化中间产物的氧化峰[34-35]。根据文献,正向和反向扫描中两个阳极峰的比值可被用作反映中毒/中间产物去除效率的指标[34,36]。C-N@NiO/NF、NiMoO4/NF和C-N@NiO-NiMoO4/NF 的比值分别为1.15、0.89 和1.24。较高的比值表明能更有效的去除催化剂表面的中毒物质(CO 或CO2)。该结果表明C-N@NiO/NF和C-N@NiO-NiMoO4/NF 均具有较高的中间产物去除效率。这对于增强催化剂的长期稳定性极为重要。C-N@NiO-NiMoO4/NF良好的抗中毒性可能主要归因于其氮掺杂的碳包覆结构。氮的掺杂可以削弱中间产物与活性位点之间的结合强度,从而加速了其解吸[24]。碳包覆结构可以阻止电活性材料的浸出和聚集,保留电化学活性位点。两方面的共同作用协同提高了C-N@NiO-NiMoO4/NF的长期稳定性。
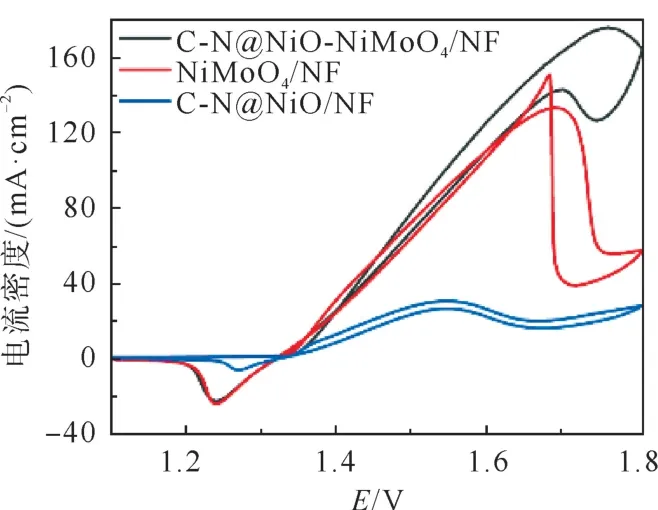
图8 C-N@NiO/NF、NiMoO4/NF和C-N@NiO-NiMoO4/NF在含有0.33 mol·L-1 尿素的1.0 mol·L-1 KOH 溶液中的CV曲线Fig.8 CV curves of C-N@NiO/NF,NiMoO4/NF,and C-N@NiO-NiMoO4/NF in 1.0 mol·L-1 KOH solution containing 0.33 mol·L-1 urea
为了研究3种催化剂的反应动力学,对其进行了Tafel斜率和电化学阻抗测试。图9展示了3种催化剂的Tafel斜率。如图所示,C-N@NiO-Ni-MoO4/NF(25.60 mV·dec-1)的Tafel斜率低于NiMoO4/NF(39.64 mV·dec-1)和C-N@NiO/NF(62.62 mV·dec-1)。这表明,C-N@NiO-Ni-MoO4/NF 上表现出更快的UOR 反应速率。Nyquist谱图及其放大图如图10所示。可以看到,C-N@NiO 的前体NiMOF 负载的NF 电极(Ni-MOF/NF)显示出最大的半圆弧,具有最大的电荷转移电阻(Rct)。与其相比,C-N@NiO/NF 的Rct显著减小。这说明经过退火处理形成碳包覆结构有助于减小材料的Rct,提高材料的导电性。其中,CN@NiO-NiMoO4/NF 的Rct最小,这有利于催化剂和电解质界面的电子转移。该结果与上述Tafel斜率的结果一致,为其快速的反应动力学提供了解释。

图9 C-N@NiO/NF、NiMoO4/NF和C-N@NiO-NiMoO4/NF在含有0.33 mol·L-1 尿素的1.0 mol·L-1 KOH 溶液中的Tafel图Fig.9 Tafel plots of C-N@NiO/NF,NiMoO4/NF,and C-N@NiO-NiMoO4/NF in 1.0 mol·L-1 KOH solution containing 0.33 mol·L-1 urea

图10 NiMOF/NF、C-N@NiO/NF、NiMoO4/NF和C-N@NiO-NiMoO4/NF在含有0.33 mol·L-1尿素的1.0 mol·L-1 KOH 溶液中的Nyquist谱图Fig.10 Nyquist plots of NiMOF/NF,C-N@NiO/NF,NiMoO4/NF,and C-N@NiO-NiMoO4/NF in 1.0 mol·L-1 KOH solution containing 0.33 mol·L-1 urea
此外,通过计算双电层电容(Cdl)对3个电极的电化学活性表面积(ECSA)进行了比较。图11 和图12 为C-N@NiO/NF、NiMoO4/NF 和C-N@NiO-NiMoO4/NF在非法拉第电位区间以不同扫速测试获得的CV曲线图。根据图12计算得到C-N@NiO-NiMoO4/NF的Cdl值为1.11 mF·cm-2,高于C-N@NiO/NF(0.46 mF·cm-2)和NiMoO4/NF(0.81 mF·cm-2)。更高的Cdl值表明C-N@NiONiMoO4/NF具有更大的ECSA 和更多暴露的活性位点。
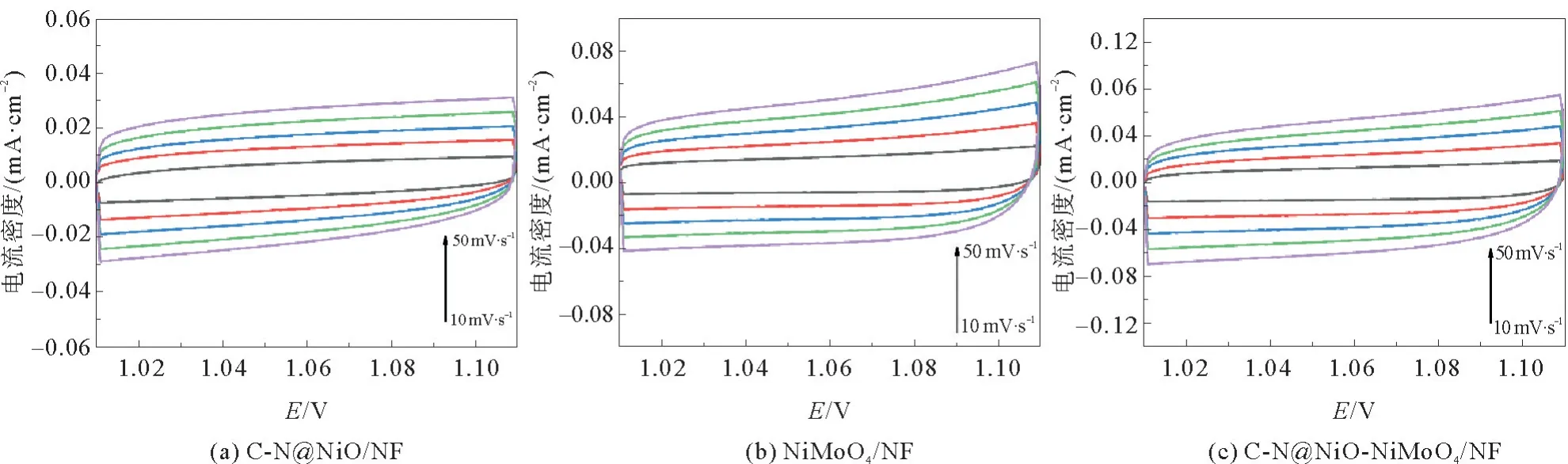
图11 C-N@NiO/NF,NiMoO4/NF和C-N@NiO-NiMoO4/NF在不同扫速下的CV曲线Fig.11 CV curves of C-N@NiO/NF,NiMoO4/NF,and C-N@NiO-NiMoO4/NF at different scan rates
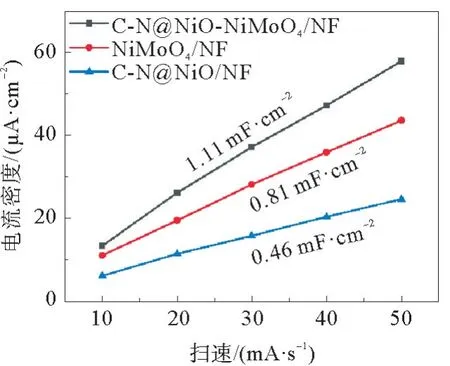
图12 NiMOF/NF,NiMOF-Fc/NF和NiCoMOF-Fc/NF的电容电流密度-扫速图Fig.12 Capacitive current density plotted against various scan rates for NiMOF/NF,NiMOF-Fc/NF and NiCoMOF-Fc/NF
根据上述研究结果,C-N@NiO-NiMoO4/NF更高的UOR 催化活性主要归因于其更快的电荷传递能力和更大的电化学活性表面积,这使得其显示出更快的UOR 反应速率和更多活性位点。研究结果表明,C-N@NiO 和NiMoO4复合产生了协同作用,使得C-N@NiO-NiMoO4/NF 具有较C-N@NiO/NF和NiMoO4/NF显著提升的催化性能。
最后,还对C-N@NiO-NiMoO4/NF 的耐久性进行了评估,见图13。如图13 所示,C-N@NiONiMoO4/NF在10 mA·cm-2的电流密度下持续催化UOR 57 h,电压没有明显上升,这显示出C-N@NiO-NiMoO4/NF优异的催化稳定性。结合图6~图10研究结果,表明氮掺杂的碳包覆结构有利于提高催化剂的稳定性。
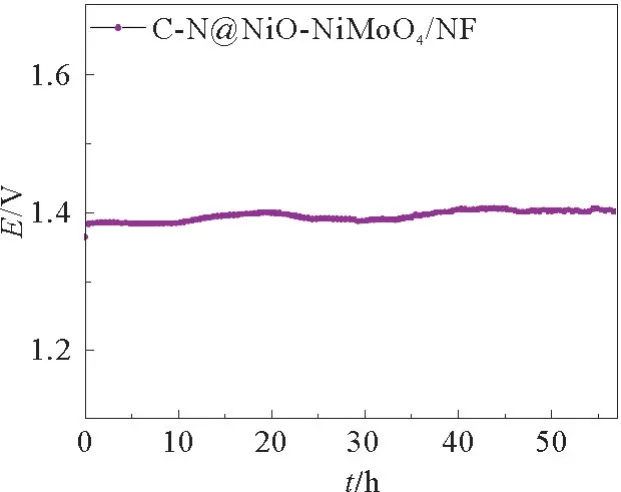
图13 C-N@NiO-NiMoO4/NF的计时电位曲线Fig.13 Time-dependent potential curve of C-N@NiO-NiMoO4/NF
3 结论
合成了氮掺杂碳包覆的NiO 和NiMoO4复合材料C-N@NiO-NiMoO4,并将其用作UOR 电催化剂。基于NF的高机械强度和导电性,将其负载于NF上以进一步提高其催化性能。实验结果表明,C-N@NiO-NiMoO4/NF具有较C-N@NiO/NF和NiMoO4/NF更加优异的催化活性和长期稳定性。在含有0.33 mol·L-1尿素的1 mol·L-1KOH 溶液 中,C-N@NiO-NiMoO4/NF在1.8 V 时的电流密度是NiMoO4/NF 的1.7倍,C-N@NiO/NF 的3.6 倍。此 外,C-N@NiO-NiMoO4/NF 在10 mA·cm-2的电流密度下持续催化UOR 57 h催化性能无显著变化。催化活性的提高主要归因于C-N@NiO 和NiMoO4的协同效应使得C-N@NiO-NiMoO4具有更快的电荷传递能力和更大的电化学活性表面积,加速了UOR 反应速率并提供了更多活性位点。长期稳定性的改善可能是由于氮掺杂的碳包覆结构的存在,使得C-N@NiO-Ni-MoO4具有较高的抗中毒性和中间产物去除效率。
