北京市油松林根际真菌种类调查
——松山自然保护区为例
2024-03-05高丙英王平王艳春丁熙张经纬刘淑英
高丙英,王平,王艳春,丁熙,张经纬,刘淑英
(1甘肃农业大学资源与环境学院,兰州 730070;2北京市园林绿化科学研究院土壤与水研究所,北京 100102;3北京松山国家级自然保护区管理处,北京 102115)
0 引言
油松(Pinustabuliformis)是中国北方广大地区造林的先锋树种[1],也是延庆区的主要造林树种[2],在改善气候、涵养水源、固碳释氧及美化环境等方面发挥重要作用[3-4]。北京地区油松广泛分布,北京市现有森林面积45.5 万hm2,其中油松人工林占总面积的17.3%,在保护地区生态安全方面起到非常重要的作用[5]。然而,多数松科植物的根毛较少,依赖菌根吸收水分和养分。在其长期的生存进化过程中,树木已形成依赖菌根在自然条件下成活和生长的特性[6]。在自然条件下没有菌根就生长不良,甚至死亡[7]。因此,为提高油松的造林成活率和加快幼树的生长,使油松幼苗的根系形成更多的菌根,可通过自然感染和人工接种,以明确油松林根际真菌资源状况,更好地开发、利用这一资源。
根际(Rhizosphere)一般是指根—土界面不足1 mm到几毫米范围的微区土壤,它是土壤水分和矿质养分进入根系参与生物循环的门户,同时也是根系自身生命活动和代谢对土壤影响最直接、最强烈的区[8]。根系从土壤环境中吸收自身所需要的各种养分并与土壤直接接触,两者之间不断地进行着物质循环和能量流动,从而从根本上影响着养分从土壤进入植物体的过程[9]。近年来人们非常关注根际微生态系统土壤环境的研究[10-11],但对林木根际土壤真菌的研究很少。
本研究主要以北京市松山国家级自然保护区人工油松林、天然油松林2种主要群落类型为研究对象,研究不同油松林下根际真菌多样性,研究结果对北京城区及周边山区根际真菌的资源保护、合理开发和可持续利用具有重要意义,同时为松林的可持续经营、有效防止植物病害提供科学依据。
1 材料与方法
1.1 试验区概况
北京市松山国家级自然保护区为研究地区,位于北京市延庆县西北部,属于燕山山脉军都山,为中山地带,地势西高东低。地理位置介于40°29′—40°33′N,115°43′—115°50′E,属暖温带大陆性季风气候,春季干旱多风,夏季高温多雨,冬季寒冷干燥。年平均降雨量为493 mm,主要集中于6—9月,年均蒸发量为1772 mm,是降雨量的3 倍多。年平均日照时数为2843.7 h,年平均气温为8.5℃左右。
松山自然保护区有着华北地区唯一成片的天然次生油松林,是华北地区最具有代表性的生态较为完好的落叶阔叶林生态系统[12]。由海拔变化导致的温度和水分分布变化使其形成了较为明显的植被垂直分布带,土壤垂直变化明显,主要分为山地褐土、山地棕壤和山地草甸土。保护区林分主要包括油松针叶林,以及 由 山 杨 (Populusdavidiana)、 蒙 古 栎(Quercusmongolica)和核桃楸(Juglansmandshurica)等组成的阔叶林。尤其油松在海拔100~2600 m 地带均可生长。
图1是2020—2022年北京市和延庆区年均气候及降雨图。从中可以看出,5—12月期间,北京市和延庆区气温在7月均达到最高峰后逐渐降低;北京市降雨量最高峰出现在7月,8月降雨量骤降,而延庆区降雨量最高峰出现在7月,在8、9月出现小高峰,其余月份降雨量均极少。
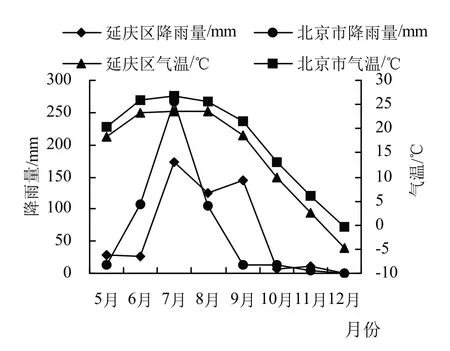
图1 2022年5—12月气温及降雨量
1.2 试验材料
于北京市延庆区(40°47′N,116°34′E)松山采集的土样、子实体中筛选培养,供试土样、子实体采自人工油松林、天然油松林2 类林地。不同油松群落基本情况见表1。

表1 2种油松林的基本信息
采样点距植株主干30 cm,用土钻按0~10 cm、10~20 cm、20~30 cm 的深度分别采集3 层土样,每层采土样约2.0 kg。带回试验室自然风干,四分法缩取,研磨并通过孔径为2 mm的筛,测定土壤pH值、EC值、有机质、碱解氮、有效磷、速效钾等相关指标分析。
采集根际土样时铲去表土,沿着根部挖掘至根的末级(深挖),将采集的带有根系的土块,用力抖动,使较大土粒脱落,脱落土粒为非根围土壤,剩余的黏附在根系上的则为根围土壤[13],取附着根系0~4 mm左右的土壤为根际土。将土样装入无菌自封袋中并编号,标记好采样地点、时间与坡向等,置于便携式冷藏箱内带回。在实验室中立即剔除植物残体、碎石等杂物,过2 mm筛备用。4℃冰箱内保存,使用时间不超过一周。
子实体采集时间一般选在雨季初期,6—8月是林地内菌根真菌子实体大量出现的季节[14]。野外采集过程中,首先观察、鉴定,并采取现场拍照记录,以详细准确记录新鲜子实体的形态特征。每种子实体采集2~5株,放入带有编号的自封袋,置于便携式冷藏箱内带回。当天分离培养(也有采集后2~3 d 的),以防腐烂置于4 ℃冰箱内保存。
1.3 试验设计及方法
本试验于2022年6—12月共计6 个月,试验在北京市园林绿化科学研究土壤与水研究所无菌室内筛选培养菌种,采用MMN 固体培养基对试验菌种进行平板培养[15-16]。培养基组成成分,见表2。

表2 培养基组成成分
1.3.1 土样真菌培养采用稀释涂布平板法、尖端菌丝挑取法和平板划线法进行真菌分离纯化。通过梯度稀释,使悬液依次稀释至10-1~10-6,取0.1 mL不同稀释梯度的悬液涂布于MMN 固体培养基中(已加入终浓度为200 μg/mL 的青链霉素溶液),每个稀释梯度做3 个平行;将涂布完毕的平板置于生化培养箱中25℃恒温培养,每日定期观察真菌长出情况,待长出菌丝后,采用尖端菌丝挑取法,把菌丝转移到新的固体MMN 平板上,进行纯化培养,转接3~4次。有杂菌污染则立即剔除并重新纯培。
1.3.2 子实体真菌培养所有分离工作均在超净工作台上完成。将采集的新鲜、健康的完整子实体测量其大小后,既不冲洗也不表面消毒,将表面杂物去净后,分离部位为菌盖和菌柄。菌盖用灭菌镊子将菌盖表皮剥离,菌柄则徒手沿中轴小心掰开,在其不同内部挑取豌豆大小组织块置于固体MMN 培养皿内,每个处理重复3次。将培养皿放入25℃生化培养箱中培养。3~4 d后检查培养基面是否有污染,有污染则立即剔除并重新培养。根据菌根真菌菌丝体直接从接种块上长出、生长较慢及同种真菌形成的菌落形态一致等特点,初步确定所分离是否为菌根真菌纯培养物[17]。
1.3.3 菌种的保存经3~5次挑选纯化培养后的菌株继续转接到固体MMN 斜面上培养,待长满斜面后在斜面上覆盖一层灭菌的液体石蜡,完全覆盖菌种从而隔绝空气,减少菌种及培养物水分挥发,密封试管直立置4℃保存。15 d转种1次。
1.4 分析方法
1.4.1 子实体的鉴定大部分菌根菌子实体含水率较高,易被破坏和虫蛀,筛菌培养选用健康无病虫害的子实体。将采集到的子实体去其泥土等杂物,编号、放入9 号自封袋,然后统一置于装有冰袋的便携式冷藏箱中。带回实验室后,记录其数量和形态指标(包括菌盖直径、真菌高度等)。根据子实体的解剖学特性和形态学特征,并参考相关书籍和文献资料[18-19]进行鉴定。
1.4.2 菌种的鉴定筛选培养的真菌菌落经3~4次平板划线纯培,纯培一次菌种需要4~7 d。待菌种长满培养皿且无杂菌污染,送至上海生工生物工程股份有限公司进行一代测序。
1.4.3 菌种检测对比库对比库为美国国家生物技术信息中心(NCBI)。
1.4.4 菌种基因组DNA 提取 按SK8255(细菌)、SK8259(真菌)、SK8257(酵母)试剂盒操作(表3)。
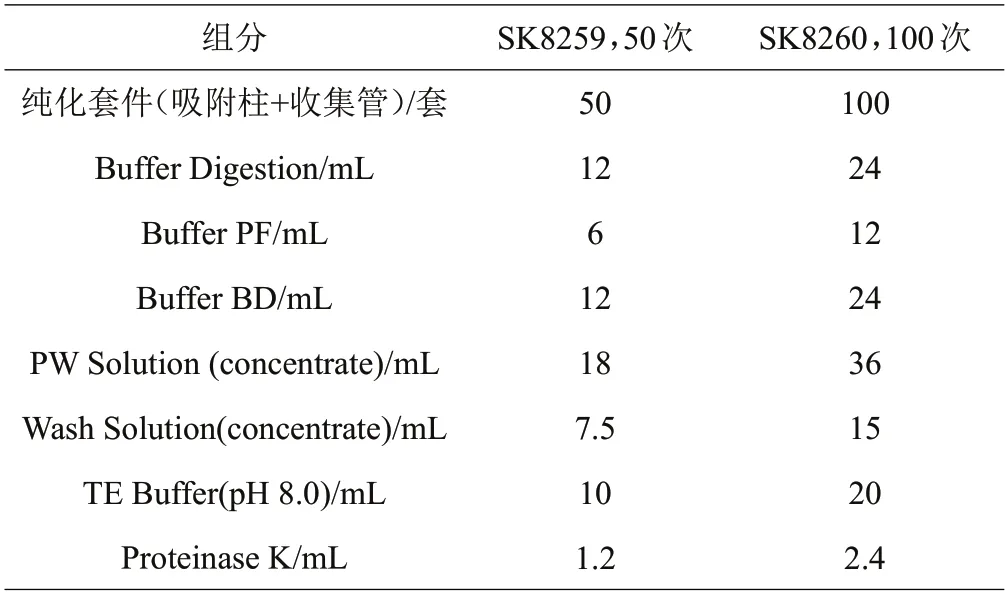
表3 Ezup柱式真菌基因组DNA抽提试剂盒
1.4.5 18s rDNAITS区段PCR扩增利用琼脂糖凝胶电泳检测DNA 的纯度和浓度,取适量样品于离心管中,使用无菌水稀释样品至0.5 ng/μL。以稀释后的基因组DNA 为模板,根据测序区域的选择,使用ITS1 和ITS4 引物,生工生物工程(上海)股份有限公司的SanTaq Plus Mix PCR 预混液,含蓝染料,(B532081)进行PCR,确保扩增效率和准确性。PCR 反应体系为50 μL,其中Sterilized ddH2O 20 μL,2×PCR Master 25 μL,DNA 模板1 μL,上游引物(10 μL mol/L)2 μL,下游引物(10 μL mol/L)2 μL,见表4。其中,rDNA的扩增引物选择真菌ITS1、ITS4 引物序列下:ITS1-TCCGTAGGTGAACCTGCGG、ITS4- TCCTCCGCTT ATTGATATGC。

表4 预混液(含蓝染料)试剂盒组成
2 结果与分析
2.1 2种油松林根际真菌资源
调查共采集4次,12种不同的子实体,初步鉴定出松山油松林根际真菌有16 个属,17 个种。青霉属(Penicillium)最多,占总数的18.60%;其次为镰孢菌属(Fusarium),占总数的13.95%;接着为小克银汉霉属(Cunninghamella),占总数的11.63%;然后为伞状霉属(Umbelopsis)、毛霉属(Mucor),占比均为9.30%;再为木霉属(Trichoderma)、拟盾壳霉属(Paraconiothyrium),占比均为6.98% ;短梗霉属(Aureobasidium)占比为4.65%;最后为裂褶菌属(Schizophyllum)、螺旋聚孢霉属(Clonostachys)、鳞质霉属(Apophysomyces)、拉恩氏菌属(Rahnella)、多孔菌属(Polyporus)、中文名不详(Lecanicillium)、中文名不详(Vanrija)和菌寄生属(Hypomyces)8种菌属均占总数的2.33%。结果见表5。

表5 油松林下的根际真菌及类型
2.2 2种油松林根际真菌优势属的分析
2022年5—10月,初步从松山自然保护区天然油松林和人工油松林中筛选出真菌17种,隶属于16属。其中,青霉属(Penicillium)最多,其次为镰孢菌属(Fusarium),最后为小克银汉霉属(Cunninghamella),分别占总数的18.60%、13.95%、11.63%,见表5、图2。
图2 1%琼脂糖电泳观察图(电泳图DNA Ladder Mix make)
2.2.1 人工油松林人工油松林中根际真菌有9属5种,4个种名尚未能鉴定。其中以伞状霉属(Umbelopsis)为最多,占人工油松林筛选出真菌总数的23.53%;其次为青霉属(Penicillium),占比为17.65%;小克银汉霉属(Cunninghamella)、镰孢菌属(Fusarium)和短梗霉属(Aureobasidium),占比均为11.76% ;鳞质霉属(Apophysomyces)、拟盾壳霉属(Paraconiothyrium)、螺旋聚孢霉属(Clonostachys)和中文名不详(Vanrija)占比最少为5.88%。
2.2.2 天然油松林天然油松林中根际真菌有11 属11种,3 个种名尚未能鉴定。其中以青霉属(Penicillium)为最多,占天然油松林筛选出真菌总数的19.23%;其次为镰孢菌属(Fusarium)和毛霉属(Mucor),占比均为15.38%;小克银汉霉属(Cunninghamella)、木霉属(Trichoderma)和拟盾壳霉属(Paraconiothyrium),占比分别为11.54% 、11.54% 和7.69% ;裂褶菌属(Schizophyllum)、拉恩氏菌属(Rahnella)、多孔菌属(Polyporus)、中文名不详(Lecanicillium)和菌寄生属(Hypomyces)占比最少均为3.85%。
青 霉 属 (Penicillium)、小 克 银 汉 霉 属(Cunninghamella)、镰孢菌属(Fusarium)和拟盾壳霉属(Paraconiothyrium)4 属同时存在人工油松林和天然油松林中;且天然油松林的根际真菌群落比人工油松林的根际真菌群落丰富。
2.3 影响2种油松林根际真菌分布的因素
由表6和表7可知,天然油松林与人工油松林的土壤养分状况较相近。仅天然油松林的速效钾含量低于人工油松林,其他基本养分状况差异不大。由此可知,2种油松林土壤养分状况对根际真菌群落的分布影响较小。

表6 天然油松林土壤的基本养分状况

表7 人工油松林土壤的基本养分状况
3 讨论
从延庆松山国家级自然保护区人工油松林和天然油松林根际土壤中分离出16 个属,17 个种,中文名不详3 个,4 个种名尚未能鉴定,其中天然油松林真菌群落种类更丰富。董爱荣等[20]研究小兴安岭凉水自然保护区不同林型的土壤真菌发现,在林分结构复杂、林下植物种类多的椴树(Tiliatuan)林、红松(Pinuskoraiensis)林和枫桦(Betulacostata)红松林中,土壤真菌数量和种类明显多于其他林分类型。赵文静等[21]对额尔古纳国家级自然保护区山杨林、白桦林、黑桦林和落叶松林中土壤真菌进行了分离鉴定,结果表明土壤真菌区系与森林类型密切相关。尚蓓[22]研究表明不同林型、不同土壤性质等都会影响土壤真菌的分布,包括土壤真菌种类和数量。MICHAELA等[23]研究也发现,真菌的多样性指数与森林类型密切相关。本研究中,天然油松林的真菌群落种类比人工油松林的真菌群落种类丰富,与其有较好的一致性。研究中测定天然油松林和人工油松林的基本养分状况得出,2 种林型的土壤养分状况差异不大。养分的有效性是由土壤物理、化学和生物学特性,特别是根系主导的根际微生态系统性状所决定的[24]。这可能是天然油松林林下灌木层和草本层物种多样性比人工油松的高[25]。天然林的抗逆性强,森林结构分布稳定,长时间的自然演替,生物链比较完整,物种的分布较丰富,有较强的自我恢复能力,物种的多样性程度极高[26-27]。而人工林构成树木种类单一,年龄和高矮接近,冠层分布密集单一,树冠完全遮挡了阳光,林下缺乏中间地灌木层和地表植被,因而影响微生物群落多样性[28-29]。
接合菌门(Zygomycota) 和子囊菌亚门(Ascomycotina)是本研究结果的优势真菌群落。接合菌门真菌大多为腐生物,有些接合菌门真菌与高等植物共生形成菌根[30]。其中青霉属在2 种林型种均有分布,且天然油松林中数量丰富于人工油松林。油松林土壤中可能以木质素(油松叶凋落物含木质素较多)为主,木质素较纤维素、半纤维难分解,而真菌对纤维素分解作用较强,如青霉属[31]。Ren等[32]通过ITS序列高通量测序技术也揭示油松林在门水平的优势真菌类群为子囊菌门(Ascomycota)、担子菌门(Basidiomycota)和接合菌门(Zygomycota)。高微微等[33]研究城市森林不同林型下土壤基本理化特性及土壤真菌多样性,研究表明真菌门和真菌纲水平的变化最明显,主要涵盖了子囊菌门、担子菌门、壶菌门和接合菌门等。
根际微生物种类越多,数量越大,土壤微生物的活性则越强,越能促进植物的生长[34-35]而真菌作为土壤微生物的重要组成部分,紧密的将地上部分与地下部分联系起来[21]。所以,研究不同林分下根际真菌多样性具有重要意义,将为油松林的保护和人工恢复提供依据,为“适树适种”菌剂的研究提供一定的理论依据,同时对医药工业和保障人类健康具有一定的推动作用。如:粉红粘帚霉是重要的生防真菌,不仅拮抗能力强,而且能抑制病原菌诱导植物产生系统抗性,对农业上植物抗病的发展起了重要的推动作用[36];根霉属、毛霉属和小克银汉霉属是毛霉科下最常见的致病菌属,毛霉一般好侵犯下呼吸道[37]。但毛霉属真菌有较强的分解枝叶能力[38],促进落叶等的分解。另外在2 种林型中检测出未被鉴定的真菌种类,这些种类还需要进一步的分析鉴定。
4 结论
本研究主要获得以下结论:(1)青霉属是松山自然保护林天然油松林的优势真菌,伞状霉属是人工油松林的优势真菌。(2)天然油松林根际真菌群落比人工油松林根际真菌群落丰富。(3)青霉属、镰孢菌属、小克银汉霉属、伞状霉属和毛霉属等是油松林根际土壤占优势的真菌。(4)青霉属、小克银汉霉属、镰孢菌属和拟盾壳霉属4属在天然油松林和人工油松林中均有分布。
