磷化工厂周边溪流水体对斑马鱼的毒性影响*
2024-03-04罗康婷郭子毓代恒美汪淑颖
罗康婷,郭子毓,代恒美,汪淑颖,刘 龙,潘 莎
(贵州医科大学公共卫生与健康学院 环境污染与疾病监控教育部重点实验室,贵州 贵安新区 561113)
磷矿是生产磷化工产品的重要原料,P、Hg等元素含量较高[1-2]。P是生物有机体生长和能量传输所必需的营养元素,是核酸、细胞膜和骨骼的重要组成部分[3],但生物摄入过量的P可造成牙齿、骨骼的损害[4-5]。Hg是一种生物体非必需的有毒有害重金属元素,具有易迁移性、隐蔽性、高生物蓄积性、高挥发性及潜在持久性等危害[6]。
磷化工生产过程中废弃物的排放,易对周边水生生态系统造成破坏,且对于年径流量小、复氧能力差的溪流水体影响更为显著。当溪流水体受到磷化工废弃物污染时,极易出现水体富营养化现象,同时其中的有害物质可通过生物富集、生物放大作用等危及人类健康。因此,开展磷化工企业对周边溪流水体影响的监测评价尤为重要[7-8]。
斑马鱼(Daniorerio)属于辐鳍亚纲(Actinopterygii)、鲤科(Cyprinidae)、短担尼鱼属(Danio),平均长度为3.5 cm,寿命约为2~3年。斑马鱼繁殖力强,繁殖周期短,遗传性状稳定,且对于有毒有害物质的刺激非常敏感。此外,斑马鱼具有高度保守的基因组和信号传导通路,与人类参考基因组的比较表明,71.4%的人类基因中有一个或多个斑马鱼同源物[9-10]。目前,斑马鱼在生态毒理学相关研究领域应用广泛,同时也是分子遗传学、发育生物学中常用的模式生物[11-13]。
在正常情况下,生物体细胞的生长代谢会产生少量自由基,但当生物受到环境污染物胁迫时,体内活性氧物质(ROS)的过度生成便会产生大量的超氧阴离子、过氧化氢等含氧自由基。当体内自由基的产生清除失衡,机体出现氧化应激,会导致大量强氧化性中间产物生成,易引发脂质过氧化、基因突变、蛋白质失活等一系列损伤[14]。抗氧化系统是机体为了清除体内过量自由基而自发形成的一种解毒机制,使自由基处于动态平衡状态,其主要由抗氧化酶(如超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GPx)等)以及抗氧化小分子(如还原型谷胱甘肽(GSH)、β-胡萝卜素(维生素B)、抗坏血酸(维生素C)等)构成。这些酶或小分子的改变可以作为机体受到污染物胁迫出现氧化应激的早期预警生物标志物[15-16]。
目前,斑马鱼已被广泛应用于工业废水污染的研究。CHAGAS等[17]将斑马鱼暴露于制革废水(UTE)中,发现斑马鱼行为发生改变,且产生了神经毒性作用。解卫方[18]将斑马鱼暴露于药厂阿莫西林废水中,结果表明阿莫西林废水48 h内毒性效应较小,超过48 h后毒性效应逐渐增强。沈洪艳等[19]将斑马鱼暴露于抗生素药厂废水中,发现斑马鱼肌肉中SOD活性、丙二醛(MDA)含量出现变化,该废水导致斑马鱼出现氧化应激。DERIKVANDY等[20]采用未经处理的酒精工业废水对斑马鱼进行胁迫,发现暴露于1%和2%的废水造成斑马鱼体内总抗氧化物(TAC)、MDA和天冬氨酸转氨酶(AST)活性显著增高,Sod1、Gstp-1a和Gpx1a基因表达显著上调。目前的研究主要集中于较为常见的工业废水对斑马鱼的毒性影响,但关于磷化工企业周边水体的毒性影响研究却相对缺乏。基于此,本研究以某磷化工厂周边溪流水体为研究对象,以斑马鱼为受试生物,探讨溪流水体P、Hg在斑马鱼体内的累积状况及对斑马鱼生长体征和斑马鱼机体SOD活性、GSH含量和MDA含量的影响,以期为区域水环境生态风险评估及水环境污染防治提供理论依据。
1 材料与方法
1.1 仪器与试剂
电子天平:上海浦春计量仪器有限公司,JA1003;pH计:上海仪电分析仪器有限公司,PXSJ-226;原子荧光光谱仪:北京瑞利分析仪器有限公司,AF-630A;电感耦合等离子体质谱仪:美国珀金埃尔默股份有限公司,NexlON2000。
酚酞、抗坏血酸、氢氧化钠、铜酸盐、过硫酸钾、重铭酸钾、盐酸羟胺:分析纯,天津科密欧化学试剂有限公司;硫酸、硝酸、高氧酸:优级纯,国药集团化学试剂有限公司;试验水:充分曝气的自来水,pH值(7±0.5),温度(23±1)℃,溶解氧(DO)≥ 4 mg/L;斑马鱼胁迫用水:采自距某磷化工厂1100 m断面的溪流水。该溪流是贵州省开阳县境内某磷化工厂污水排放的主要受纳水体,是区域农田灌溉的主要水源。前期调查发现,该溪流距磷化工厂1100 m附近设有该厂的渗滤池及废渣堆放地,是受污染较为严重的典型断面水样。
1.2 试验生物
斑马鱼成鱼:购自贵阳某花鸟市场,体长为(2±1)cm,体重为(0.3±0.1)g。将斑马鱼置于玻璃水族箱中驯养两周,驯养期间斑马鱼死亡率在5%以下。光暗周期为t(光)∶t(暗)= 12 h∶12 h。每日早晚各喂食1次,及时清除粪便及食物残渣。驯养结束后,随机挑选健康活泼的斑马鱼进行试验。
1.3 试验方法
1.3.1 水质指标测定
pH值的测定采用玻璃电极法(GB/T 6920—1986);P的测定采用钼酸铵分光光度法(GB/T 11893—1989);F-的测定采用氟离子选择电极法(GB/T 7484—1987);Hg的测定采用原子荧光光谱仪(AF-630A,北京瑞利,中国);As、Cd、Co、Cr、Mn、Pb、Zn的测定采用电感耦合等离子体质谱仪(NexION 2000,PerkinElmer,USA)。实验用玻璃容器均经10%硝酸浸泡24 h后冲洗。在分析测试过程中,每个样品设3个平行,同时设置空白样,平行样的相对标准偏差小于10%,加标回收率控制在80% ~ 120%之间。
1.3.2 急性毒性实验
急性毒性实验方法参照GB/T 13267—1991《水质物质对淡水鱼(斑马鱼)急性毒性测定方法》。实验采用静水式进行,周期为96 h。以百分比体积浓度按几何级数间距用曝气48 h的标准稀释水对水样进行稀释,配成水样的体积百分比分别为20%、40%、60%、80%、100%的5个浓度组,同时用标准稀释水设置空白对照组,每组3个平行。从驯养鱼群中随机选10尾试验鱼放入各鱼缸中,观察并记录染毒1 h、4 h、8 h、12 h、16 h、20 h、24 h、48 h、72 h、96 h各浓度组试验鱼的死亡状况。96 h后未观察到任何一组斑马鱼死亡,因此,该溪流水体对斑马鱼无急性毒性。
1.3.3 亚急性毒性实验
参照急性毒性实验结果,采用某磷化工厂周边溪流原水样进行亚急性毒性实验。实验分为对照组和原水暴露组,每组随机放入驯养后的斑马鱼20尾,每组设置3个平行。每24 h更换试验液1次。
在14 d、28 d时,每个处理每次分别随机选取4尾(雌雄1∶1)斑马鱼置于小烧杯内,按重量(g)∶体积(mL)=1∶9的比例加入生理盐水后匀浆,取其上清液参照南京建成生物工程研究所试剂盒方法测定SOD活性、GSH含量和MDA含量。
暴露28 d后,取0.1 g鱼样采用钼蓝分光光度法测定P含量,取0.2 g鱼样采用原子荧光分光光度法测定Hg含量。测定过程中采用标准物质(GBW10024-扇贝组织,计量科学研究院)进行分析质量控制,相对标准偏差小于10%,加标回收率为80%~120%。
1.4 数据处理
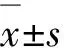
2 结果与分析
2.1 溪流水质的污染特性
磷化工厂周边溪流水质特征如表1所示,pH值为7.76,水体呈中性偏弱碱性,P、F-、Hg、As、Cd、Co、Cr、Mn、Pb、Zn的平均浓度见表1,其中P、Hg的平均浓度均超过《地表水环境质量标准》(GB 3838—2002)V类水标准限值,超标倍数分别达1.9倍、1.43倍。

表1 磷化工厂周边溪流水质特征
2.2 斑马鱼体内P、Hg含量
为进一步探索磷化工区溪流水体中的潜在生态风险因子P、Hg在斑马鱼体内的累积状况,对斑马鱼体内P、Hg含量进行了分析。如图1所示,在溪流水体胁迫下,处理组斑马鱼体内P含量范围为5.371~7.457 mg/g,平均含量为6.233 mg/g,与对照组相比稍升高,是对照组的1.01倍,但差异不显著(P>0.05);处理组斑马鱼体内Hg含量范围为0.068~0.124 mg/kg,平均含量为0.094 mg/kg,与对照组相比显著升高(P<0.05),是对照组的1.62倍。
注:*表示处理组与对照组具有统计学差异(P<0.05)。图1 斑马鱼体内P、Hg含量
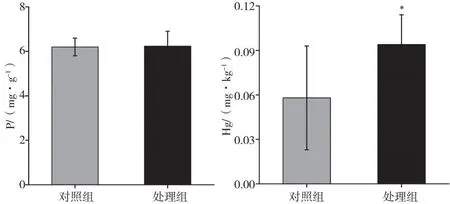
2.3 生长体征变化
暴露于磷化工溪流水体中的斑马鱼的生长体征情况如图2所示。在溪流水体胁迫下,与对照组相比,处理组斑马鱼体质量下降至对照组的13.33%;体长较对照组有所升高,是对照组的1.01倍;肝体比下降至对照组的4.94%;鳃体比较对照组有所升高,是对照组的1.12倍,但差异均无统计学意义(P>0.05)。
图2 在溪流水体胁迫下斑马鱼的生长体征变化
2.4 溪流水体对斑马鱼SOD活性、GSH含量及MDA含量的影响
2.4.1 溪流水体对斑马鱼SOD活性的影响
磷化工厂周边溪流水体对斑马鱼SOD活性的影响见图3。由图3可知,暴露14 d时,处理组SOD活性较对照组升高17.4%,表现为显著诱导效应(P<0.05),说明此时斑马鱼的抗氧化防御系统对磷化工区溪流水体的攻击有较强的主动调节能力;当暴露28 d时,处理组SOD活性上调作用有所缓解,较对照组升高12.6%,但差异不显著(P>0.05)。
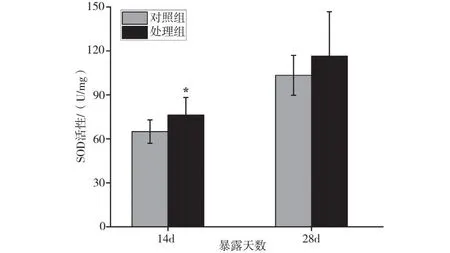
注:*表示处理组与对照组具有统计学差异(P<0.05)。图3 溪流水体对斑马鱼SOD活性的影响
2.4.2 溪流水体对斑马鱼GSH含量的影响
磷化工厂周边溪流水体对斑马鱼GSH含量的影响见图4。由图4可知,处理组GSH含量整体呈“先诱导后抑制”的趋势。暴露14 d时,处理组GSH含量较对照组升高27.5%;暴露28 d时,处理组GSH含量较对照组降低9.61%,但差异均不显著(P>0.05)。
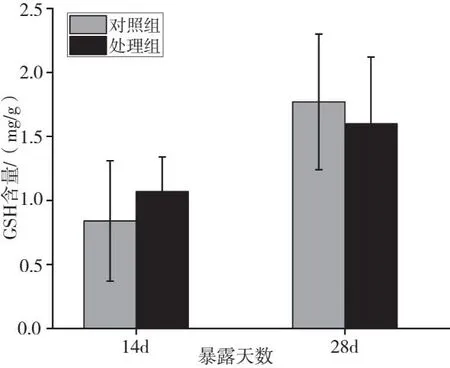
图4 溪流水体对斑马鱼GSH含量的影响
2.4.3 溪流水体对斑马鱼MDA含量的影响
磷化工厂周边溪流水体对斑马鱼MDA含量的影响见图5。由图5可知,处理组MDA含量也呈现“先诱导后抑制”的趋势。暴露14 d时,处理组MDA含量较对照组升高11.9%;暴露28 d时,处理组MDA含量较对照组降低13.5%,但差异均不显著(P>0.05)。
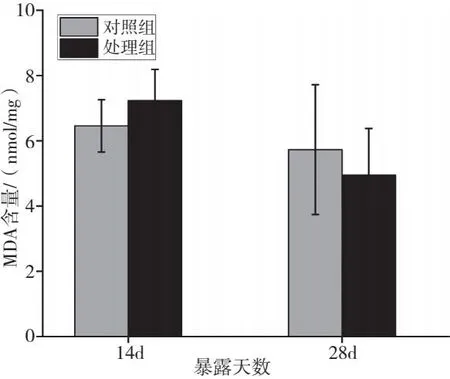
图5 溪流水体对斑马鱼MDA含量的影响
3 讨论与结论
本研究结果表明,磷化工厂周边溪流P、Hg的平均含量均超过地表水环境质量标准限值:磷化工厂排放的废水P含量较高[21],可对周边的地表水体造成P污染。当水体P含量较高时,一旦温度、光照等条件合适,极易发生富营养化,使水质恶化,水体溶解氧降低,水中生物死亡,水生生物多样性丧失;磷化工企业在生产过程中使用的磷矿石中含有Hg元素[1],其可随废水、废气、固体废物的排放,通过干湿沉降或地表径流等过程进入到周边水环境,造成水体Hg污染。Hg的生物富集性很强,在机体内富集超过一定限度时,即可产生毒性影响,对生物遗传发育、内分泌、中枢神经系统等产生损害[6]。可见,磷化工区溪流水体中含有潜在的生态风险因子。
本研究结果表明,在溪流水体胁迫下,斑马鱼对Hg的累积能力高于P。这可能是由于Hg的毒性较大,很容易与其体内巯基结合有关[22]。相关研究表明[23-24],水体Hg可通过生物累积和生物放大作用被鱼类富集并蓄积在体内,其生物富集倍数可高达104~107。
生长体征是生物健康状况的一个重要表征,常作为研究污染物对生物毒性作用的重要指标[25]。在溪流水体胁迫下,斑马鱼体质量、体长、肝体比和鳃体比虽有影响,但影响不显著。这可能与试验用鱼为成年斑马鱼,且暴露时间较短有关[26]。
许多环境污染物会导致生物体的氧化胁迫[27],将氧化应激相关酶或小分子的变化作为监测指标,可较好地弥补理化指标监测的不足。SOD是一种抗氧化金属酶,·OH是活性最高的活性氧自由基[28]。生物体受到环境污染物胁迫时,SOD是抗氧化防御系统的第一道防线,能使超氧阴离子转化为过氧化氢和氧分子,从而抑制超氧阴离子向·OH的转化,减轻对机体的损害,其在生物体的抗氧化防御系统中占有重要地位[10]。本研究中,溪流水体可诱导斑马鱼体内的SOD活性,但暴露一段时间后,又恢复至正常水平,这可能是由于随着暴露时间的延长,斑马鱼逐渐适应了外界环境,达到了新的氧化-抗氧化平衡[29]。GSH是机体内保护组织细胞免受自由基损伤的一种主要抗氧化剂,可维持机体的正常免疫功能,其所具有的巯基易与毒素结合,具有整合解毒功能,同时,GSH可与GPx等发挥相互协调的作用更加有效清除氧自由基[30]。本研究中,GSH呈现“先诱导后抑制”的趋势,与曹谨玲等[31]研究氟对鲤鱼脑抗氧化系统影响以及边建朝等[32]研究氟对大鼠抗氧化酶影响的结果类似,这可能是由于斑马鱼暴露于磷化工区溪流水体中,其体内ROS增多,机体抗氧化系统的防御能力无法清除超量生成的ROS,过量的ROS加大机体氧化损伤,反作用抑制了GSH的含量[33]。MDA是污染胁迫引发脂质过氧化的产物,它能与细胞膜上蛋白质和DNA等大分子交联生成西弗碱(Shiff碱),直接影响细胞膜的流动性和通透性,进而使细胞膜结构与功能发生紊乱,严重时导致细胞死亡[19]。因此,其含量的变化可反应细胞脂质过氧化的程度,也可间接反映细胞氧化损伤程度[34]。本研究中,MDA含量呈现“先诱导后抑制”的趋势,可能是由于斑马鱼暴露14 d后,体内SOD活性显著上升,有效发挥了清除体内过量自由基的效用,缓解脂质过氧化水平,MDA含量因此下降。研究表明,SOD活性上升伴随着MDA含量下降,两者呈现完全相反的趋势,这正是机体受到外界污染物胁迫时氧化应激反应中各成分保持动态平衡的体现[29]。
本研究表明:
1)在磷化工厂周边溪流水体胁迫下,斑马鱼体内无明显的P含量累积,Hg含量显著升高;
2)斑马鱼生长体征无显著变化;
3)斑马鱼体内SOD活性在14 d时较对照组升高17.4%,且差异显著(P<0.05);28 d时上调作用有所缓解,较对照组升高12.6%,但差异不显著(P>0.05)。溪流水体对斑马鱼体内SOD活性的影响表现为诱导效应;
4)对GSH和MDA含量的影响表现为“先诱导后抑制”的趋势,14 d时GSH、MDA含量分别较对照组升高27.5%和11.9%,但差异不显著(P>0.05);28 d时,GSH、MDA含量较对照组降低9.61%和13.5%,但差异不显著(P>0.05)。
以上说明,SOD对磷化工溪流水体的胁迫较敏感。磷化工厂周边溪流水体破坏了机体抗氧化系统的动态平衡,具有一定的生态风险。因此,应加强磷化工企业周边水环境的监测和治理,以维护良好的生态环境。
