降糖甲治疗2型糖尿病的机制研究*
2024-03-04程方玲田昌林张楠楠
程方玲,田昌林,张楠楠▲
(1贵州中医药大学 药学院,贵州 贵阳 550025;2贵州中医药大学 基础医学院,贵州 贵阳 550025)
0 引言
2型糖尿病(Type 2 Diabetes Mellitus,T2DM)是糖尿病最常见的类型。 T2DM是由遗传和环境因素相互作用而引起的一种代谢异常综合征,以慢性高血糖为主要特征,具有起病隐匿、潜伏期长的特点[1]。T2DM可能导致大血管和微血管退化性并发症,包括心血管疾病、糖尿病肾病和视网膜病变等[2]。代谢功能障碍和炎症反应是T2DM病理进展及其相关并发症期间胰岛功能丧失和不可逆的宿主器官损伤的部分原因。目前,针对2型糖尿病的治疗,西医多采用罗格列酮、二甲双胍等药物,一方面可以通过增加肝脏、肌肉、脂肪组织对胰岛素的敏感性,另一方通过减少糖原生成,增加葡萄糖外周利用而降低血糖,但长时间用药会造成肝肾功能和消化系统的损伤,效果不够理想[3]。因此,寻找更有效、更安全的药物治疗T2DM一直是全球研究的焦点。
降糖甲(JiangTangJia,JTJ)是中药复方制剂,由黄芪、地黄、太子参、黄精、天花粉5味药材加工而成,具有补气益气、养阴生津的功效,临床用于治疗气阴两虚型消渴症即非胰岛素依赖型糖尿病[4]。文献报道,JTJ具有提高血浆胰岛素、改善糖耐量的作用,并有一定的降低血脂及纤维蛋白原的功效[5]。JTJ在控制血糖的同时对体重的增长也有一定的抑制作用[6-7]。樊萌等人[8]研究显示降糖甲片联合二甲双胍治疗,可以减少T2DM的发生。赖晓阳等人[9]的研究发现,JTJ可抑制肝糖元分解,对肾上腺素性高血糖有抑制作用,也能减少西药降糖类药物中的一些副作用[10],认为它是对T2DM治疗较理想的中成药。但是目前为止并未对JTJ有深入的机制研究,因此本文将探索JTJ治疗T2DM的物质基础及作用机制,为其临床应用提供数据支撑。
1 材料与方法
1.1 获取糖尿病GSE25724数据集中的差异表达基因
从GEO数据库[11](https://www.ncbi.nlm.nih.gov/geoprofiles/)下载基因表达谱数据集GSE25724,并通过R中的limma包[12]筛选出2型糖尿病(T2DM)患者胰岛样本和正常胰岛样本的差异表达基因(DEGs)。GSE25724数据集中共分析了13个胰岛样本的基因表达,其中6个样本来自T2DM患者,7个样本来源于健康受试者。GSE25724数据集的DEGs在log FC≥0.584或log FC≤-0.584且P<0.05的条件下进行筛选。
1.2 降糖甲颗粒活性成分、靶点的获取
将降糖甲(JTJ)中“黄芪、黄精、地黄、太子参、天花粉”分别输入中药系统药理学数据库和分析平台(TCMSP,https://old.tcmsp-e.com/tcmsp.php)[13]。TCMSP中指出口服生物利用度(OB)≥30%的化合物具有良好的吸收性,口服后代谢缓慢,药物相似度(DL)≥0.18的化合物在化学上适合药物开发。因此,采用这两个ADME相关参数(OB≥30%和DL≥0.18)来鉴定JTJ颗粒中的潜在活性化合物。将TCMSP的OB≥30%和DL≥0.18的化合物通过swisstarget和SEA数据库预测靶点。将化合物对应的靶点导出,并通过UniProt[14](https://www.uniprot.org)将所有靶蛋白转换为与“homo sapiens”物种相对应的基因符号,最后获得标准化的靶点。
1.3 药物-成分-靶点网络的构建
利用Venny 2.1.0(https://bioinfogp.cnb.csic.es/tools/venny/)得到T2DM和JTJ颗粒的交集靶点。使用Cytoscape 3.9.1可视化活性化学成分与交集靶点之间的关系,以构建JTJ颗粒治疗T2DM的靶点调节网络。
1.4 蛋白质-蛋白质相互作用网络的构建与核心靶点的筛选
将交集靶点导入STRING[15](https://cn.string-db.org/),将蛋白质分类设置为“Homo sapiens”,最大置信水平为≥0.9,隐藏网络中未连接的节点后进行蛋白质-蛋白质相互作用(PPI)分析,并下载TSV文件。然后导入Cytoscape 3.9.1软件来构建PPI网络图。使用cytoHubba插件,并通过MCC算法筛选出PPI网络中排名前十二的核心靶点(Hubs)。
1.5 GO、KEGG通路富集分析
基因本体论(GO)功能分析主要用于描述基因靶点的功能,包括生物过程(BP)、细胞成分(CC)和分子功能(MF),KEGG富集分析可以获得Hubs所富集的信号通路。将Hubs导入DAVID[16](https://david.ncifcrf.gov/)进行GO富集分析和KEGG通路富集分析,下载相关数据,其中P<0.05被认为具有统计学意义。按“count”排列,选取P<0.05且排名靠前的前十条通路,导入微生信(http://www.bioinformatics.com.cn/)进行可视化。
1.6 差异表达及ROC分析
下载GSE25734相关表达谱文件,使用GraphPad Prism 9.4.1软件和微生信分析关键靶点在测试集样本中的差异表达并进行受试者工作特征曲线(ROC)分析。
1.7 分子对接验证
活性化合物小分子配体的2D结构从TCMSP中获取,Hubs蛋白结构文件从PDB数据库[17](https://www.rcsb.org)中获取,并将活性化合物配体和Hubs蛋白结构导入DS BIOVIA Discovery Studio 2016 v16.1进行分子对接模拟,对接分数表明配体与受体间亲和能力的大小。
2 结果
2.1 筛选糖尿病差异表达基因
如图1所示,GSE25724分别通过R中limma包、ggplot2包[18]、ComplexHeatmap包分析得到样本均一化箱式图、火山图、热图。样本均一化箱式图显示各个样本中位数基本在一个水平线上,说明样本间归一化程度好。火山图中选定的阈值为|log2(FC)|> 0.584和p.adj<0.05,满足这一阈值的DEGs个数有2952个,其中,高表达(logFC为正,红色圆点)的有1382个,低表达(logFC为负,蓝色圆点)的有1571个。热图中展示了高表达低表达各top20基因表达情况,其中红色代表高表达,蓝色代表低表达。

图1 GSE25724数据分析
2.2 JTJ活性成分与靶点的筛选及“药物-成分-靶点”网络构建
以OB值≥30%和DL值≥0.18作为条件筛选出41个活性成分(表1),通过Uniprot、swisstarget和SEA数据库将靶点标准化且去除重复靶点后得到909个靶点。将JTJ颗粒的909个靶点与GSE25724中的2952个DEGs取交集得到160个潜在靶点(图2(a))。通过创建属性文件整理成分-靶点,得到“药物-成分-靶点”文件,将文件导入Cytoscape3.9.1得到“药物-成分-靶点”网络图(图2(b))。其中V型的为药物名称缩写,黄芪为绿色的V型,黄精、天花粉为淡红色的V型,地黄、太子参为橘色,浅紫色的六边形为靶点,按照Degree排列;绿色的菱形为黄芪的成分,淡红色的菱形为黄精、天花粉的成分,橘色的为地黄、太子参的成分。

表1 JTJ活性成分

图2 韦恩图与药物-成分-靶点网络图
2.3 潜在靶点的PPI网络及关键靶点网络
将String中下载的TSV文件导入Cytoscape 3.9.1中,去除掉游离的靶点,获得的PPI网络图如图3(a)所示,按照Degree排列,颜色越深Degree越大。通过MCC算法得到12个Hubs(MAPK1、SRC、MAPK3、MAPK14、LCK、MAP2K1、PTPN11、NFKBIA、JUN、PIK3CA、PRKCZ、RAF1),同样按照Degree排列(图3(b))。
2.4 GO、KEGG通路富集分析
GO富集分析中P<0.05的BP有991条,CC有50条,MF有75条。选取前十条通路绘制成图,如图4(a)-4(c)所示,JTJ治疗T2DM的机制可能归因于以下生物过程:激活蛋白激酶的活性、血小板的激活、对MAP激酶活性的积极调节等生物学过程。在治疗T2DM时,JTJ对细胞成分的影响主要体现在膜区、膜外基质、晚期内膜体、不对称突触等。JTJ还对以下分子功能存在影响:MAP激酶活性、磷蛋白结合、磷酸酪氨酸残基结合、胰岛素受体底物结合等。KEGG富集分析中P<0.05的通路共有136条,其中主要富集于细胞凋亡,其次是MAPK信号传导途径,以及糖尿病并发症中的AGE-RAGE信号通路、II型糖尿病(图4(d))。

图4 GO、KEGG富集分析
2.5 差异表达及ROC曲线构建
对12个交集靶点进行差异表达分析。结果如图5所示,与对照组相比,PRKCZ和LCK在数据集GSE25724中T2DM组中表达显著增加,PTPN11在数据集中T2DM组显著降低(SRC、NFKBIA、JUN在数据集没有差异表达)。ROC曲线将灵敏度和特异度以图示的方法结合在一起,可准确地反映灵敏度和特异度的关系,是诊断方法准确性的代表,AUC越大代表准确率越高,结果如图5所示,PRKCZ、LCK、MAPK3在T2DM中有显著诊断价值(PRKCZ:AUC=1.000;LCK: AUC=0.952;PTPN11:AUC=0.952)。
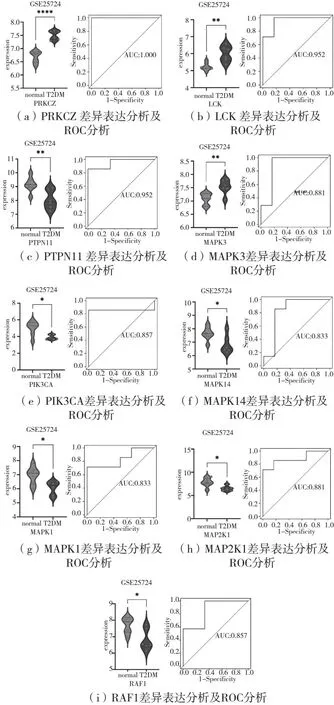
图5 交集靶点差异表达分析和ROC分析
2.6 分子对接
通过对3个Hubs编码的蛋白PPKCZ、LCK、PTPN11进行分子对接以确定最佳候选基因,如表2所示,对接分数表示活性化合物配体与靶蛋白的亲和力,分数越高,亲和力越强。分子对接结果(图6)表明,LCK能与(+)-丁香树脂醇-O-β-D-葡萄糖苷、反式角鲨烯、叶酸、薯蓣皂苷元很好的结合,蒙花苷能与PRKCZ很好的结合,PTPN11能与(+)-丁香树脂醇-O-β-D-葡萄糖苷、常春藤皂苷元很好的结合。
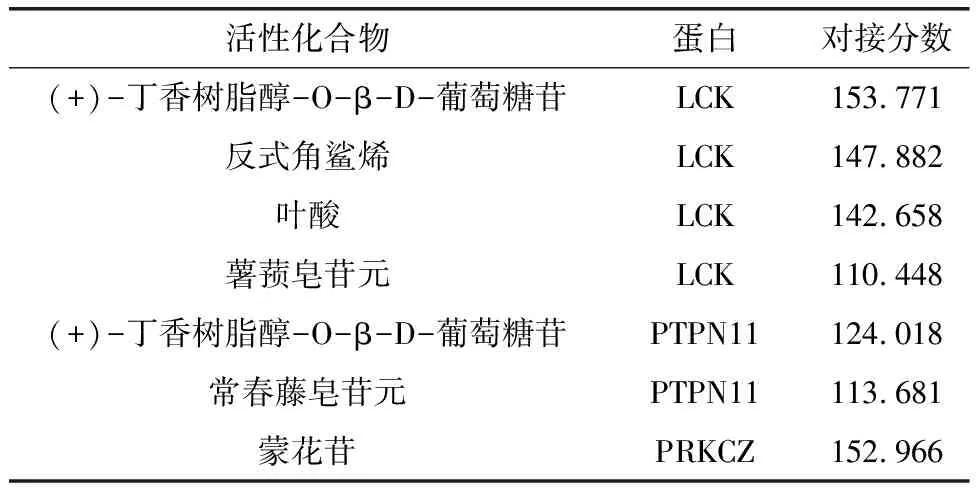
表2 靶蛋白和活性化合物的对接结果

图6 分子对接结果
3 讨论
T2DM是最常见的代谢性疾病,主要表现为代谢紊乱,如高血糖、高脂血症和胰岛素抵抗。糖尿病可导致各种严重的并发症,如冠状动脉疾病、下肢动脉病、视网膜病变和糖尿病肾病,并影响全球大量人群的生活质量[19]。JTJ是治疗T2DM的有效常用中成药,在临床实践中显示出显著效果,然而,目前尚不清楚JTJ治疗T2DM的作用机制,故利用生物信息学、网络药理学和分子对接技术进行分析。
根据药物-成分-靶点网络图可知通过筛选得到28个有效成分、160个潜在靶点。为进一步得到关键靶标,进行了PPI网络分析及cytoHubba插件分析,最终筛选出了12个Hubs(MAPK1、SRC、MAPK3、MAPK14、LCK、MAP2K1、PTPN11、NFKBIA、JUN、PIK3CA、PRKCZ、RAF1)。通过对这12个Hubs进行GO功能富集分析。发现在生物过程中,涉及到激活蛋白激酶的活性、血小板的激活、对MAP激酶活性的积极调节等。这些生物过程还与细胞成分和分子功能有关,包括膜区、膜外基质、胰岛素受体底物结合和MAP激酶活性等,并且T2DM患者细胞的超微结构也存在异常,如线粒体肿胀、染色质凝聚异常等。在KEGG分析中,前10个KEGG通路显著富集,其中主要涉及细胞凋亡,其次是MAPK信号传导途径,以及糖尿病并发症中的AGE-RAGE信号通路、II型糖尿病。T2DM的特征是继发于功能性β细胞衰退的慢性高血糖疾病,T2DM中β细胞减少部分归因于β细胞凋亡,这是由淀粉样蛋白沉积、脂毒性和葡萄糖毒性等致糖尿病情况引发的[20]。因此治疗T2DM的潜在策略可能是抑制促凋亡途径或增强胰腺保护因子的作用来保护胰腺β细胞[21]。且高血糖除直接引发β细胞凋亡的过程,还会导致许多严重的并发症。对异物刺激的反应可能会进一步诱发炎症[22],炎症会影响β细胞功能、胰岛素敏感性,代谢紊乱和低度炎症之间的交织关系被称为“内燃”。这表明与对病原体和组织损伤的器械急性炎症反应相反,在T2DM中观察到的慢性低度炎症对人体新陈代谢具有不利影响[23]。MAPK级联反应是一种高度保守的模块,对细胞外刺激作出反应并调节细胞增殖、分化、迁移等[24]。该信号通路由相关蛋白质的4个主要亚家族(Erk1/2、JNK、p38和Erk5)组成,可导致各种疾病,包括癌症、自身免疫性疾病、神经退行性疾病、心血管疾病、炎症等,且当MAPK下调时可调控糖尿病[25]。AGE-RAGE信号通路激活后,细胞内通路如ERK1和磷脂酰肌醇-3激酶途径的刺激可导致核因子kappa B(NF-κB)的活化和易位到细胞核并引起炎症[26]。而过度刺激RAGE受体会触发线粒体释放过量超氧化物,这一过程与细胞损伤和凋亡增加有关[27]。T2DM中的RAGE激活可能对内皮细胞、上皮细胞和免疫细胞产生特别有害的后果,特别是在微血管相对丰富的区域,包括糖尿病肾病和糖尿病视网膜病变[28]。
数据集验证及ROC曲线分析显示PRKCZ、LCK和MAPK3均有显著差异。高甲基化的PRKCZ基因启动子可能导致PRKCZ基因表达降低,进而通过胰岛素信号通路诱导T2DM的发生[29]。LCK也称为淋巴细胞特异性蛋白酪氨酸激酶,是Src家族非受体蛋白酪氨酸激酶的成员。它是一种 56 KDa 蛋白,可磷酸化许多蛋白质,如 ZAP-70、ITK、蛋白激酶 C 和 PI3K,从而调节多种细胞过程,包括细胞周期控制、细胞粘附、细胞运动、细胞增殖和细胞分化[30]。分子对接结果表明,LCK能与(+)-丁香树脂醇-O-β-D-葡萄糖苷、反式角鲨烯、叶酸、薯蓣皂苷元很好的结合,蒙花苷能与PRKCZ很好的结合,PTPN11能与(+)-丁香树脂醇-O-β-D-葡萄糖苷、常春藤皂苷元很好的结合。角鲨烯属于大戟属药用植物,大戟属的植物传统上用于治疗和管理各种疾病,如糖尿病、黄疸、高血压、发烧、肝脏炎症、血吸虫病、痢疾、呼吸系统疾病以及皮肤病[31]。薯蓣苷元及其衍生物已被证明对癌症、糖尿病、骨质疏松症、阿尔茨海默病和中风具有药理学益处[32]。研究表明[33],蒙花苷是有效的抗糖尿病药物,它可以作为预防剂,也可以作为治疗代谢性疾病的药物。
综上所述,降糖甲中的主要有效成分薯蓣苷元、蒙花苷主要通过作用于PPKCZ、LCK等关键靶点发挥抑制细胞凋亡、减少炎症产生和降低胰岛素抵抗的方式治疗2型糖尿病,本研究使用生物信息学结合网络药理学和分子对接的方法为中成药降糖甲治疗2型糖尿病的研究提供了新的数据,后期将通过体内外实验加以验证。
