污染治理前后小清河上游浮游植物群落变化与水质评价
2024-03-04唐厚全张水燕郑琳琳刘建军
杨 青,唐厚全,张水燕,田 勇,郑琳琳,薛 飞,刘建军
山东省济南生态环境监测中心,山东 济南 250101
小清河是黄河流域重要的独流入海河流,起源于山东省济南市睦里庄,于寿光市羊口镇汇入渤海莱州湾。小清河上游全部位于济南市境内,河长70.3 km,流域面积2 803 km2,是济南市最主要的纳污和泄洪河道。自20世纪90年代起,小清河上游水质日益恶化,除源头睦里庄外,其余河段均为严重污染状态[1-4],水生态系统遭受严重破坏,部分水生生物甚至绝迹[5-6]。2015年,国务院印发《水污染防治行动计划》(又称“水十条”),提出系统推进水污染防治和水生态保护工作。2016—2020年,济南市通过新改建污水处理厂、升级污水收集管网、开展流域生态补水和河道清淤等一系列治理措施,有效减少了小清河上游的污染输入,使河流自净能力得到提升,水质得到明显改善。
浮游植物是水生态系统中主要的初级生产者,其群落的动态变化对水质有重要的指示作用[7-9]。研究发现:砷、镉等重金属会胁迫浮游植物优势种发生改变[10-12];石油污染中,芘会降低浮游植物生物量[13];水库蓄水前后、黄河调水调沙前后、南水北调前后,浮游植物的功能群、生物量、藻类占比、优势种、多样性指数都会发生改变[14-19]。可见,浮游植物不仅能反映受污染水体的水质情况,还能指示未受污染水体的水质变化趋势,在河湖水质评价中具有广泛应用。污染治理措施是对水体的强烈人为干扰,会使浮游植物的群落组成和结构发生变化,因而通过监测浮游植物变化可以评价水质变化情况和污染治理效果。
有学者运用浮游植物多样性指数评价了小清河水质状况,但相关研究以单年度或单季节的短期调查为主,调查数据不能支撑污染治理前后河流水质变化的全面比较,也缺少对浮游植物群落演替与理化指标相关性的分析。本研究分别于2015年(治理前)和2020年(治理后)在小清河上游开展浮游植物采样调查和理化指标检测,调查时间覆盖春、夏、秋3季。基于调查结果,从种类组成、相对丰度、优势种等方面对比分析了污染治理前后浮游植物群落特征变化,利用综合污染指数和3种生物多样性指数分别评价研究区域水质,并采用多变量统计方法研究理化指标改善与浮游植物群落变化的关系。研究结果可为流域水污染治理和水生态保护工作提供科学参考。
1 材料与方法
1.1 采样点位设置
在小清河上游设置4个采样点(图1),自上而下分别是睦里庄(S1)、还乡店(S2)、大码头(S3)、辛丰庄(S4)。S1为小清河源头断面,源头水来自玉清湖水库渗水和玉符河河水;S2位于济南市主城区下游,对应主城区排污汇水区;S3、S4位于城市东北部,主要对应工业和农业用水区。
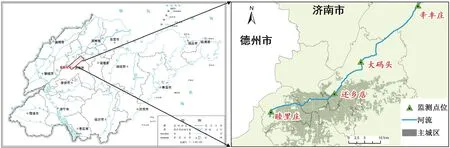
注:底图下载自山东省标准地图服务系统(http://bzdt.shandongmap.cn/standard-map),审图号为鲁SG(2021)026号,下载日期为2022-01-10。图1 采样点分布
1.2 样品采集和检测方法
2015年和2020年的春季(3月)、夏季(7月、8月)、秋季(10月)前后,分别在S1至S4采样点开展采样调查。
浮游植物采样与鉴定方法:在水面下0.5 m左右采集水样1 L。完成样品采集后,立即在样品中加入鲁哥试剂,利用虹吸法缓慢吸去上清液,将下层的浮游植物样品定容至100 mL,使用0.1 mL浮游生物计数框在显微镜(日本Olympus,BX53)下采用目镜视野法进行浮游植物计数,并根据形态学特征鉴定浮游植物种类。
理化指标采样与检测方法:理化指标样品与浮游植物样品同步采集,水温(WT)、pH、溶解氧(DO)使用便携式水质分析仪现场测定,高锰酸盐指数(CODMn)、化学需氧量(COD)、生化五日需氧量(BOD5)、氨氮(NH3-N)、总氮(TN)、总磷(TP)测定参考国家标准方法[20-26]。对于超过方法检出上限的样品,在分析或比色前以适当倍数稀释,通过换算获得样品浓度;对于低于方法检出下限的样品,以检出限的1/2参与计算。
1.3 数据处理与统计分析
选取pH、DO、CODMn、COD、BOD5、NH3-N、TP等7项指标,按照公式(1)和公式(2)计算综合污染指数(P)[27]:
(1)
(2)
式中:i为检测指标,Pi为单项污染指数,Ci为指标i的实测浓度,Si为《地表水环境质量标准》(GB 3838—2002)中指标i的Ⅲ类标准限值,n为参与评价的指标数量。
按照公式(3)计算污染分担率(Ki)[28]:
(3)
按照公式(4)计算浮游植物密度:
(4)
式中:N表示浮游植物密度,个/L;A表示计数框面积,mm2;AC表示计数面积,mm2;V1表示水样经沉淀浓缩后的体积,mL;V表示计数框容积,mL;n为计数所得浮游植物的个体数,个;V0为浓缩前的水样体积,mL;1 000为体积换算系数。
按照公式(5)、公式(6)、公式(7)分别计算Shannon-Wiener多样性指数(H′)、Pielou均匀度指数(J)、Marglef丰富度指数(d)[29]:
(5)
(6)
(7)
式中:ni表示第i个物种的个体数,N表示样品中所有种类的总个体数,S表示样品中所有物种的种类数。
按照公式(8)计算优势度指数:
Y=(ni/N)×fi
(8)
式中:Y表示优势度指数,fi为第i个物种在各站点或月份出现的频次。当Y>0.02时,判定该物种为优势种[30]。综合污染指数和多样性指数评价标准见表1[31]。

表1 水质状况评价标准
使用SPSS 21.0进行数据统计和t检验。非度量多维标度分析(Non-metric Multidimensional Scaling,NMDS)、相似性分析(Analysis of Similarities,ANOSIM)和相似度百分比分析(Similarity Percentage Analysis,SIMPER)使用PAST程序完成。冗余分析(Redundancy Analysis,RDA)使用CANOCO5.0软件,并在开展分析前对除pH以外的理化指标数据和浮游植物数据进行lg(x+1)转换(x为原始数据),使数据趋于正态分布[32-34]。
2 结果与分析
2.1 理化指标变化
2015年,小清河上游综合污染指数为1.67,对应重度污染,NH3-N、TP、DO 3项指标的污染分担率分别达到了37.4%、21.0%、13.8%[图2(a)]。2020年,小清河上游综合污染指数降至0.76,为中度污染,NH3-N、TP、DO 3项指标的污染分担率分别为17.9%、15.2%、6.5%[图2(b)]。配对样本t检验结果显示,治理前后的NH3-N(t=6.144,P<0.001)、TN(t=4.433,P<0.001)、TP(t=5.857,P<0.001)、DO(t=-13.796,P<0.001)浓度均有极显著差异,pH(t=3.038,P=0.008)有显著差异。从沿程变化来看(图3),2015年,污染主要集中于S2至S4采样点,水质均为重度污染及以上级别,其中S2采样点综合污染指数达2.16,为严重污染。2020年,S2至S4采样点综合污染指数为0.83~0.94,均为中度污染,其中最大值仍出现在S2点位,综合污染指数为0.94。

图2 治理前后小清河上游污染分担率
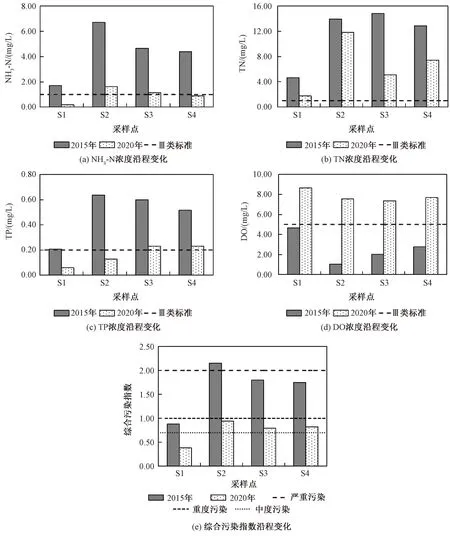
图3 小清河上游污染沿程变化
2.2 浮游植物群落变化
2.2.1 种类组成变化
浮游植物种类数占比见图4。2015年,小清河上游样品中共检出浮游植物6门35种,包括硅藻15种、绿藻11种、蓝藻4种、裸藻2种、甲藻2种、隐藻1种,硅藻、绿藻、蓝藻种类较多,占比分别为42.9%、31.4%、11.4%。2020年,共检出浮游植物4门31种,包括硅藻12种、绿藻12种、蓝藻5种、裸藻2种,仍是硅藻、绿藻、蓝藻种类较多,占比分别为38.7%、38.7%、16.1%。配对样本t检验结果显示,治理前后的浮游植物种类数存在显著差异(t=2.882,P=0.011)。
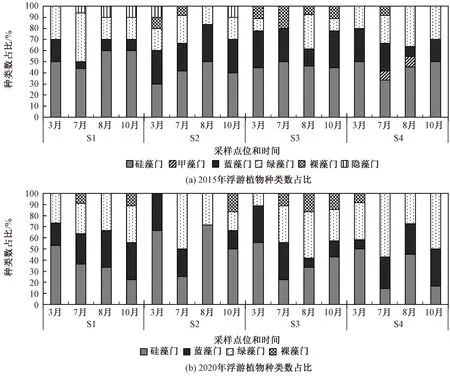
图4 治理前后浮游植物种类数占比
2.2.2 密度和相对丰度变化
浮游植物相对丰度变化见图5。2015年,小清河上游浮游植物密度变化范围为1.10×106~2.60×106个/L,平均值为1.77×106个/L,占比前4位的种类分别是蓝藻(77.2%)、硅藻(13.2%)、绿藻(4.9%)、隐藻(3.5%)。2020年,浮游植物密度变化范围为0.75×106~6.46×106个/L,平均值为1.92×106个/L,占比前4位的种类分别是硅藻(64.9%)、绿藻(18.2%)、蓝藻(14.3%)、裸藻(2.7%)。与2015年相比,硅藻相对丰度上升了51.7个百分点,绿藻上升了13.3个百分点,蓝藻下降了62.9个百分点。配对样本t检验结果显示,治理前后的硅藻(t=-3.701,P=0.002)、绿藻(t=-3.255,P=0.005)密度存在显著差异,蓝藻密度存在极显著差异(t=12.780,P<0.001)。

图5 治理前后浮游植物相对丰度
2.2.3 优势种和群落类型变化
如表2所示,2015年,小清河上游样品中共检出优势种4门8种,包括蓝藻3种、硅藻3种、裸藻和隐藻各1种,平均优势度指数为0.216。不同门类中,以蓝藻的平均优势度指数为最大(0.379),其中微囊藻(Microcysitisspp.)为绝对优势种,优势度指数为0.548~0.697。以优势度指数最大的两种优势种所属门类表征各点位群落类型,除S1为蓝藻-硅藻型外,S2、S3、S4均为蓝藻型。
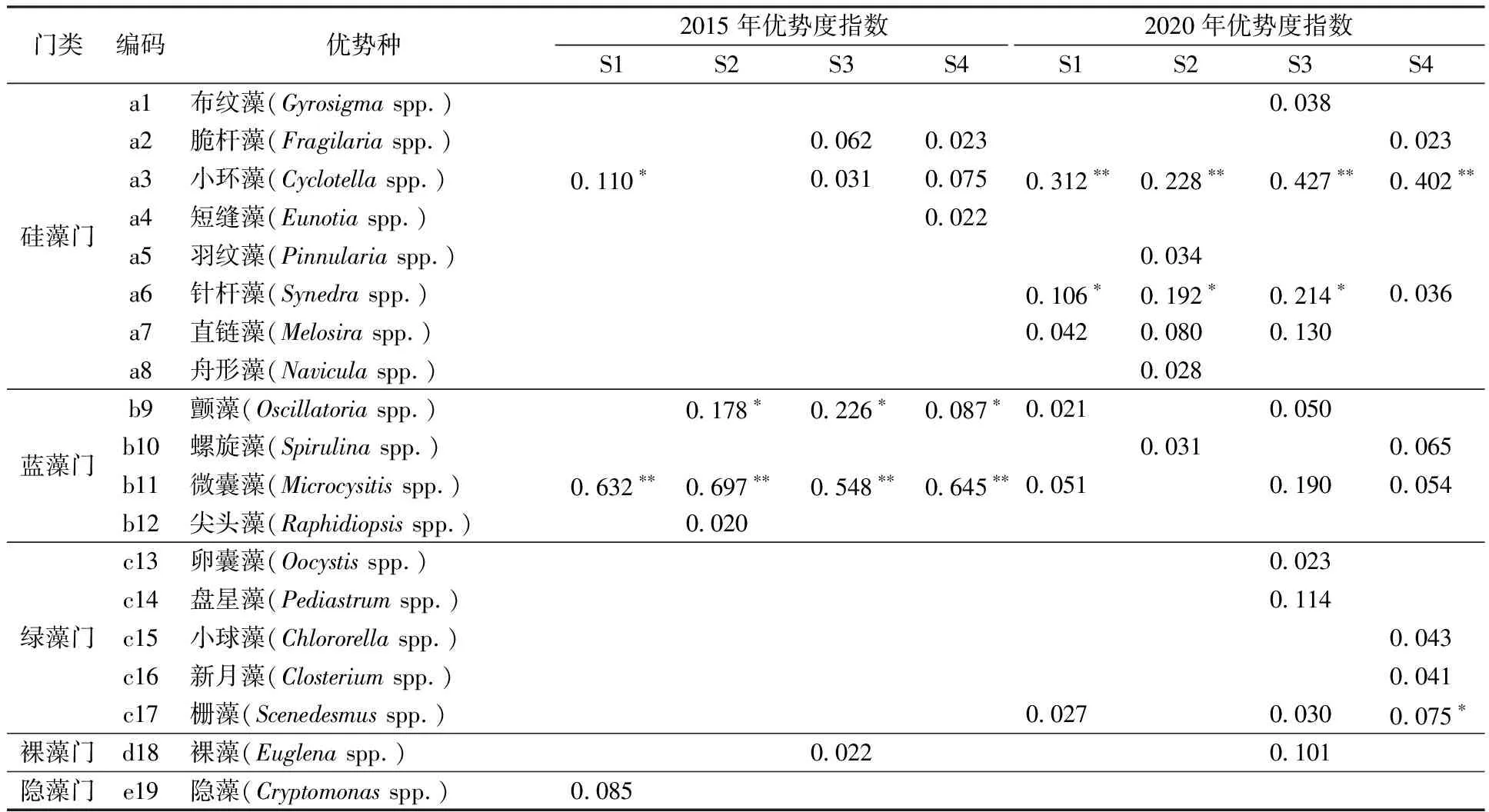
表2 治理前后优势种及优势度指数
2020年,共检出优势种4门16种,包括硅藻7种、蓝藻3种、绿藻5种、裸藻1种,较2015年增加了8种,平均优势度指数为0.107。不同门类中,以硅藻的平均优势度指数为最大(0.153),其中小环藻(Cyclotellaspp.)为绝对优势种,优势度指数为0.228~0.427。以优势度指数最大的两种优势种所属门类表征各点位群落类型,S1、S2、S3均为硅藻型,S4为硅藻-绿藻型。
2.2.4 群落特征变化
在非度量多维标度分析中,点与点之间的距离越小,群落特征越相似;点与点之间的距离越大,群落特征相差越大。如图6所示,2015年和2020年浮游植物群落明显分为两组:2015年,S2与S3采样点群落特征十分相似,S4与S1采样点群落特征差异较大;2020年,S2与S3采样点群落特征表现出差异,S4与S1采样点群落特征相似。相似性分析结果显示,R=0.906 3,P<0.05,表明治理前后的群落特征有显著差异。相似度百分比分析结果显示,污染治理前后群落的相似性百分比只有21.2%。完成治理后,小清河上游浮游植物群落较治理前已经发生明显改变。

注:B代表2015年,A代表2020年。图6 非度量多维标度分析结果
2.2.5 浮游植物与理化指标相关性分析
以治理前后存在显著差异的理化指标和浮游植物优势种作冗余分析(图7)。2015年轴1和轴2分别能解释浮游植物群落特征的55.32%和22.46%,NH3-N、TN、TP、DO、pH是影响研究区群落的主要理化指标。从物种来看,短缝藻(a4)、舟形藻(a8)、螺旋藻(b10)、尖头藻(b12)、颤藻(b9)、卵囊藻(c13)、裸藻(d18)与NH3-N、TN、TP呈正相关,脆杆藻(a2)、小环藻(a3)与之呈负相关。从点位来看,S1样本主要分布于第一、四象限,pH、DO是影响其群落特征的主要理化指标;S2、S3、S4样本主要分布于第二、三象限,NH3-N、TN、TP是影响其群落特征的主要理化指标。
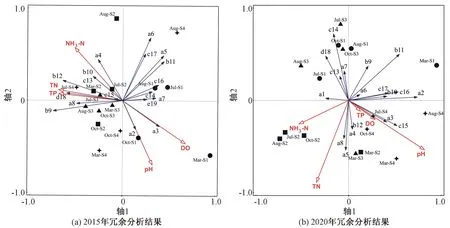
注:各编码(a1~e19)对应的物种见表2。“Mar”表示3月,“Jul”表示7月,“Aug”表示8月,“Oct”表示10月。图7 浮游植物与理化指标的冗余分析
2020年轴1和轴2分别能解释浮游植物群落特征的40.42%和30.58%,TN、NH3-N、pH是影响研究区群落特征的主要理化指标,TP、DO对群落的影响减小。布纹藻(a1)、短缝藻(a4)、羽纹藻(a5)、舟形藻(a8)、尖头藻(b12)等5个种类与NH3-N、TN呈正相关,脆杆藻(a2)、小环藻(a3)、针杆藻(a6)、直链藻(a7)、颤藻(b9)、螺旋藻(b10)、微囊藻(b11)、盘星藻(c14)、小球藻(c15)、新月藻(c16)、栅藻(c17)等11个种类与NH3-N、TN呈负相关。S1、S3样本交叉分布于第一、二象限,与NH3-N、TN、pH呈负相关;S2样本主要聚集于第三、四象限,NH3-N、TN是影响其群落特征的主要理化指标;S4样本主要聚集于第四象限,pH是影响其群落特征的主要理化指标。
2.2.6 多样性指数与水质评价
治理前后多样性指数及评价结果见表3。2015年,小清河上游Shannon-Wiener多样性指数等于1.17,为中污染(α-中污染);Pielou均匀度指数等于0.49,为中污染(β-中污染);Marglef丰富度指数等于1.32,为中污染(α-中污染)。2020年,Shannon-Wiener多样性指数上升到1.78,仍为中污染(α-中污染);Pielou均匀度指数上升到0.84,为寡污染;Marglef丰富度指数下降到1.05,为中污染(α-中污染)。配对样本t检验结果表明,治理前后的小清河上游Shannon-Wiener多样性指数(t=-8.221,P<0.001)、Pielou均匀度指数(t=-11.75,P<0.001)和Marglef丰富度指数(t=3.435,P=0.004)均存在显著差异。Pearson相关性分析结果显示,Shannon-Wiener多样性指数、Pielou均匀度指数与综合污染指数呈显著相关(P<0.01),相关系数分别为-0.512和-0.569。

表3 污染治理前后多样性指数和水质评价结果
3 讨论
3.1 治理前后浮游植物群落变化
经过污染治理,小清河上游浮游植物种类由35种减少为31种,密度平均值由1.77×106个/L上升到1.92×106个/L,相对丰度、优势种都发生了明显变化,小环藻(Cyclotellaspp.)取代微囊藻(Microcysitisspp.)成为绝对优势种,群落类型整体由蓝藻型向硅藻型过渡。相似性分析结果和相似度百分比分析结果都表明,经过污染治理,小清河上游浮游植物群落特征已经发生显著改变。小清河是黄河山东段重要的伴行河流。两条河流所在区域的自然环境和气候条件相似,实行相同的水污染防治政策。文献报道显示,2015年后,黄河山东段硅藻和绿藻种类增加,硅藻密度和生物量在所有门类中占比最大,小环藻和针杆藻几乎在所有断面都为优势种[35-36],浮游植物群落变化情况与本研究结果相似。
张晶晶等[37]对经小清河专项治理后的莱州湾环境和浮游植物群落变化的研究显示,氮磷营养盐浓度变化与优势种的改变明显相关。小清河上游氮磷营养盐主要来源于主城区污水,其中:第一污染来源为污水处理厂尾水,污染贡献度为34.0%;第二污染来源为直排污水,污染贡献度为29.1%[38]。为解决污水处理厂尾水和直排污水收集问题,2015—2020年,济南市新建改建污水处理设施23座,新建污水管网1 883.58 km,主城区污水处理能力增加了44万t/d,基本实现主城区污水全收集、全处理,有效遏制了主城区对流域的氮磷污染输入,使上游TN、TP、NH3-N浓度显著下降。
浮游植物对营养盐绝对浓度和氮磷比(N/P,摩尔比)的响应具有种属特异性。蓝藻喜好高氮高磷环境,硅藻喜好低磷环境,绿藻更适合在中氮高磷条件下生长[39-40]。SCHINDLER[41]、SMITH[42]的氮磷比学说认为,低氮磷比有利于蓝藻形成优势,高氮磷比更有利于硅藻形成优势。2020年,S2、S3、S4采样点TP年均值降低到了0.20 mg/L,较2015年下降66.3%,氮磷比由55∶1上升到120∶1,最大值达220∶1,表明治理后的流域磷限制明显增强。受低磷限制,蓝藻生长繁殖速度受到一定影响,而氮磷比的上升为硅藻取代蓝藻成为优势种创造了有利条件。由此,群落类型整体向硅藻型过渡。文献报道显示,2019年汉江下游TP浓度在0.1 mg/L左右,低磷条件明显限制了蓝藻的生长,使群落中蓝藻的种类、密度占比都小于硅藻[43]。这与本研究结果一致。值得注意的是,治理后的S2、S3、S4采样点TN年均值仍可达到8.11 mg/L,最大值达13.90 mg/L。相比汉江的低TN浓度(<2 mg/L),高氮条件在一定程度上限制了小清河上游绿藻的扩增,使绿藻相对丰度明显小于硅藻。随着治理重点向氮污染偏移,河流会逐渐向中氮环境过渡,TN浓度的降低会刺激绿藻的增长,使浮游植物群落向硅藻-绿藻型演替。
3.2 浮游植物与理化指标的关系
浮游植物群落演替是众多环境因子在时间和空间上相互影响的结果[44]。治理前,NH3-N、TN、TP、DO、pH都是影响研究区域群落特征的主要理化指标,而治理后,TP、DO对群落的影响作用明显减弱。DO是表征水体污染程度的重要指标,较低的DO会抑制浮游植物的生长[45]。2015年小清河上游DO平均浓度为2.62 mg/L,仅达到《地表水环境质量标准》(GB 3838—2002)Ⅲ类标准(5 mg/L)的52.4%。以蓝藻为主要优势种的浮游植物群落在生长繁殖过程中会大量消耗水中的氧气,造成水体DO浓度进一步降低。浮游植物对氧气的竞争使DO成为影响流域浮游植物生长的关键因子,并与优势种密度呈负相关。治理后,小清河上游DO平均浓度上升到7.81 mg/L,加之光合型藻类可以通过光合作用向水体释放氧气,以及绿藻、蓝藻密度占比的改变,使氧气不再是浮游植物的主要竞争资源,DO对群落的影响作用减弱。磷是浮游植物实现物质合成和能量传输的必要元素,其浓度变化会影响藻类的代谢及群落的动态格局[46]。硅藻偏好低磷环境。在治理过程中,随着硅藻在群落中逐渐占据优势,硅藻型群落对磷的整体需求较治理前的蓝藻型群落有所降低,因此,TP对群落的影响减弱。
对于湖泊型生态系统,浮游植物一般与氮磷指标正相关[47-49]。对于河流型生态系统,浮游植物与氮磷指标的关系比较复杂。在受污染、营养化水平高的河流,浮游植物多与TP、TN正相关,而在水质清洁、营养化水平低的河流,多与TP、TN负相关。例如:长江和澜沧江源区(TP浓度<0.08 mg/L,TN浓度<1 mg/L)蓝藻密度与TP负相关[50];淮河上游典型支流水质较好的主河道的浮游植物优势种多与TP、TN负相关,水质较差的古河道的浮游植物优势种与TP、TN呈现一定程度的正相关[51];营养化水平较低的锦江河(综合营养状态指数=36.05)的浮游植物密度与TP、TN负相关,营养化水平较高的南明河(综合营养状态指数=61.76)的浮游植物密度与 TN、TP正相关[52]。本研究冗余分析结果显示:治理前,有7种浮游植物与TN、NH3-N、TP明显正相关,2种与TN、NH3-N、TP负相关;治理后,有5种浮游植物与NH3-N、TN正相关,11种与NH3-N、TN负相关。以上结果符合河流型水体中浮游植物与环境因子的相关性规律,同时也表明小清河上游水质整体呈改善趋势。
从空间上来看,S2、S3、S4采样点都位于主城区下游。冗余分析结果显示,治理前,S2、S3、S4采样点浮游植物样本分布集中,并且都与TN、NH3-N、TP正相关。非度量多维标度分析结果表明,S2和S3采样点群落特征十分相似。这说明主城区氮磷污染同时影响了S2、S3、S4采样点的浮游植物群落,特别是使S2和S3采样点的群落特征呈现高度相似。治理后,S2采样点群落与S3、S4采样点群落分离,S2采样点浮游植物仍与TN、NH3-N正相关,S3采样点浮游植物与TN、NH3-N负相关,S4采样点浮游植物与pH正相关。非度量多维标度分析结果显示,S2和S3两点位的浮游植物群落特征已经明显不同,S4点位的群落特征与源头断面S1表现出一定的相似性。冗余分析结果和非度量多维标度分析结果都表明,主城区污染对下游浮游植物的影响范围由S2、S3、S4采样点缩小到S2采样点,S3、S4采样点浮游植物群落受上游污水的影响明显减弱。S2采样点群落仍受主城区影响,但主要影响指标由TN、NH3-N、TP变为TN、NH3-N,表明流域磷污染对下游浮游植物群落的影响范围缩小。
3.3 不同生物指数的水质评价结果
从水质现状来看,治理后小清河上游水质的Shannon-Wiener多样性指数、Marglef丰富度指数评价结果均为中污染(α-中污染),与综合污染指数评价结果一致,而Pielou均匀度指数评价结果为寡污染(清洁)。从变化趋势来看,Shannon-Wiener多样性指数、Pielou均匀度指数指示治理后水质有所改善,与综合污染指数评价结果一致,而Marglef丰富度指数指示水质有所退化。Shannon-Wiener多样性指数在治理后的现状评价和趋势评价上的评价结果与综合污染指数一致,表明Shannon-Wiener多样性指数是当前更适用于小清河上游水质评价的生物多样性指数。
为解决河流环境容量和自净能力不足的问题,治理期间,小清河上游曾进行多轮生态补水[53]。原水和客水的混合会加快不同水层间营养盐和浮游植物的交换及混合,使浮游植物的分布更趋均匀。滏阳河、太湖贡湖湾、东平湖在接收补水或调水后,Pielou均匀度指数较补水前均有不同程度的上升[54-56]。因此,生态补水是造成治理后小清河上游Pielou均匀度指数偏大的原因之一,使Pielou均匀度指数评价结果优于其他两种指数。
汛期的小清河上游水质不稳定,存在短期NH3-N、TP浓度高值。同时,河道清淤造成的沉积物内源性污染释放也会使NH3-N、TN、TP浓度出现超标[57-58]。水质波动会冲击群落物种组成,导致清洁种可能会由此消失。同时,汛期河流水量增长使密度较低的浮游植物种类更不容易被采集到,成为造成Marglef丰富度指数下降的主要原因。对比治理前后浮游植物的种类可以发现,虽然治理后小清河上游浮游植物种类由35种减少到31种,但减少的种类主要是喜污的隐藻、甲藻和指示富营养水体的冠盘藻。因此,虽然治理后Marglef丰富度指数减小,但从群落物种组成上来看,研究区域的水质仍呈改善趋势。
4 结论
1)经过污染治理,小清河上游浮游植物种类由35种减少为31种,密度平均值由1.77×106个/L上升到1.92×106个/L,硅藻、绿藻相对丰度分别上升了51.6个百分点和13.3个百分点,蓝藻相对丰度下降了62.9个百分点,优势种由8种增加到16种,小环藻(Cyclotellaspp.)取代微囊藻(Microcysitisspp.)成为绝对优势种,群落类型整体由蓝藻型向硅藻型过渡,表明治理前后的群落特征发生显著改变。
2)治理后,TP、DO对浮游植物群落的影响明显减弱,TN、NH3-N、pH成为当前影响浮游植物群落特征的主要理化指标。主城区氮磷污染对小清河上游浮游植物群落特征的影响范围由S2、S3、S4采样点缩小到S2采样点。
3)Shannon-Wiener多样性指数是当前更适用于小清河上游水质评价的生物多样性指数。治理后,小清河上游处于α-中污染状态,水质较治理前有明显改善。
