生物信息学方法筛选结肠癌相关lncRNA-miRNA网络及其细胞水平的功能验证
2024-03-04潘希望邱模竞郑林林杨新博李太原胡家萍
潘希望,邱模竞,郑林林,杨新博,徐 晨,李太原,胡家萍
(南昌大学第一附属医院普外科,南昌 330006)
1 材料与方法
1.1 材料
细胞株:人结肠癌HCT116细胞系购自中国科学院细胞库。主要试剂:DMEM高糖培养基(Gibco);胎牛血清(Gibco);青霉素-链霉素溶液(Biosharp);TSPEAR-AS2 shRNA质粒载体(上海吉玛基因);Opti-MEM培养基(Gibco);CCK-8试剂盒(新赛美生物科技);Lipofectamine©2000(Invitrogen);Annexin V-FITC细胞凋亡检测试剂盒(北京索莱宝科技);TRIzol(Invitrogen)。主要仪器:CO2培养箱(Thermo);酶标仪(BIO-TEK);离心机(Eppendorf);荧光定量PCR仪(BIO-RAD);流式细胞仪(Beckman Coulter);倒置显微镜(Nikon)。
1.2 方法
1.2.1 数据库资料获取及预处理
从TCGA数据库(https://www.cancer.gov/ccg/research/genome-sequencing/tcga)中下载452例结肠癌患者的基因表达谱数据,包括临床信息、lncRNA及miRNA表达数据。提取lncRNA及miRNA表达数据,生成相应的表达矩阵。保留临床信息中患者的生存时间、生存状态等资料。使用R软件limma包,对下载的lncRNA和miRNA表达矩阵进行预处理,包括数据背景校正、中位数标准化以及基因名转换等。
1.2.2 差异表达分析
使用R软件limma包对标准化后lncRNA和miRNA表达数据进行差异表达分析,设定阈值:|差异倍数|≥2及P<0.05,筛选结肠癌组织和癌旁组织中差异表达lncRNA(DE-lncRNA)和miRNA(DE-miRNA)。
You should look up the words.Their meanings are unclear.
1.2.3 单因素Cox回归分析
整合结肠癌患者的临床信息(包括生存时间和生存状态)和癌组织中DE-lncRNA及DE-miRNA表达谱,使用R软件survival包,对DE-lncRNA和DE-miRNA进行单因素Cox回归分析。根据HR值和P值筛选与预后显著相关的lncRNA和miRNA。
1.2.4 lncRNA-miRNA网络的构建
采用miRNet数据库(https://www.mirnet.ca/miRNet/home.xhtml),探究上述预后相关lncRNA和miRNA之间的相互关系,剔除癌组织和癌旁组织中表达趋势一致的lncRNA-miRNA对,构建lncRNA-miRNA网络。
1.2.5 功能富集分析
采用mirPath v.3软件对lncRNA-miRNA网络进行功能富集分析,包括GO分析和KEGG分析,并绘制相应的气泡图。
1.2.6 预后模型构建
使用R软件glmnet包进行LASSO回归分析以构建结肠癌患者预后模型。整合结肠癌患者的生存时间、生存状态和差异lncRNA-miRNA的表达数据;利用LASSO-Cox算法进行变量选择,通过十折交叉验证选取最优λ值,从所有特征基因中筛选出与患者预后显著相关的关键特征基因。根据特征基因的系数(Coefficients)生成预后风险评分公式:风险评分(RiskScore)=∑Coefficients×expi(expi代表第i个特征基因的表达值)。根据风险评分将所有患者分为高危组和低危组。采用survival包进行Kaplan-Meier生存分析,通过log-rank检验比较2组患者的生存差异。使用survivalROC包绘制ROC曲线并计算AUC值,评估构建的预后模型对患者生存预测的特异性和敏感性。
1.2.7 细胞分组及处理
使用含10%胎牛血清的DMEM培养基,37 ℃、5% CO2培养箱中培养人结肠癌HCT116细胞,按细胞生长状态每2~3天传代1次。将实验细胞分为对照组和TSPEAR-AS2敲减组(敲减组)。敲减组采用Lipofectamine©2000转染试剂将TSPEAR-AS2 shRNA表达载体转染至HCT116细胞,对照组加入等量培养基。转染24 h后,提取2组总RNA,采用qPCR检测TSPEAR-AS2的表达水平,验证沉默效率。
1.2.8 CCK-8实验
将2组细胞以2×103细胞·孔-1接种于96孔板,每孔加入100 μL培养基。转染后24、48、72 h加入CCK-8试剂10 μL,孵育1 h,使用酶标仪检测各孔450 nm处吸光度值(OD值)。
1.2.9 划痕实验
取对数生长期2组细胞接种于六孔板,每孔加入2 mL含有1×105细胞·孔-1的DMEM培养基。待细胞融合至80%~90%时,使用无菌200 μL枪头进行划痕,PBS洗涤细胞,继续培养24 h。在划痕 0 h和24 h分别观察并拍照记录2组细胞,Image J软件分析并计算2组细胞迁移率。
1.2.10 流式细胞术
取对数生长期2组细胞接种于六孔板,每孔加入2 mL含1×105细胞·孔-1的DMEM培养基。培养24 h后收集细胞,调整密度为1×106细胞·mL-1。将细胞重悬于结合缓冲液中,加入Annexin V-FITC/PI进行染色,室温避光孵育15 min。采用流式细胞仪检测2组细胞凋亡情况。
1.2.11 qPCR实验
TRIzol法提取2组细胞总RNA,采用反转录试剂盒PrimeScript RT Master Mix进行逆转录合成cDNA。qPCR检测TSPEAR-AS2、hsa-mir-4731-5p和hsa-mir-342-3p的表达。以GAPDH作为TSPEAR-AS2的内参照基因,U6作为hsa-mir-4731-5p和hsa-mir-342-3p的内参照基因。目的基因与内参基因引物见表1。qPCR反应40个循环(95 ℃ 10 s,53~58 ℃ 30 s,72 ℃ 30 s)。
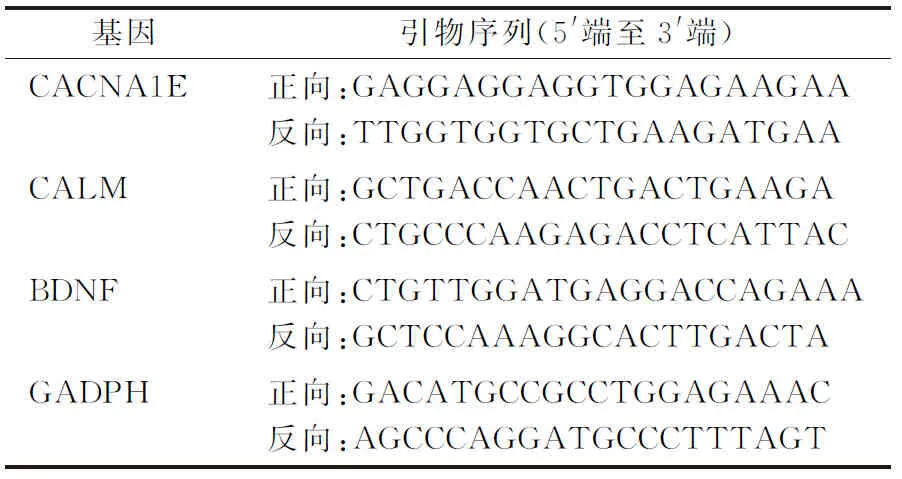
表1 各基因引物序列
1.2.12 统计学方法
采用SPSS19.0软件进行数据处理。计量资料以均数±标准差表示,2组间比较采用独立样本t检验。以P<0.05为差异有统计学意义。
2 结果
2.1 结肠癌组织中差异表达的lncRNA和miRNA
差异表达分析结果显示,结肠癌组织和癌旁组织中1823个差异表达lncRNA(DE-lncRNA)和524个差异表达的miRNA(DE-miRNA),其中980个lncRNA和421个miRNA在结肠癌组织中显著下调,843个lncRNA和103个miRNA在结肠癌组织中显著上调。见图1。
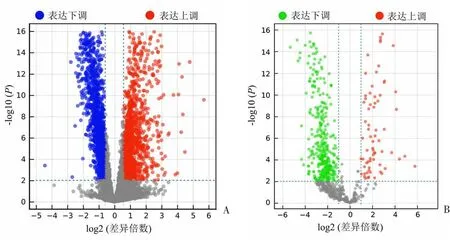
A:差异表达lncRNA的火山图。B:差异表达miRNA的火山图。图1 结肠癌组织中差异表达lncRNA和miRNA的火山图
2.2 结肠癌预后相关lncRNA和miRNA
单因素Cox回归分析结果显示,158个lncRNA和31个miRNA与预后相关。
2.3 成功构建结肠癌预后相关的lncRNA-miRNA网络
miRNet数据库结果显示,22对与预后相关的lncRNA-miRNA存在互作,包括8个lncRNA和14个miRNA 。见图2。结肠癌组织中这些lncRNA和miRNA的表达见图3。与癌旁组织比较,5个lncRNA(SNHG16、LINC00894、MIR503HG、TSPEAR-AS2和LINC00858)在结肠癌组织中显著上调,3个lncRNA(CYP1B1-AS1、LINC00324和FENDRR)在结肠癌组织中显著下调;3个miRNA(hsa-mir-493、hsa-mir-495和hsa-mir-708)在结肠癌组织中显著上调,11个miRNA(hsa-mir-4731、hsa-mir-6875、hsa-mir-149、hsa-mir-342、hsa-let-7a-3、hsa-let-7e、hsa-mir-1301、hsa-mir-205、hsa-mir-488、hsa-let-7a-2和hsa-mir-193b)在结肠癌组织中显著下调。
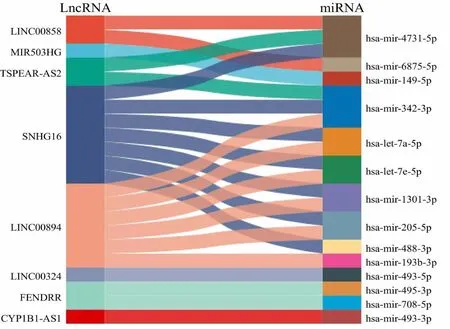
图2 与预后相关的lncRNA-miRNA互作网络
2.4 lncRNA-miRNA网络的功能富集分析
GO富集分析结果显示,lncRNA-miRNA网络主要富集在细胞氮化合物代谢过程、离子结合、生物合成过程、细胞蛋白质修饰过程、神经营养素 TRK 受体信号通路、基因表达、核酸结合转录因子活性、共生,包括从寄生到互生的过程等生物学功能。KEGG富集结果显示,lncRNA-miRNA网络调控结肠癌发生发展和预后的分子机制可能涉及癌症中的蛋白聚糖、TGF-β信号通路、ErbB信号通路、Hippo信号通路、GABA能突触、昼夜节律调节、黏着斑、癌症的发病途径等信号通路。按显著性大小排名前30的生物学功能和信号通路气泡图见图4。
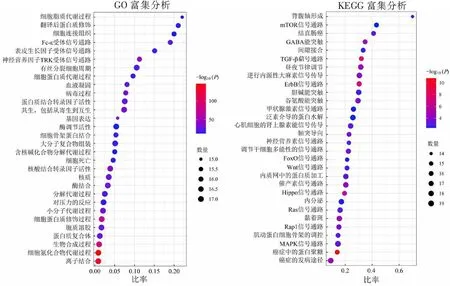
图4 lncRNA-miRNA网络的功能富集分析
2.5 成功构建预后模型
采用LASSO-Cox回归模型,通过十折交叉验证,选择最优参数λ=0.03,最终从lncRNA-miRNA网络中鉴定出11个能够有效评价结肠癌预后特征的关键基因。见图5A。以11个关键基因构建预后风险模型,预后模型风险评分计算如下:
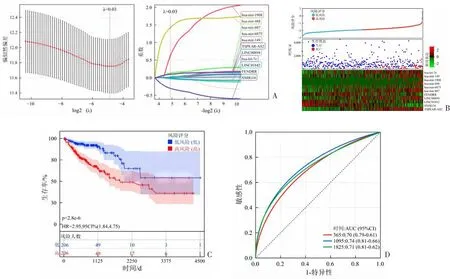
A:LASSO回归筛选关键预后基因;B:预后模型评价结肠癌患者的风险状态;C:Kaplan-Meier生存曲线;D:ROC曲线。图5 预后模型的构建及评估
风险评分=-0.032 0×FENDRR+0.016 9×LINC00894-0.007 5×LINC01842-0.305 8×SNHG16+0.965 3×TSPEAR-AS2+0.001 5×hsa-let-7e+0.016 2×hsa-mir-149+0.623 5×hsa-mir-1908+1.421 9×hsa-mir-488+0.020 8×hsa-mir-6875+0.132 0×hsa-mir-887。预后模型对结肠癌患者风险状态的评价效果显示,高风险组生存状态低于低风险组。见图5B。Kaplan-Meier分析结果显示,高风险组生存时间显著短于低风险组(P<0.001)。见图5C。ROC曲线结果显示,该模型预测1年(365 d)、3年(1095 d)和5年(1825 d)生存的AUC分别为0.70、0.74和0.71。见图5D。后续实验选择预后模型中风险系数及表达差异最大的lncRNA(TSPEAR-AS2)进行细胞水平验证。
2.6 TSPEAR-AS2敲减效率
qPCR结果显示,与对照组比较,敲减组中TSPEAR-AS2的表达量显著下降(下降71.84%,P<0.01),表明敲减效果良好,见图6。
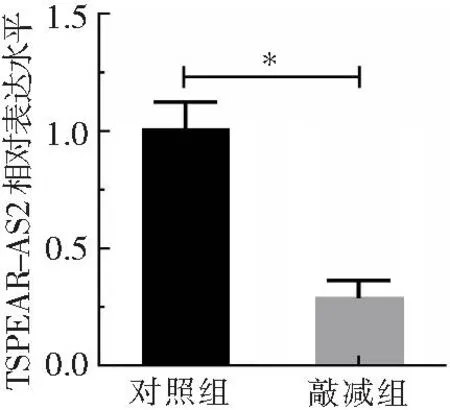
*P<0.01。图6 2组TSPEAR-AS2表达
2.7 TSPEAR-AS2敲减对结肠癌细胞增殖、迁移和凋亡的影响
与对照组比较:敲减组24、48、72 h细胞活力均显著降低(P<0.01),见图7A;敲减组细胞迁移能力显著降低(P<0.01),见图7B—C;流式细胞术结果显示,敲减组凋亡细胞比例显著增加(P<0.01),见图7D—E。
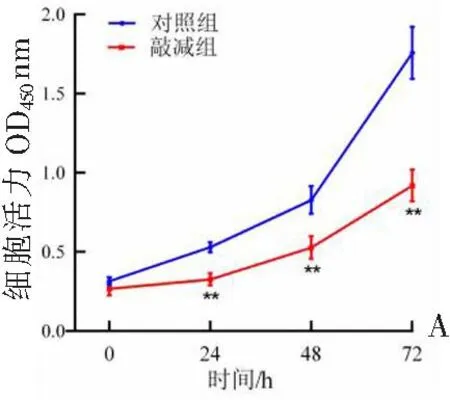
A:CCK-8实验;B:划痕实验图;C:2组相对迁移率比较。图7 TSPEAR-AS2敲低对HCT116细胞增殖、迁移和凋亡的影响
2.8 TSPEAR-AS2敲减对miRNA表达的影响
在lncRNA-miRNA网络中,hsa-mir-4731-5p和hsa-mir-342-3p是TSPEAR-AS2的下游靶标。qPCR结果显示,下调TSPEAR-AS2表达能显著增强结肠癌细胞中hsa-mir-4731-5p和hsa-mir-342-3p的表达。见图8。

*P<0.01。图8 敲减TSPEAR-AS2对相关miRNA表达的影响
3 讨论
lncRNA作为miRNA的分子海绵,通过与miRNA间的互补配对,抑制miRNA的表达。lncRNA也可以作为竞争性内源RNA,与miRNA的靶基因mRNA竞争结合,抑制miRNA对靶基因的调控[4]。它们可通过参与调节细胞增殖、凋亡、细胞周期等多个生物学过程影响肿瘤的进程[7]。lncRNA-miRNA调控网络在结肠癌等肿瘤疾病的发生发展中发挥中重要作用[7-8]。例如,lncRNA HOTAIR高表达是结肠癌患者预后不良的风险因素,它能够与miR-34a海绵结合而抑制其表达,进而促进结肠癌细胞增殖,侵袭和迁移[9]。lncRNA ZFAS1通过与miR-200b和miR-200c结合,上调ZEB1表达,进而抑制结肠癌细胞增殖、转移和上皮间质转化[10]。因此,探究lncRNA-miRNA调控网络,对于揭示结肠癌的发病机制以及评价结肠癌预后具有重要意义。
本研究运用生物信息学方法分析结肠癌样本中lncRNA和miRNA的差异表达谱,筛选出与预后相关的lncRNA-miRNA对。其中一些lncRNA-miRNA对在结肠癌或其他肿瘤疾病中发挥重要作用。比如,YANG等[11]研究表明,SNHG16-hsa-mir-342-3p调控机制在多发性骨髓瘤中发挥着重要作用。敲除lncRNA SNHG16可通过降低与miR-342-3p的海绵吸附作用,促进miR-342-3p表达,进而抑制多发性骨髓瘤细胞增殖。YAN等[12]研究表明,SNHG16可能抑制miR-342-3p与EP300之间的相互作用,从而影响肺腺癌中淋巴转移过程。XIA等[13]研究发现,SNHG16通过与miR-205-5p结合,抑制miR-205-5p对P21激活激酶2(PAK2)的调控作用,导致PAK2表达增加,促进黑色素瘤的转移和生长。而SNHG16高表达和miR-205-5p低表达均可以促进结肠癌细胞的生长[14-15]。另,本研究功能富集分析结果显示,这些lncRNA-miRNA网络主要富集在TGF-β信号通路、ErbB信号通路、Hippo信号通路等肿瘤相关的生物学功能和信号途径。有研究[16]发现,TGF-β信号通路激活可促进结肠癌细胞的上皮-间质转化,增加其侵袭和转移能力。ErbB信号通路的活化能促进结肠癌细胞的增殖、抗凋亡、促血管生成等作用[17]。而Hippo通路失活会导致YAP/TAZ的持续激活,促进结肠癌的生长和转移[18]。而且,本研究基于这些lncRNA和miRNA构建的预后风险模型能较好地评价结肠癌患者的生存状态。
已有研究[19-20]表明TSPEAR-AS2在乳腺癌、口腔鳞状细胞癌和胃癌中高表达,而敲低TSPEAR-AS2可改善这些肿瘤进程,抑制癌细胞的生长和转移。本研究以TSPEAR-AS2为代表,分析lncRNA在结肠癌细胞中的功能,结果显示,下调TSPEAR-AS2能抑制结肠癌细胞的增殖和迁移,促进其凋亡。此外,生物信息学结果显示,TSPEAR-AS2可能与hsa-mir-4731-5p和hsa-mir-342-3p形成lncRNA-miRNA网络,在结肠癌中发挥重要作用。虽然既往研究[21-24]显示hsa-mir-4731-5p和hsa-mir-342-3p在多种肿瘤中起抑癌作用,但目前尚不明确TSPEAR-AS2是否可以影响结肠癌细胞中hsa-mir-4731-5p和hsa-mir-342-3p的表达。本研究发现,敲减TSPEAR-AS2可显著上调结肠癌细胞中hsa-mir-4731-5p和hsa-mir-342-3p的表达。
综上所述,本研究成功筛选结肠癌相关lncRNA-miRNA网络,并据此构建的预后风险模型具有良好的预测效能。TSPEAR-AS2参与调控结肠癌细胞的增殖、迁移、凋亡以及下游miRNA表达。这些研究将为结肠癌的诊断、治疗和预后评估提供潜在的生物标志物。
