慢性铝中毒对大鼠记忆功能的影响
2024-03-04李晨羽贾芸菁甘珏方廉春容李莎莎凌雁武
李晨羽,贾芸菁,甘珏方,廉春容,李莎莎,凌雁武
(右江民族医学院基础医学院,广西 百色 533000)
铝已经成为工业、农业、医疗和日常生活等多个领域中极其重要且广泛使用材料[1],但环境中的铝正日益明显地影响着人类的健康。以往研究[2]指出,铝能够穿过血脑屏障进入大脑,并在多个神经元区域(如内嗅皮层、海马和下丘脑)中积聚。有研究[3]显示,铝与阿尔茨海默病(AD)密切相关,认知障碍患者脑中的铝含量明显高于正常对照组,表明铝是认知障碍的重要危险因子之一。CACNA1E基因编码钙离子通道蛋白的α1E亚基,具有重要的生物学功能,能调节细胞内钙离子的运输,影响细胞的生长和生理功能[4]。钙调蛋白(calmodulin,CALM)是CACNA1E的下游蛋白[5],与AD、癫痫、帕金森病和抑郁症等疾病有关[6]。脑源性神经营养因子(BDNF)是一种重要的神经生长因子,AD患者海马区域的BDNF表达显著降低[7]。
本课题组的前期研究[8]通过第二代高通量测序技术对高铝认知障碍人群的血清样本进行了分析,筛选出CACNA1E下调血清外泌体表达与高铝认知障碍之间的关联。本研究将利用铝致认知障碍大鼠模型验证这一关联,并探究究CACNA1E、CALM和BDNF在铝致认知障碍中的作用。
1 材料与方法
1.1 实验动物
雄性Wistar大鼠由长沙市天勤生物技术有限公司[SCXK(湘)2022-0014]提供,总数为48只,每只体重约为(200±20)g,饲养于右江民族医学院实验动物中心。对实验动物的操作处理符合医学伦理学标准和动物3R原则,本研究经右江民族医学院伦理委员会批准。
1.2 主要试剂与仪器
三氯化铝(AlCl3)购自广东光华化学厂有限公司;CACNA1E、CALM、BDNF抗体购自杭州华安生物技术有限公司;PCR引物委托上海生工生物股份工程有限公司合成;Morris水迷宫分析系统购自成都泰盟公司;ECLIPSEE100正置显微镜购自日本尼康公司。
1.3 实验方法
1.3.1 动物分组与给药方法
将大鼠随机划分成对照组和低、中、高剂量组各12只,建立慢性铝中毒模型。用配置好的AlCl3溶液对低、中、高剂量组进行灌胃,剂量分别为25、50、100 mg·kg-1,同时予以对照组等体积的生理盐水灌胃。4组均每天给药1次,连续90 d。
1.3.2 Morris水迷宫实验
造模完成后进行为期5 d的水迷宫定位航行实验。自第1天起,将大鼠放进水迷宫池,在相同的时间范围内,观察和记录其逃避潜伏期(从入水到找到安全平台所需的时间),如果大鼠1 min内未找到平台,则记录潜伏期为60 s。连续测试4 d,以评估各组大鼠的学习能力。
第5天,拆除水池中的安全平台,观察和记录大鼠在原平台所在象限停留的时长和穿过原平台位置的次数,以此评估其记忆能力。
1.3.3 苏木素伊红和尼氏染色
麻醉大鼠后,将其断头处死,完整取出脑组织,用4%的多聚甲醛溶液处理。制成5 μm的石蜡切片,烘干,二甲苯脱蜡,最终用酒精进行脱水。苏木素伊红染色切片经过苏木素、氨水和伊红的处理,用蒸馏水冲洗;尼氏染色切片加1%甲苯胺蓝溶液后,置于温箱内,浸染30 min,冲洗后用无水乙醇浸泡5 min;全部切片迅速脱水后封片,干燥后置于显微镜下观察。
1.3.4 实时定量PCR
从脑组织中分离出海马,使用眼科剪刀将海马组织剪碎,并使用Monzol TM试剂提取总RNA,通过分光光度计检测RNA质量和浓度。按试剂盒说明书,进行逆转录和实时定量PCR的操作。采用2-ΔΔCt法计算CACNA1E、CALM、BDNF mRNA的相对表达水平(内参为GADPH)。引物名称及序列见表1。

表1 引物名称及序列
1.3.5 蛋白免疫印迹
麻醉大鼠后将其断头处死,从脑部取出完整的海马组织,使用RIPA裂解液在冰上进行取样和匀浆后,离心分离上清液,用BCA法测定蛋白浓度。取各组样本上样,用浓度为10%的SDS-PAGE凝胶进行电泳,之后将蛋白质转移到PVDF膜上。用5%脱脂奶粉封闭处理2 h,TBST洗膜后,于4 ℃进行一抗孵育过夜。第二天进行TBST洗膜,经过1 h 的二抗孵育和PBST洗膜处理后,使用ECL化学发光法显色,拍照后采用Image J软件进行相关蛋白条带的分析和计算。
1.4 统计学方法

2 结果
2.1 慢性铝中毒影响大鼠空间学习和记忆能力
Morris水迷宫定位航行实验期间,随着实验的重复各组的逃避潜伏期均逐渐缩短,中、高剂量组大鼠的逃避潜伏期明显长于同期对照组(P<0.05或P<0.01),低剂量组与对照组比较差异无统计学意义(P>0.05),见表2。空间探索实验结果显示,与空白对照组相比,低剂量组无明显变化,中、高剂量染铝组大鼠在目标象限停留时间显著缩短,穿越平台次数显著减少,差异具有统计学意义(P<0.05),见表3。

表2 各组定位航行实验逃避潜伏期比较
表3 各组空间探索实验结果比较
2.2 慢性铝中毒引起大鼠海马区病理变化
HE染色结果显示,对照组海马CA1区和CA3区的细胞排列有序,边界清晰可见;随着铝剂量的增加,低、中、高剂量组海马CA1和CA3区逐渐出现细胞边界明显模糊,细胞体积显著减小,胞浆呈现出深红色,核固缩,最终细胞变形,排列紊乱。见图1—2。

A:对照组;B:低剂量组;C:中剂量组;D:高剂量组。图1 4组海马CA1区HE染色(比例尺:10 μm)
尼氏染色结果显示,对照组海马CA1区和CA3区的神经细胞分布整齐,神经元的形态和结构完好,且胞质内的尼氏体数量丰富,颜色呈现出蓝紫色。随着铝剂量的增加,低、中、高剂量组海马CA1和CA3区逐渐出现细胞排列疏松,染色变浅,细胞核缩小,胞质中的尼氏体大幅减少,乃至完全消失。上述现象表明慢性铝中毒大鼠海马CA1和CA3区的神经细胞蛋白的合成活性下降。见图3—4。
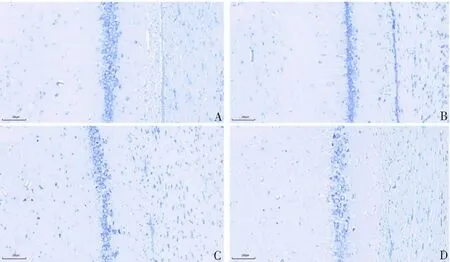
A:对照组;B:低剂量组;C:中剂量组;D:高剂量组。图3 4组海马CA1区尼氏染色(比例尺:10 μm)

A:对照组;B:低剂量组;C:中剂量组;D:高剂量组。图4 4组海马CA3区尼氏染色(比例尺:10 μm)
2.3 慢性铝中毒降低大鼠海马中CACNA1E、CALM、BDNF表达水平
实时定量PCR结果显示,中、高剂量组CACNA1E、CALM、BDNF mRNA相对表达水平较对照组明显下调(P<0.05或P<0.01),而低剂量组与对照组比较差异无统计学意义(P>0.05)。见图5。

*P<0.05,**P<0.01与对照组比较。图5 各组CACNA1E、CALM、BDNF mRNA的相对表达水平
蛋白免疫印迹结果显示,中、高剂量组CACNA1E、CALM、BDNF蛋白表达水平相较于对照组明显降低(P<0.05或P<0.01),而低剂量组与对照组比较差异无统计学意义(P>0.05)。见图6、表4。

图6 各组海马CACNA1E、CALM、BDNF蛋白免疫印迹
表4 各组海马CACNA1E、CALM、BDNF蛋白相对表达量比较
3 讨论
最新研究[9]发现,铝可能对人体造成严重危害,引发神经系统疾病,如老年痴呆症。铝元素被证实能够穿越血脑屏障进入大脑,对神经系统造成极其严重的损害,影响学习能力和记忆力。还有研究[10]表明,当大鼠腹腔注射铝盐溶液后,其大脑顶叶、小脑以及海马神经元的数量减少,其空间认知能力降低。深入研究铝导致的认知功能障碍及作用机制具有重要的理论和实际意义[11-12]。通过水迷宫行为学实验、HE染色和尼氏染色,本研究证明了中、高剂量组存在不同程度的学习记忆障碍,其海马区神经元受到不同程度的损伤,证明了铝致大鼠认知障碍模型建立成功。
本研究选择神经系统内关键的R型钙通道亚基α1E(CACNA1E)及其信号传导中的下游蛋白(CALM和BDNF)作为目的基因,进行蛋白免疫印迹和实时定量PCR实验。与对照组相比,中、高剂量组大脑海马组织中CACNA1E的蛋白和mRNA表达显著降低,同时伴随CALM、BDNF蛋白及mRNA的表达下调。说明慢性率中毒可导致海马中CACNA1E、CALM和BDNF的表达受阻。
中、高剂量组在水迷宫定位航行试验中逃避潜伏期增加,而在空间探索试验中,其在目标象限停留时间显著缩短,穿越平台次数显著减少,提示其海马受损,学习和记忆功能下降。组织病理学检测发现,低、中、高剂量组海马神经元受到不同程度的损伤,细胞变形,排列紊乱,神经细胞内尼氏体减少,染色变浅。综上所述,本研究认为铝致大鼠认知障碍的机制可能与CACNA1E及其下游蛋白的表达下调有关,但具体的分子机制仍需进一步深入研究。
