噻托溴铵调控MAPK/NF-κB信号通路对气道平滑肌细胞增殖的影响及机制研究
2024-03-04李妮,张静
李 妮,张 静
(1.铜川矿务局中心医院药剂科,陕西 铜川 727000; 2.空军第九八六医院药剂科,西安 710054)
哮喘是一种常见的气道慢性炎症性疾病[1]。其特征是炎症、可逆性气道阻塞、高反应性和气道重塑。常见症状包括喘息、咳嗽、胸闷和呼吸困难,这是由遗传和环境因素共同引起的[2-3]。气道重塑是哮喘的主要特征之一,其特征是气道壁厚增加,因此,气道平滑肌细胞(airway smooth muscle cells,ASMCs)的异常增殖被认为有助于气道重塑[4]。血小板衍生生长因子(platelet-derived growth factor,PDGF)-BB是一种细胞分裂素,是刺激多种细胞的关键调节因子,并可诱导ASMCs的增殖和运动,最终导致哮喘。因此,研究气道重塑和ASMCs增殖机制对哮喘的防治具有重要意义。
支气管收缩引起的机械力可能在哮喘的气道重塑中起着至关重要的作用[5-6]。GRAINGE等[7]发现,在没有炎症的情况下,支气管收缩会导致哮喘患者的气道重塑。而抗胆碱能药物的治疗作用可能超过支气管扩张药。噻托溴铵(tiotropium)是一种长效吸入毒蕈碱拮抗剂,有研究[8]表明,噻托溴铵能够抑制豚鼠哮喘模型中的气道重塑,而噻托溴铵抑制气道重塑的潜在机制尚未明确。据报道[9],NF-κB/MAPK信号通路在哮喘的发展中发挥关键调节作用。因此,本研究构建PDGF-BB诱导的ASMCs,提出噻托溴铵通过MAPK/NF-κB途径影响ASMCs增殖和侵袭的假设,并进一步研究其可能的调节机制,证实噻托溴铵可以作为一种治疗哮喘的有前途的药物。
1 材料与方法
1.1 材料
人ASMCs(江阴齐氏生物科技有限公司),DMEM培养基(美国invitrogen公司),PDGF-BB、噻托溴铵(美国Sigma公司),CCK-8检测试剂盒(中国Beyotime公司),微型平板光谱仪(美国Bio-Rad公司),Boyden Transwell室(美国Corning公司),100%Matrigel(美国BD Biosciences公司),PVDF膜(美国Millipore公司),兔抗人MMP-2、MMP-9、calponin、α-SMA、p-p38、p-JNK、p-ERK、p-NF-κB、p-p62、GAPDH(英国Abcam公司),二抗山羊抗兔IgG(美国Millipore公司)。
1.2 细胞培养
将人ASMCs接种在含有10%FBS的DMEM培养基中,在37 ℃、5% CO2的条件下培养。PDGF-BB处理:将PDGF-BB以10 ng·mL-1的质量浓度加入到ASMCs中24 h。噻托溴铵以10 mmol·L-1的浓度溶解在二甲亚砜(DMSO)中作为储存溶液。
1.3 细胞增殖能力分析
使用CCK-8检测试剂盒测量ASMCs的活力。将ASMCs细胞接种到96孔板中,并在37 ℃下在完全生长培养基中培养24 h。使用10 ng·mL-1PDGF处理或使用不同浓度(0、5、10、20、50 μmol·L-1)噻托溴铵处理后,将细胞从培养基中移除,并在37 ℃下暴露于CCK-8试剂1.5 h。在450 nm下用微型平板光谱仪评估相对细胞活力。
通过克隆形成实验检测细胞增殖能力。将PDGF-BB处理后的ASMCs细胞(1×103细胞·孔-1)接种到六孔板中,并在含有10%FBS的培养基中培养14 d。用甲醇固定菌落,并用0.1%结晶紫染色。使用光学显微镜计数大于50个细胞的菌落。
1.4 划痕愈合实验
当细胞在培养孔中生长约70%~80%时,使用200 μL移液管尖端轻轻在培养皿底部划出一条横线。用PBS短暂洗涤2次以除去划痕产生的细胞碎片,加入新鲜的无血清培养基。继续培养24 h,后在显微镜上拍照,计算ASMCs细胞的迁移率。
1.5 Transwell实验
细胞迁移实验:将在无血清培养基中收获的转染细胞置于Boyden Transwell室的上室。细胞侵袭实验:将细胞接种在预涂有100%Matrigel的上室中。将含有10%FBS的完整培养基用作化学引诱剂添加到下腔室中。用棉签轻轻去除残留在上表面的细胞,固定位于下腔室的细胞,用结晶紫染色,并在光学显微镜下观察并计数。
1.6 蛋白质免疫印迹法
采用蛋白质免疫印迹法(Western blot)检测MAPK/NF-κB信号通路的水平。用RIPA缓冲液在冰上裂解ASMCs细胞,后于10%SDS聚丙烯酰胺凝胶上电泳,转移到PVDF膜上,并用5%脱脂奶封闭。在4 ℃加一抗兔抗人MMP-2、MMP-9、calponin、α-SMA、p-p38、p-JNK、p-ERK、p-NF-κB、p-p62、GAPDH,随后用二抗山羊抗兔IgG孵育1 h,用ImageJ软件获取数据并计算。
1.7 酶联免疫吸附试验(ELISA)
用人VEGF ELISA试剂盒评价细胞上清液中VEGF的浓度。通过以13 000 r·min-1和4 ℃离心10 min收集上清液。然后用ELISA法测定VEGF的浓度。
1.8 统计学方法
使用GraphPad 8.0软件分析数据。符合正态分布的数据以平均值±3次独立重复的标准差表示,比较采用单因素方差分析或t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 噻托溴铵抑制PDGF-BB诱导的ASMCs活力和增殖
CCK-8检测结果显示,不同浓度噻托溴铵处理的各组ASMCs细胞活力比较差异无统计学意义(P>0.05),表明在这些浓度下使用噻托溴铵不会损害细胞活力(图1A)。与对照组相比,PDGF-BB刺激显著诱导ASMCs生长约30%(P<0.05)。噻托溴铵处理以剂量依赖的方式抑制PDGF-BB诱导的ASMCs中的细胞生长,在20 μmol·L-1的浓度下抑制显著(P<0.05)(图1B)。克隆形成实验结果显示噻托溴铵处理以剂量依赖的方式抑制PDGF-BB诱导的ASMCs中的细胞增殖能力(图1C—D)。

A:不同浓度噻托溴铵处理的各组ASMCs细胞活力比较;B:10 ng·mL-1PDGF处理或不同浓度(0、5、10、20、50 μmol·L-1)噻托溴铵处理ASMCs细胞活力比较;C、D:10 ng·mL-1PDGF处理或不同浓度(0、5、10、20、50 μmol·L-1)噻托溴铵处理ASMCs细胞增殖能力比较。n=3,*P<0.05与对照组[PDGF-BB(-),噻托溴铵(-)]比较;#P<0.05与PDGF-BB处理组[PDGF-BB(+),噻托溴铵(-)]比较。图1 噻托溴铵抑制PDGF-BB诱导的ASMCs活力和增殖
2.2 噻托溴铵抑制PDGF-BB诱导的ASMCs迁移和侵袭
划痕愈合实验的结果显示,噻托溴铵可以逆转PDGF-BB诱导的伤口愈合能力的增加(图2A—B)。Transwell分析结果显示,与对照组相比,PDGF-BB刺激极大地诱导了ASMCs的迁移和侵袭,而噻托溴铵以剂量依赖的方式部分抑制PDGF-BB诱导的细胞迁移和侵袭的促进作用(图2C—E)。
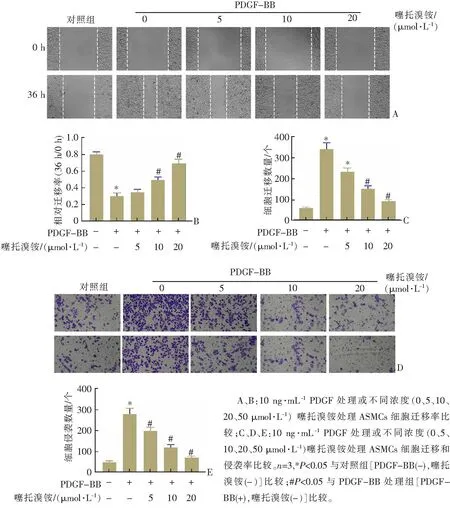
图2 噻托溴铵抑制PDGF-BB诱导的ASMCs迁移和侵袭
2.3 噻托溴铵调节ASMCs的表型转变
PDGF-BB刺激下ASMCs中的MMP-2和MMP-9表达显著提高(P<0.05),见图3A—C。噻托溴铵对ASMCs收缩表型转换的影响:在PDGF-BB诱导的ASMCs中,calponin和α-SMA的表达显著减少(P<0.05)(图3A,3D—E);VEGF水平在PDGF-BB诱导的ASMCs中升高(P<0.05)(图3F)。加入噻托溴铵逆转了这一结果(P<0.05)(图3)。
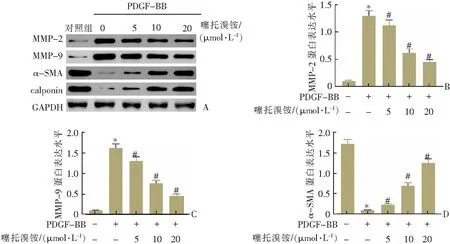
A—D:10 ng·mL-1PDGF处理或不同浓度(0、5、10、20、50 μmol·L-1)噻托溴铵处理ASMCs细胞中MMP-2、MMP-9、calponin和α-SMA的表达和VEGF的水平比较。n=3,*P<0.05与对照组[PDGF-BB(-),噻托溴铵(-)]比较;#P<0.05与PDGF-BB处理组[PDGF-BB(+),噻托溴铵(-)]比较。图3 噻托溴铵调节ASMCs的表型转变
2.4 噻托溴铵调节MAPK/NF-κB信号通路
Western blot分析MAPK/NF-κB信号通路的激活状态,结果显示,PDGF-BB处理的细胞中p-38、p-JNK、p-ERK、p-p65、p-NF-κB的表达增强(P<0.05),噻托溴铵治疗部分缓解了这些蛋白表达水平(P<0.05)。见图4。

A—F:10 ng·mL-1PDGF处理或不同浓度(0、5、10、20、50 μmol·L-1)噻托溴铵处理ASMCs细胞中p-38、p-JNK、p-ERK、p-p65、p-NF-κB的表达比较。n=3,*P<0.05与对照组[PDGF-BB(-),噻托溴铵(-)]比较;#P<0.05与PDGF-BB处理组[PDGF-BB(+),噻托溴铵(-)]比较。图4 噻托溴铵调节MAPK/NF-κB信号通路
3 讨论
哮喘是一种常见病、多发病,严重危害青少年健康。哮喘曾被认为是一种免疫系统疾病,但现在它更被认为是气道壁疾病[10]。气道重塑在哮喘的病理发展中起着主导作用。ASMCs的异常增殖被认为有助于气道重塑[11]。PDGF是一种细胞分裂素,是刺激成纤维细胞、神经胶质细胞、平滑肌细胞和停滞细胞的关键调节因子[12]。PDGF-BB可以诱导ASMCs的增殖和运动,最终导致哮喘[13]。因此,研究气道重塑和ASMCs的生长对治疗哮喘非常重要。本研究结果显示噻托溴铵能抑制PDGF-BB诱导的ASMCs增殖和侵袭,并可调节ASMCs的表型转变。因此,笔者认为噻托溴铵可以作为一种有前途的治疗哮喘的药物。然而,其精确调控机制还需要进一步研究。
噻托溴铵是一种长效毒蕈碱受体抑制剂,是治疗支气管哮喘和慢性阻塞性肺病的强效药物。有研究[14]揭示了噻托溴铵可以抑制哮喘小鼠模型中Th2细胞因子的产生和气道炎症,从而可能降低气道重塑和气道对血清素的高反应性。另一项研究[15]表明,噻托溴铵通过β-catenin信号抑制乙酰甲胆碱诱导的ASMCs细胞产生细胞外间质。本研究通过CCK-8、划痕愈合和Transwell实验,证实噻托溴铵可以抑制PDGF-BB诱导的ASMC的活力和运动性。而ASMC迁移是哮喘发病的关键因素,因此,本研究推测噻托溴铵对PDGF-BB诱导的ASMCs的活力和运动性的影响可能会影响哮喘的进展。另有研究[16]发现,噻托溴铵/奥达特罗治疗可减少香烟烟雾提取物诱导的支气管上皮细胞(BEAS-2B)死亡,并提高香烟烟雾提取物暴露后的BEAS-2B细胞活力。证实噻托溴铵在肺部疾病治疗中起关键作用。
有研究[17]证实,噻托溴铵水合物抑制TNF-α诱导的肺成纤维细胞中的NF-κB的激活。同样,本研究结果也说明噻托溴铵可以抑制PDGF-BB诱导的ASMCs中的MAPK/NF-κB通路活性。MAPK/NF-κB信号通路在炎症调节中有着重要的作用[18-19],如LV等[20]证实氟非尼酮通过抑制MAPK/NF-κB通路对急性肺损伤起保护作用。MAPK/NF-κB通路在哮喘病理中起关键作用:FGF2在哮喘中过表达,通过FGFR/MAPK/NF-κB通路促进气道上皮细胞的气道炎症反应[21];桔梗素D3通过调节哮喘小鼠MAPK/NF-κB信号通路对气道重塑和炎症起着保护作用[22];Eupatilin抑制NF-κB和MAPK通路的激活,并增加Nrf2的表达,进而抑制卵清蛋白诱导的哮喘[23]。这些研究证实,MAPK/NF-κB途径有望成为哮喘的治疗靶标。
本研究证实噻托溴铵可以抑制PDGF-BB诱导的ASMCs的增殖和侵袭,并调节ASMCs的表型转变。在机制上,噻托溴铵可以介导MAPK/NF-κB通路,从而抑制PDGF-BB诱导的ASMCs增殖和运动。为噻托溴铵预防哮喘提供了新的证据。
