肌源干细胞通过TGF-β1/CTGF信号通路减轻压力性尿失禁大鼠的排尿障碍和尿道损伤
2024-03-04李善凤龚静亚沈海川朱永贞姚明莹陈品静
李善凤,龚静亚,沈海川,朱永贞,孙 瑗,王 玲,顾 月,姚明莹,陈品静
(1.连云港市妇幼保健院a.妇产科; b.检验科,江苏 连云港 222006; 2.苏州大学附属第二医院妇产科,江苏 苏州 215008; 3.东海县温泉镇第一卫生院妇产科,江苏 连云港 222301; 4.灌云县伊山镇中心卫生院妇产科,江苏 连云港 222299)
压力性尿失禁(stress urinary incontinence,SUI)是女性常见疾病之一,我国SUI患者发病率约为18.9%[1]。咳嗽、打喷嚏、大笑等均会诱发SUI患者发生不自主的尿液渗漏,严重影响其生活质量[2]。有研究[3]表明,尿道高活动度及固有括约肌功能障碍是导致SUI的主要原因。目前临床治疗因单纯尿道高活动度所导致的SUI疗效较好,但因尿道固有括约肌功能障碍所致的SUI效果不理想,且不能完全治愈肌功能障碍[4]。
近年来,干细胞治疗受到学者们的广泛关注。干细胞具有自我更新和自我分化的潜能,为女性SUI治疗提供新的方向。肌源性干细胞(muscle-derived stem cells,MDSCs)、脂肪干细胞及骨髓间充质干细胞是目前常用于治疗SUI的干细胞。和其他类型干细胞相比,MDSCs具有特殊的分化能力,可直接分化为成熟的肌肉细胞,并极易形成肌管和肌纤维[5-6]。有研究[7]发现MDSCs可改善大鼠SUI的尿失禁,但其机制尚不清楚。有研究[8]显示,女性发生SUI的主要原因是盆底支撑结构损坏,因胶原和弹性蛋白的含量明显减少导致支持组织的弹性降低,使得盆底松弛,从而导致SUI。转化生长因子β1(transforming growth factor β1,TGF-β1)可调节胶原和弹性蛋白的含量,影响基质降解酶的活性[9]。结缔组织生长因子(connective tissue growth factor,CTGF)可通过刺激成纤维细胞增殖和分泌而介导多种病理过程,包括纤维性疾病和创伤后瘢痕形成等[10]。目前TGF-β1/CTGF在SUI中的研究报道较少。因此,本研究旨在基于TGF-β1/CTGF信号通路探究MDSCs对SUI大鼠排尿功能及尿道损伤的作用机制,从而为SUI的防治提供理论依据。
1 材料与方法
1.1 材料
1.1.1 实验动物
6~8周龄雌性未孕未产SD大鼠40只,SPF级,体重200~220 g,购自北京华阜康生物科技有限公司,许可证号:SCXK(京)2019-0008。3~4周龄SPF级健康未孕雌性SD大鼠5只,购自上海计划生育科学研究所,许可证号:SCXK(沪)2018-0006。所有大鼠均饲养在SPF级屏障环境中,自由饮水,室温恒定23~25 ℃,相对湿度50%~60%,光照12 h/12 h明暗循环,适应性喂养大鼠1周后进行实验。
1.1.2 主要试剂和仪器
HE染色试剂盒(上海百通科技股份有限公司)、TGF-β1和CTGF羊抗兔多克隆抗体、兔抗大鼠结蛋白(Desmin)抗体、兔抗大鼠Sca-1抗体(美国Abcam公司)、TGF-β1/CTGF信号抑制剂SB431542(上海联迈生物工程有限公司)、尿动力学分析仪(成都维信医疗设备有限公司)、盆底电刺激仪(ADInstruments公司)、显微镜(日本尼康公司)、切片机(北京万方医学科技股份有限公司)。
1.2 方法
1.2.1 MDSCs的分离、纯化及培养
5只SD大鼠全身麻醉后无菌条件下取腓肠肌,剪碎后用D-Hank’s液吹打漂洗,静置1 min,弃上清,0.2%Ⅺ型胶原酶37 ℃消化1 h;再次离心并弃上清,2.2 U·mL-1dispase酶37 ℃孵育1 h后,0.1%胰酶消化30 min,将细胞分别经100、200和400目细胞筛网过滤,将筛选出的细胞置于含多聚赖氨酸的培养瓶,于37 ℃、5%CO2培养箱孵育1 h后,将未贴壁细胞转移至一新培养瓶中,换液后培养4~5 d,每24 h换液1次,5~6 d后贴壁细胞即为MDSCs。细胞每2~3 d换液1次,汇合度为70%~80%时传代。倒置显微镜观察细胞形态。
1.2.2 免疫细胞化学法鉴定MDSCs
MDSCs细胞用0.25%胰蛋白酶消化,以1×105个·mL-1接种于六孔板培养24 h后,PBS漂洗3次,4%多聚甲醛固定10 min,3%过氧化氢4 ℃孵育10 min,PBS漂洗,一抗兔抗大鼠结蛋白(Desmin)抗体、兔抗大鼠Sca-1抗体4 ℃孵育1 h,PBS漂洗5 min后滴加二抗37 ℃孵育40 min,PBS漂洗,DAB显色10 min,自来水冲洗以终止显色反应。苏木素复染1 min,封片,显微镜下观察,阳性细胞为棕黄色颗粒,计算阳性细胞百分比。
1.2.3 实验分组与模型制备
SD大鼠40只,按随机数字表法分为NC组、SUI组、MDSCs组、MDSCs+SB431542组,每组10只。NC组不做任何处理,其他组均采用接受模拟产伤和双侧卵巢切除手术建立SUI模型[11]。在SUI模型基础上,MDSCs组经尿道壁内注射30 μL MDSCs细胞悬液(约含3×106个细胞);MDSCs+SB431542组经尿道壁内注射10 μL TGF-β1/CTGF信号抑制剂SB431542及30 μL MDSCs细胞悬液;NC组、SUI组经尿道壁内注射等量生理盐水。各组均于药物干预4周后进行后续实验。
SUI模型:用导管将大鼠膀胱排空,腹部正中位作1 cm的切口,剥离双侧卵巢后缝合切口。将尿导管置于阴道,3 mL无菌生理盐水用气囊注入阴道以充分扩张阴道,4 h后撤掉尿导管,当阴道气囊扩张2周后完全摘除卵巢组织后缝合。采用喷嚏实验验证模型。
1.2.4 喷嚏实验
仰卧位固定大鼠,经尿道口将硬皮导管一端插入到膀胱,另一端和微量泵连接,将生理盐水注入到膀胱中,速度为10 mL·h-1,当尿道口有液体溢出时停止注入,计算注入量。将大鼠的膀胱排空,将前次1/2注入量的生理盐水再次注入到膀胱,用鼠须刺激大鼠鼻孔,当大鼠发生喷嚏时尿道口有液体流出时则视为喷嚏实验阳性,如尿道口没有液体流出则视为阴性。统计各组大鼠喷嚏阳性率,喷嚏阳性率=喷嚏阳性大鼠数量/大鼠总数量×100%。
1.2.5 尿动力学指标检测
排空大鼠膀胱内液体,将生理盐水注入到膀胱,速度为12 mL·min-1,当观察到尿道口出现第一滴尿液时,记录膀胱最大容积(MBC)和漏尿点压(LPP)。再次排空膀胱,按上述同样的方法注入生理盐水后,用手指缓慢按压大鼠腹部,直至尿道口有液体排出时停止按压,记录腹压漏尿点压(ALPP)。
1.2.6 排尿指标测定
将三通管中一根导管经左侧颈静脉插入到膀胱内后缝合固定供膀胱,一根导管口连接到压力检测器,监测膀胱压力,经第三根导管持续向膀胱注入生理盐水以诱导膀胱收缩并排尿,收集尿液,计算排尿量、残留尿量及排尿效率等。
1.2.7 HE染色
取尿道组织,将组织于4%多聚甲醛溶液中固定24 h,石蜡包埋,切4 μm薄片,苏木素染色10 min,浸泡于1%N2O2中2 min,伊红染色20 min,中性树脂封片,光学显微镜下观察。
1.2.8 蛋白免疫印迹法
取尿道组织50 mg,将组织充分剪碎,液氮中将研磨,收集粉末,RIPA裂解液裂解1 h,蛋白试剂盒提取组织总蛋白,上样、电泳、转膜和封闭,一抗(1:500)孵育过夜,HRP标记二抗(1:2000)室温孵育1 h,发光液显色,使用Image J软件分析条带灰度值,计算蛋白相对表达水平。
1.2.9 统计学方法

2 结果
2.1 MDSCs形态学变化
1~5 d细胞多呈纤维细胞,胞体较大,细胞贴壁后呈梭形和扁平星形,数量明显增多,未传代的细胞大量融合;6 d时细胞以球形、短梭形和纺锤形为主,胞体体积变小且细胞数量减少(图1A);MDSCs培养9 d时可见少量悬浮细胞,细胞开始分裂增殖,呈圆形或多角形(图1B);11~13 d后未见悬浮细胞,贴壁细胞见明显分裂,且多呈长梭形和长菱形,数量明显增加(图1C);14~16 d时,贴壁细胞大量增殖且数量增多,多数细胞出现有规律的融合,平行排列(图1D);细胞在培养25~29 d时融合至70%,传代后细胞分布明显均匀,细胞多以长梭形和纺锤形为主,形态均一,约3~4 d可传代(图1E)。

A:6 d;B:9 d;C:11~13 d;D:14~16 d;E:25~29 d。图1 光学显微镜下不同培养时间MDSCs的形态(×100)
2.2 MDSCs鉴定
免疫细胞化学结果显示,细胞分布均匀,Desmin和Sca-1均呈阳性表达。见图2。

A:Desmin表达;B:Sca-1表达。图2 免疫细胞化学检测干细胞标记物Desmin和Sca-1的表达(×100)
2.3 4组大鼠喷嚏阳性率比较
喷嚏实验结果显示,SUI组喷嚏阳性率(80%)较NC组(0%)增加(χ2=7.500,P=0.023 5);MDSCs组喷嚏阳性率(20%)低于SUI组(χ2=7.200,P=0.027 3);MDSCs+SB431542组喷嚏阳性率(90%)较MDSCs组增加(χ2=9.899,P=0.007 1)。
2.4 4组大鼠尿动力学指标比较
与NC组比较,SUI组MBC、LPP、ALPP水平均降低(均P<0.05);与SUI组比较,MDSCs组MBC、LPP、ALPP水平增加(均P<0.05);与MDSCs组比较,MDSCs+SB431542组MBC、LPP、ALPP水平降低(均P<0.05)。见图3。
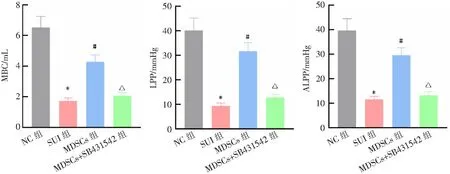
*P<0.05与NC组比较;#P<0.05与SUI组比较;△P<0.05与MDSCs组比较。1 mmHg=0.133 kPa。图3 各组大鼠尿动力学指标比较
2.5 4组大鼠排尿指标比较
与NC组比较,SUI组大鼠排尿量、残余尿量增加,排尿效率降低(均P<0.05);与SUI组比较,MDSCs组大鼠排尿量、残余尿量减少,排尿效率增加(均P<0.05);与MDSCs组比较,MDSCs+SB431542组大鼠排尿量、残余尿量增加,排尿效率降低(均P<0.05)。见图4。
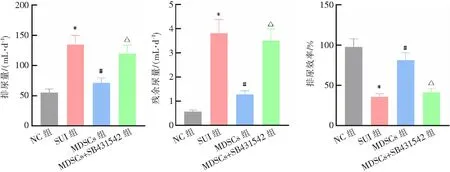
*P<0.05与NC组比较;#P<0.05与SUI组比较;△P<0.05与MDSCs组比较。图4 各组大鼠排尿指标比较
2.6 4组大鼠尿道组织病理学变化
HE染色结果显示,NC组大鼠尿道组织无异常病理学变化,尿道括约肌组织结构清晰完整;SUI组大鼠尿道组织明显损伤,细胞核排列紊乱、无规则且数量减少,多数核出现萎缩,肌层厚度明显变薄,各肌束间隙明显增加,细胞染色不均匀且有大量的空泡出现;MDSCs组大鼠尿道组织损伤减轻,细胞染色变均匀且有规则地排列,细胞数量增加且空泡明显减少;MDSCs+SB431542组大鼠尿道组织病理学变化较MDSCs组损伤明显。见图5。

黑色箭头所示为细胞核。图5 各组大鼠尿道组织HE染色(×100)
2.7 4组大鼠尿道组织中TGF-β1、CTGF蛋白表达比较
与NC组比较,SUI组大鼠尿道组织中TGF-β1、CTGF蛋白表达水平降低(P<0.05);与SUI组比较,MDSCs组大鼠尿道组织中TGF-β1、CTGF蛋白表达水平增加(P<0.05);与MDSCs组比较,MDSCs+SB431542组大鼠尿道组织中TGF-β1、CTGF蛋白表达水平降低(P<0.05)。见图6。
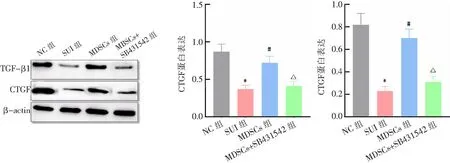
*P<0.05与NC组比较;#P<0.05与SUI组比较;△P<0.05与MDSCs组比较。图6 各组大鼠尿道组织中TGF-β1、CTGF蛋白表达比较
3 讨论
随着现代医学的快速发展,干细胞在再生医学领域中表现出巨大的潜力,为女性SUI疾病的治疗提供新的途径[6,13]。本研究分离并培养MDSCs,免疫组化鉴定Desmin和Sca-1表达发现所得细胞即为MDSCs,并向SUI模型大鼠中注射MDSCs后大鼠排尿功能和尿道损伤情况改善。由于MDSCs具有增殖速度快、多向分化等特点,而且移植后存活率明显高于从肌肉分离出来的另一干细胞即成肌细胞[13]。MDSCs在体外可分化为神经元和内皮细胞等多种不同细胞。它的这种特性符合修复尿道括约肌的要求。有研究[14]发现,自体MDSCs联合胶原基质可改善约79%的SUI症状。另有学者研究[15]发现,MDSCs注射治疗可改善女性SUI患者症状。尿道括约肌是泌尿系统最基本的结构和功能单位。当尿道括约肌细胞结构和功能异常时,由于肌细胞数量减少以及单位肌纤维的收缩能力降低,进而影响尿道括约肌的控尿能力。喷嚏反射可增加腹部压,故本研究采用喷嚏实验来判断SUI模型制备的成功与否以及MDSCs对SUI控尿能力的影响。尿动力学指标可反映控尿能力,常用方法有力学及电生理学方面的检测[16]。本研究结果显示MDSCs组大鼠喷嚏阳性率明显减少,尿动力学指标MBC、LPP、ALPP和排尿率明显增加,尿道组织病理学变化改善,提示MDSCs可改善SUI大鼠膀胱相关的排尿功能,减轻尿道组织损伤。陈春经等[17]研究证实,MDSCs可增强其在移植环境中的生存能力,并通过其旁分泌功能治疗SUI,这与本研究结果类似。
盆底组织损伤可促进SUI的发生。TGF-β1可调节组织修复过程中细胞和细胞外基质的相互作用,诱导成纤维母细胞分化为成纤维细胞。CTGF能够促进成纤维细胞增生和胶原蛋白的合成[18]。而TGF-β1可特异性调控CTGF的表达。有研究[19]显示,TGF-β1可通过CTGF促进伤口愈合和组织修复,但TGF-β1/CTGF对SUI的作用鲜有报道。本研究结果显示,MDSCs组SUI大鼠尿道组织中TGF-β1、CTGF蛋白表达均明显增加,提示MDSCs可能通过调控TGF-β1/CTGF信号通路而减轻SUI大鼠尿道损伤和相关功能障碍。本研究使用TGF-β1/CTGF信号通路抑制剂联合MDSCs共同干预SUI大鼠,结果显示SB431542组大鼠喷嚏阳性率增加,尿动力学指标MBC、LPP、ALPP和排尿率明显降低,尿道组织严重损伤,大鼠排尿功能变差,尿道组织损伤加重,提示抑制TGF-β1/CTGF信号通路可减弱MDSCs的治疗作用。
综上,MDSCs可改善SUI大鼠的排尿功能,减轻尿道损伤,其可能是通过调控TGF-β1/CTGF信号通路发挥作用。
