热活化过硫酸钠降解水体中咪唑氯盐类离子液体
2024-03-04王鑫蕊贾青竹闫方友
王鑫蕊,贾青竹,闫方友,王 强
(1. 天津科技大学海洋与环境学院,天津 300457;2. 天津科技大学化工与材料学院,天津 300457)
离子液体(ionic liquids,ILs)是一种有机盐,通常由体积相对较大、不对称的有机阳离子和体积相对较小的无机或有机阴离子组合而成,也被称为室温离子液体。由于离子液体具有极低的蒸气压、可调的结构性能、良好的热稳定性,所以被广泛应用于多个领域[1-2]。然而,随着离子液体的广泛应用,大量离子液体因其较强的溶解性而不可避免地通过废水进入环境中。据报道,离子液体具有细胞毒性、环境毒性和微生物毒性,一些离子液体的生态毒性甚至高于传统的有机溶剂[3]。因此,开发一种高效、清洁的方法去除水体中的离子液体具有重要意义。
有研究[4-5]表明,大多数离子液体具有很强的化学稳定性,尤其是广泛使用的咪唑基离子液体,基于生物技术的降解效果不能尽如人意。高级氧化工艺(AOPs)已被认为是一种有前途的环境修复技术。然而,传统高级氧化工艺如紫外线/H2O2法[6]成本较高且效率较低,芬顿法[7]和类芬顿法[8]可能会产生大量的含铁污泥[9],这些不足之处限制了它们的应用。
本工作利用过硫酸钠作为氧化剂,研究热活化过硫酸钠对1-乙基-3-甲基咪唑氯盐(EMICl)的降解效果,对比单独过硫酸钠氧化、单独加热和热活化过硫酸钠氧化3 个体系对离子液体溶液的去除率。考察反应温度、过硫酸钠投加量、pH 和共存无机阴离子对离子液体降解效果的影响,并进行动力学分析。通过自由基淬灭实验,探究了该体系中起主导氧化作用的自由基;基于密度泛函理论(density functional theory,DFT)分析了EMICl 的降解机理。
1 材料与方法
1.1 试剂与仪器
EMICl,分析纯,中国科学院兰州化学物理研究所;过硫酸钠、无水乙醇、叔丁醇、氢氧化钠,分析纯,天津市江天化工技术股份有限公司;碳酸氢钠、无水碳酸钠、无水硫酸钠、氯化钠,分析纯,天津市大茂化学试剂厂;磷酸二氢钾、磷酸、三乙胺,色谱纯,上海阿拉丁生化科技股份有限公司。实验过程中使用的超纯水由Milli-Q 超纯水系统制备。
pHS-3E 型pH 计,上海仪电科学仪器有限公司;LC-20 AT 型高效液相色谱仪,日本岛津公司,配以Symmetry C18 色谱柱(4.6 mm×250 mm,5µm)和紫外-可见光可变波长检测器;AL204 型电子天平,瑞士梅特勒-托利多仪器有限公司;DF-101S 型集热式恒温加热磁力搅拌器,上海仪昕科学仪器有限公司。
1.2 实验方法
配制250 mL 初始质量浓度为10 mg/L 的离子液体溶液,置于玻璃反应器中,投加一定量的过硫酸钠(作为氧化剂),将玻璃反应器置于集热式恒温加热磁力搅拌器上。按规定的时间间隔取2.0 mL 反应液,取出后立即添加无水乙醇淬灭反应体系中的自由基,样品经0.22µm 微孔滤膜过滤。用高效液相色谱仪测定水样中离子液体的质量浓度,计算其去除率。
1.3 分析方法
采用高效液相色谱仪测定离子液体的质量浓度。柱温保持在30 ℃。流动相是甲醇和pH=3.0 的25 mmol/L 磷酸盐缓冲液(KH2PO4/H3PO4)混合溶液与0.5%三乙胺水溶液(体积比为1∶9)。流量为0.5 mL/min,进样体积为20µL。在212 nm 处测定离子液体的质量浓度。采用准一级动力学模型描述离子液体的降解过程。
式中:ρt为t时刻离子液体的质量浓度,mg/L;ρ0为离子液体的初始质量浓度,mg/L;k为准一级反应速率常数,min-1;t为反应时间,min。
2 结果与讨论
2.1 不同体系中EMICl的降解效果
为了评价热活化过硫酸钠的氧化性能,实验对比了单独过硫酸钠氧化、单独加热和热活化过硫酸钠氧化对离子液体的降解效果,结果如图1 所示。离子液体的初始质量浓度为10 mg/L,反应温度为60 ℃,氧化剂过硫酸钠的投加量为1 mmol/L。从图1 可知,不同体系EMICl 的降解效果:热活化过硫酸钠氧化>单独加热>单独过硫酸钠氧化。在单独过硫酸钠氧化和单独加热的条件下,120 min 时EMICl 的质量浓度基本保持不变,去除率分别为0.51%和2.68%,表明它们对离子液体的降解没有效果。在热活化过硫酸钠氧化体系中,120 min 时EMICl 的去除率提高到96.55%,这主要是因为在常温下过硫酸钠主要以的形式存在,它很难转化为,而加热后热能可有效活化过硫酸钠,导致O—O 键均匀裂解,产生强氧化性的[16],如式(2)所示。因此,热能活化过硫酸钠可高效促进离子液体的降解。
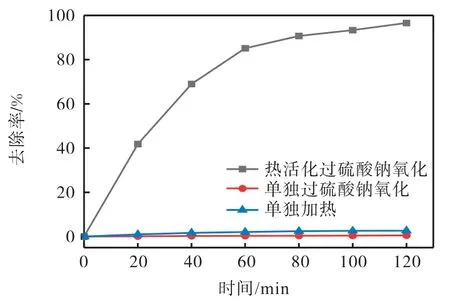
图1 不同体系对EMICl的降解效果Fig. 1 Removal efficiency of EMICl in different systems
2.2 反应温度对EMICl降解的影响
反应温度直接影响离子液体的降解效果。实验中离子液体的初始质量浓度为10 mg/L,氧化剂过硫酸钠的投加量为1 mmol/L,设置了5 个不同的反应温度(30、40、50、60、70 ℃),考察反应温度对EMICl降解的影响,实验结果如图2 所示。从图2 中可以看出,在热活化过硫酸钠体系中,随着反应温度的升高,离子液体的去除率逐渐增大。当反应温度从30 ℃升高到70 ℃,反应120 min 后,离子液体的去除率从6.59%提高到96.59%。结果表明,反应温度对EMICl的降解有显著影响,高温可以加速分子碰撞,从而促进过硫酸钠中O—O 键的均匀裂解,提高的产量[17],更有利于EMICl 的降解。当反应温度为60 ℃和70 ℃时,离子液体的最终去除率无显著差异。因此,根据EMICl 的降解效果和经济成本,确定了最佳反应温度为60 ℃。
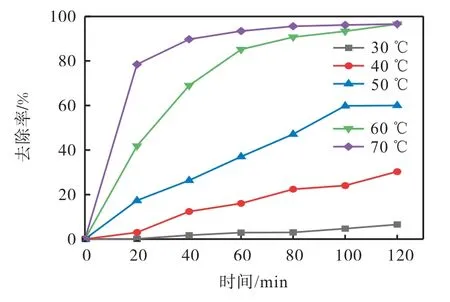
图2 反应温度对EMICl降解效果的影响Fig. 2 Effect of reaction temperature on removal efficiency of EMICl
为了进一步探讨反应温度对离子液体降解效果的影响,进行动力学拟合分析,结果如图3 和表1所示。结果显示,不同温度下的ln(ρt/ρ0)与时间具有良好的线性关系,R2均大于0.9,说明离子液体的降解符合准一级动力学模型。当反应温度从30 ℃升高到70 ℃时,反应速率常数k 从0.000 5 min-1增加到0.037 1 min-1,说明离子液体的降解速率和反应温度呈正相关。

表1 不同反应温度下EMICl的降解动力学Tab. 1 Degradation kinetics of EMICl with different reaction temperatures

图3 不同反应温度体系中的动力学拟合Fig. 3 Kinetic fitting analysis in different reaction temperature systems
通过阿伦尼乌斯方程〔式(3)〕进一步分析温度与表观速率常数(kobs)的关系。由图4 可以看出,lnkobs与T-1具有良好的线性关系(R2=0.964)。结果表明,在30~70 ℃范围内,热活化过硫酸钠体系中EMICl的降解符合阿伦尼乌斯方程。由得到的线性方程,计算得到EMICl 氧化时的活化能为94.45 kJ/mol。
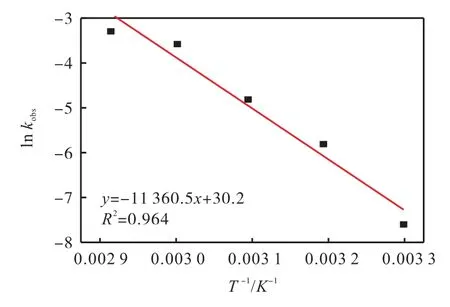
图4 ln kobs 与T -1的关系Fig. 4 Relationship between ln kobs and T -1
式中:kobs为表观速率常数;A为指前因子;Ea为活化能,kJ/mol;R为理想气体常数,8.314 J/(mol·K);T为热力学温度,K。
2.3 氧化剂投加量对EMICl降解的影响
为了研究氧化剂过硫酸钠投加量对离子液体废水的降解效果,在离子液体的初始质量浓度为10 mg/L、反应温度为60 ℃的条件下,对5 个不同氧化剂投加量(0.4、0.6、0.8、1.0、1.2 mmol/L)的体系进行实验,去除率结果如图5 所示,动力学拟合分析结果如图6 和表2 所示。

表2 不同氧化剂投加量下EMICl的降解动力学Tab. 2 Degradation kinetics of EMICl with different oxidant dosages
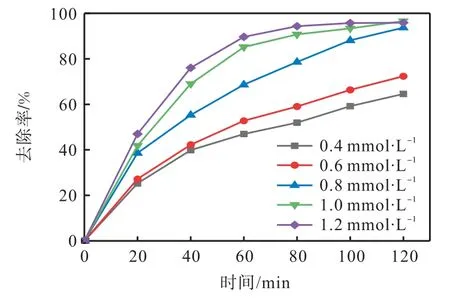
图5 氧化剂投加量对EMICl降解效果的影响Fig. 5 Effect of oxidant dosage on removal efficiency of EMICl

图6 不同氧化剂投加量体系中的动力学拟合Fig. 6 Kinetic fitting analysis in different oxidant dosage systems
由图5 和图6 可知,氧化剂过硫酸钠的投加量从0.4 mmol/L 增加到 1 mmol/L,EMICl 的去除率从64.56%升高到96.55%,对应的k从0.008 1 min-1提高到0.027 9 min-1。不同氧化剂投加量下的ln(ρt/ρ0)与时间具有良好的线性关系,R2均大于0.9(表2),表明EMICl 的降解符合准一级动力学模型。在一定的浓度范围内,随着过硫酸钠投加量的增加,产生更多的,从而促进EMICl 的降解。然而,氧化剂过硫酸钠投加量增加至1.2 mmol/L 时,离子液体的去除率略微下降至95.84%。这是因为过量的过硫酸钠会引起的猝灭〔式(4)和(5)〕[18],导致自由基的竞争与消耗,不利于目标污染物的降解。因此,降解EMICl 废水的最佳氧化剂投加量为1 mmol/L。
2.4 初始pH对EMICl降解的影响
在活化过硫酸钠降解污染物体系中,pH 是一个需要考虑的重要因素。为了研究初始pH 在热活化过硫酸钠体系中对EMICl 降解效果的影响,在EMICl初始质量浓度为10 mg/L、反应温度为60 ℃、氧化剂过硫酸钠的投加量为1 mmol/L 的条件下,对4 个不同初始pH(3、5、7 和9)体系进行实验,结果如图7所示。从图7 中可以看出,随着初始pH 从3 增加到7,在120 min 时,EMICl 的降解率从49.17%增加到96.55%,然而pH 增加到9 时,EMICl 的降解率下降到67.13%。这说明中性条件有利于热活化过硫酸钠氧化过程中 EMICl 的降解。对不同初始 pH 的EMICl 的降解过程进行动力学分析,结果见图8 和表3。图8和表3 的结果表明,ln(ρt/ρ0)与时间具有良好的线性关系,R2均大于0.9,离子液体的降解符合准一级动力学模型。不同初始pH 下离子液体的k 分别为0.006 0、0.017 4、0.027 9、0.009 2 min-1。在酸性溶液中,过硫酸钠主要以的形式存在〔式(6)〕,此时H+浓度较高,很难转化为〔式(7)〕[19],降低离子液体的降解效果。在碱性条件下,因与OH-反应〔式(8)〕而被消耗[20],从而抑制了离子液体的降解。因此,在中性条件下,热活化过硫酸钠体系对离子液体的降解效果较好。
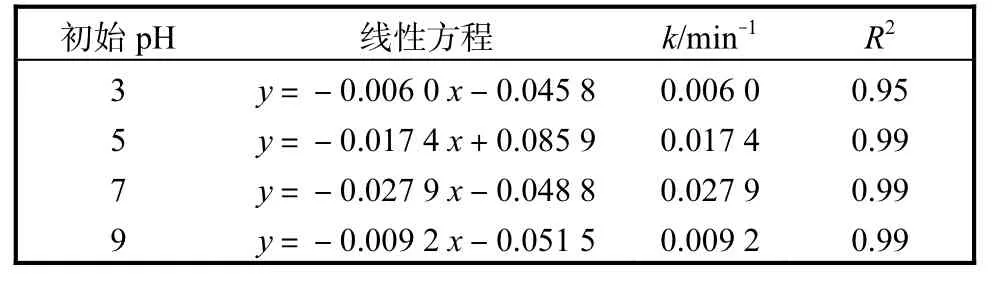
表3 不同初始pH中EMICl的降解动力学Tab. 3 Degradation kinetics of EMICl with different initial pH
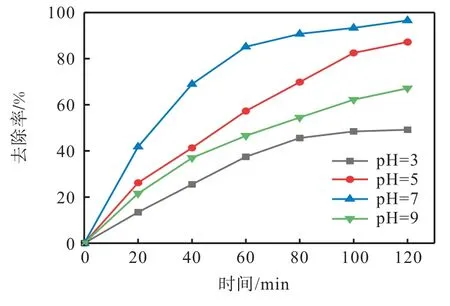
图7 不同初始pH对EMICl降解效果的影响Fig. 7 Effect of different initial pH on removal efficiency of EMICl
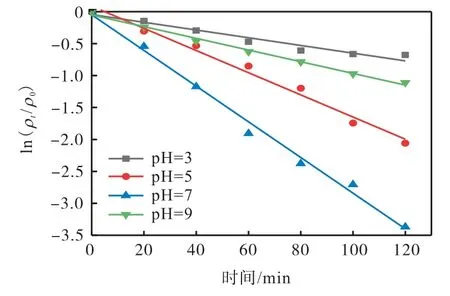
图8 不同初始pH体系中的动力学拟合Fig. 8 Kinetic fitting analysis in different initial pH systems
2.5 共存无机阴离子对EMICl降解的影响
水中存在的无机阴离子对污染物的降解可能有显著影响。因此,考察无机阴离子Cl-、、和对热活化过硫酸钠体系中降解EMICl 的影响,实验结果如图9 所示。实验中离子液体初始质量浓度为10 mg/L,反应温度为60 ℃,氧化剂过硫酸钠投加量为1 mmol/L,初始pH 为7,阴离子投加量均为5 mmol/L。

图9 共存无机阴离子对EMICl降解效果的影响Fig. 9 Effect of coexisting inorganic anions on removal efficiency of EMICl
从图9 中可以看出,热活化过硫酸钠体系不加入无机阴离子时,120 min 时 EMICl 的去除率为96.55%。在加入Cl-和后,120 min时EMICl的去除率分别略微下降至95.33%和91.93%,对应的降解动力学常数分别下降至0.025 8 min-1和0.021 2 min-1(图10 和表4)。

表4 共存无机阴离子下EMICl的降解动力学Tab. 4 Degradation kinetics of EMICl with coexisting inorganic anions
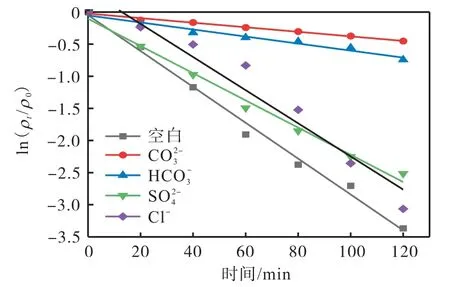
图10 共存无机阴离子体系中EMICl的降解动力学拟合Fig. 10 Kinetic fitting analysis of EMICl degradation in coexisting inorganic anions systems
Cl-和、和·OH 反应生成活性较低的Cl·、和等自由基[21],对EMICl 的降解有轻微的抑制作用。当加入和时,热活化过硫酸钠体系对EMICl 的去除率分别下降至36.35%、52.33%,降解动力学常数分别下降至0.003 6 min-1和0.005 5 min-1(图10 和表4)。这主要是因为和会淬灭部分和·OH[22],从而导致EMICl 的降解效果下降。因此,和对热活化过硫酸钠体系降解EMICl 有明显的抑制作用。
2.6 主要自由基种类的鉴定
在各种活化过硫酸钠的氧化体系中,硫酸根自由基和羟自由基是参与反应的两个主要自由基。乙醇(EtOH)与·OH 反应的二阶反应速率常数大约是与反应的50 倍。叔丁醇(TBA)与·OH 反应的二阶反应速率常数约为与反应的1 000 倍[23]。为了确定热活化过硫酸钠体系降解离子液体的主要自由基,进行自由基淬灭实验,结果如图11 所示。离子液体的初始质量浓度为 10 mg/L,反应温度为60 ℃,氧化剂过硫酸钠投加量为1 mmol/L,初始pH 为7。
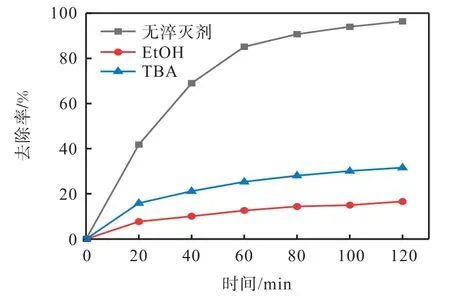
图11 自由基淬灭剂对EMICl降解的影响Fig. 11 Effect of radical scavengers on degradation of EMICl
由图11 可知,在不添加自由基清除剂的情况下,120 min 时EMICl 的去除率可以达到96.55%。在分别添加乙醇和叔丁醇后,120 min 时离子液体的去除率分别下降到16.63%和31.61%,对EMICl 的降解有明显的抑制作用。这些结果表明,SO4·-和·OH 是热活化过硫酸钠体系的主要活性物质,在EMICl 的降解过程中发挥重要作用。
电子顺磁共振(electron paramagnetic resonance,EPR)可以进一步证明自由基的存在。以5,5-二甲基-1-吡咯啉-N-氧化物(DMPO)作为自由基捕获剂,对热活化过硫酸钠体系中生成的SO4·-和·OH 进行鉴定,结果如图12 所示。由图12 可以看出,在未加热的条件下(过硫酸钠和DMPO),没有出现明显的峰。在5 min 和20 min 时,DMPO-OH 加合物形成了4 个信号,其峰强度为1∶2∶2∶1(超精细分裂常数aH=aN=14.8 G)[24],表明有·OH 的产生。在20 min时,·OH 的信号峰逐渐减弱。在5 min 和20 min 时,DMPO-SO4有6 个信号,其峰强度为1∶1∶1∶1∶1∶1(超精细分裂常数aN=13.2 G,aH=9.6 G,aH=1.48 G,aH=0.78 G)[25],表明有的生成。在20 min 时,的信号峰略微增强。结果表明,和·OH 均参与了离子液体的降解。
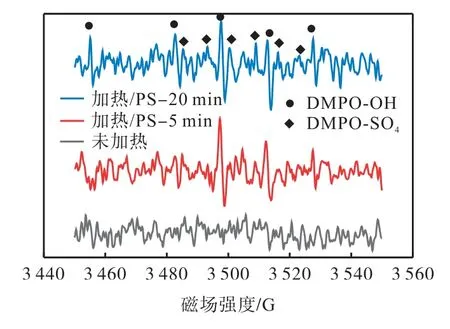
图12 热活化过硫酸钠体系中的EPR光谱Fig. 12 EPR spectra in thermally activated persulfate system
2.7 基于DFT的EMICl降解机理
DFT 计算已被证明是研究反应机理和预测反应点的可靠方法[26]。根据自然布居分析(NPA)电荷,使用Gaussian 16 计算了EMICl 原子的福井指数( f-、f+、f0),结果见表5 和图13。
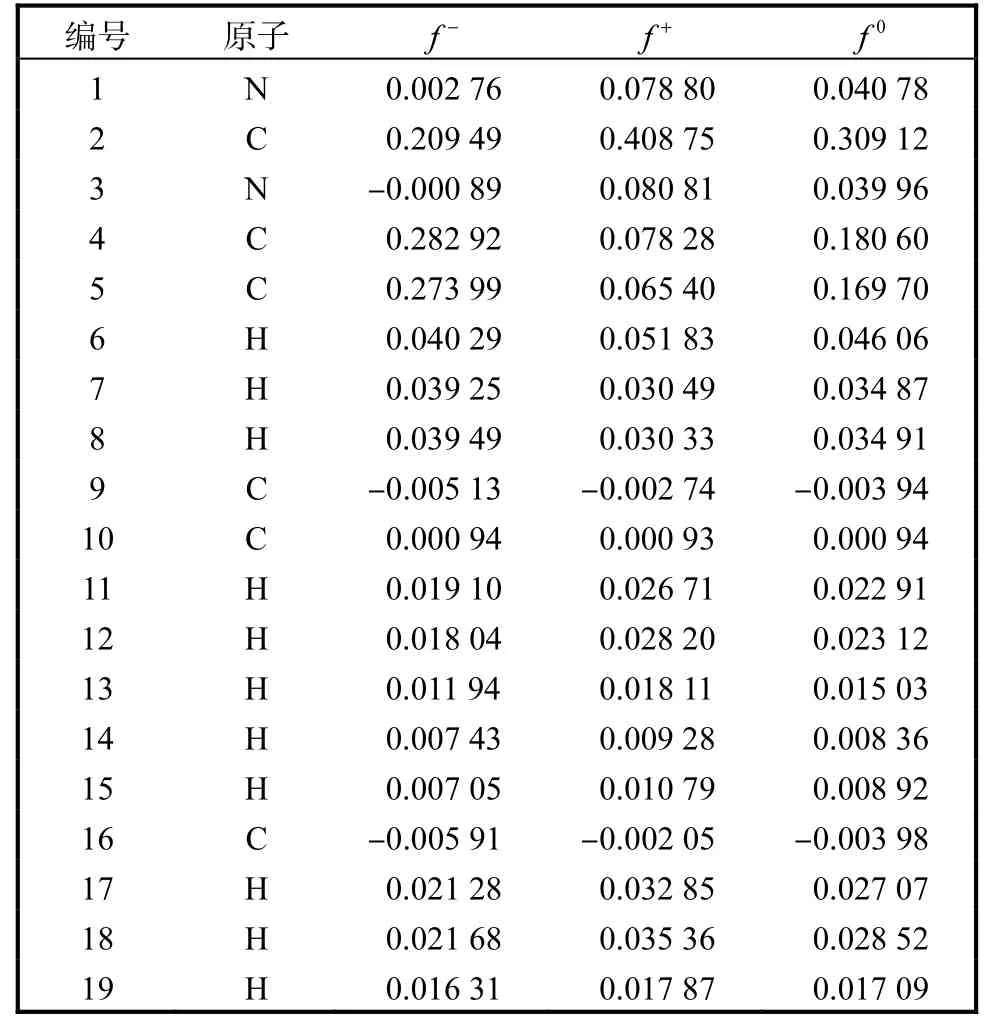
表5 EMICl的福井指数Tab. 5 Fukui index of EMICl

图13 EMICl的结构图Fig. 13 Structure diagram of EMICl
从表5 可以看出,C4 和C5 的f-值较高,这很容易导致亲电攻击反应。C2 和C4 具有较高的f+值,表示这些位点易于发生亲核反应。C2 和C4 的f0值也较高,表明它们更容易受到自由基的攻击。因此,EMICl 首先被攻击的主要位点是咪唑环上的C原子,其次是烷基侧链。最后,SO·4-和·OH 通过氢原子提取和电子转移反应等将EMICl 降解为有机中间产物,进一步矿化并分解为二氧化碳和水等小分子物质。
3 结 论
热活化过硫酸钠技术能够高效促进离子液体EMICl 的降解,与单独加热和单独过硫酸钠相比,热活化过硫酸钠对EMICl 的降解效果显著增加。当初始pH 为7.0、反应温度为60 ℃、过硫酸钠投加量为1 mmol/L 时,在2 h 内EMICl(10 mg/L)的去除率高达96.55%。此外,EMICl 的降解过程符合准一级动力学模型,R2均大于0.9。EMICl 氧化时的活化能为94.45 kJ/mol。共存的Cl-和略微抑制了离子液体的降解,而和呈现出明显的抑制作用。基于自由基淬灭实验和电子顺磁共振测试,结果表明和·OH 是热活化过硫酸钠体系中降解EMICl 的主要活性物质。DFT 计算表明EMICl 首先被攻击的主要位点是咪唑环上的C 原子,其次是烷基侧链。
