杂化纳米生物催化剂CALB@Fe3O4@ZIF-8 的构建及性能
2024-03-04杜英杰贾晓彤罗秀艳崔建东贾士儒
杜英杰 ,贾晓彤,罗秀艳,崔建东,贾士儒,龚 栋
(1. 天津科技大学生物工程学院,天津 300457;2. 湖北汉江大健康产业有限公司,十堰 442000;3. 天津益倍生物科技集团有限公司,天津 300457)
作为生物活性大分子,游离酶具有高效性、专一性和反应条件温和的优点,但在工业中使用有易失活、回收困难、不能反复利用、不易于产物分离提纯和精制、成本高等明显缺点[1-2]。将酶固定化可为酶提供一个相对稳定的环境,这不仅减少了酶在实际使用过程中的流失,还能提高酶的相对稳定性以及重复使用性[3]。将酶固定在固体载体上,能更有效控制反应过程并提高酶在储存和操作条件下的稳定性。此外,固定化酶可以更容易从产品中分离出来,有效降低生产成本[4]。
目前,固定化酶的常用方法有多种[5-8],其中新型包埋法使用各种多孔纳米材料,如无定形磷酸钙[9]、有机-无机杂化纳米花[10]、金属有机骨架(metalorganic framework,MOF)[11]等用于酶的固定化。金属有机骨架纳米材料作为酶固定化的载体具有生物亲和性高、制备过程简单、可修饰等优势,但是存在颗粒小、难回收、较低的酶负载率等问题,在一定程度上限制了其在固定化酶领域的应用。将MOF 与其他功能纳米材料相杂化,制备复合纳米材料,不仅可以保持MOF 材料的优良性能,还可以体现功能材料的特性,在酶的固定化领域具有较好的应用前景。ZIF-8 是MOF 材料的一种,它是由六水合硝酸锌和2-甲基咪唑在常温下通过有机物和无机金属离子配位合成的金属骨架材料。ZIF-8 原料价格低廉,合成条件简单易改进,因而十分适用于固定化酶的开发。当前,将大分子酶固定于MOF 材料上实现MOF 材料作为载体的固定化酶生物催化剂的构建已成为研究热点之一[12-13]。然而,单一ZIF-8 材料仍然存在一些常见问题,例如MOF 材料的酸碱稳定性较差、颗粒小、机械强度较低等,这在一定程度上限制了它们的应用范围。因此,将MOF 与其他功能纳米材料相杂化,制备复合纳米材料,不仅可以保持MOF 材料的优良性能,还可以体现功能材料的特性,对于提高酶固定化载体的性能具有重要意义。
尽管MOF 固定化酶策略能改善酶的稳定性,但往往存在较低的酶负载率、较大的传质阻力、难以简单回收并重复利用以及制备过程难以精确控制等因素,造成催化效率较低[14]。金属纳米粒子Fe3O4作为一种功能化材料,具有反式尖晶石结构和稳定的化学性质、良好的生物相容性、一定的光热效应和磁响应性能,在物理、化学、生物、医药等诸多领域受到广泛关注。Hou 等[15]在Fe3O4表面修饰了MOF 涂层制备固定化酶,利用Fe3O4的磁性特性,在磁场的控制下可以使固定化酶被快速分离。Ricco 等[16]对Fe3O4纳米粒子进行了聚多巴胺修饰,并在其表面涂覆了MOF 材料构建多层核壳结构材料,实现了高稳定性固定化胰蛋白酶的制备。Zhao 等[17]在温和条件下一步包埋Fe3O4纳米粒子和酶分子,构建ZIF-8 基的磁性固定化酶。他们发现Fe3O4纳米粒子的加入影响了ZIF-8 的晶体和孔隙结构,更有利于底物的传入和产物的传出,使催化剂展示出较高的催化活力。因此,将Fe3O4纳米粒子和酶共同包埋在MOF 材料中,形成酶/Fe3O4/MOF 复合杂化生物催化剂,能够使复合杂化生物催化剂具有多波长光效应和磁响应的特点。同时,在一定光照条件下,Fe3O4纳米粒子在催化剂内部产生局部热量,提升催化剂催化微环境的温度,进而提高固定化酶生物催化剂的酶活力。开展纳米马达杂化MOF 固定化酶的可控制备及其构效关系探究,对于开发新型高效纳米固定化酶具有重要意义。
本研究以脂肪酶(CALB)为模型酶,在功能性纳米材料Fe3O4纳米粒子与ZIF-8 纳米材料相杂化的同时,将脂肪酶包埋在ZIF-8 中,制备杂化纳米生物催化剂(CALB@Fe3O4@ZIF-8)。采用的脂肪酶(lipase,EC3.1.1.3,甘油酯水解酶)作为一种有专一性、高效性和环境友好性特点的催化剂[18-19],被广泛应用于食品、化工、皮革和生物能源等工业领域。构建的新型杂化材料固定化酶与传统仅将脂肪酶包埋在ZIF-8中的催化剂(CALB@ZIF-8)相比,该催化剂具备以下特性:作为生物亲和性好的载体,ZIF-8 纳米材料的包埋可以为脂肪酶分子提供良好的保护作用;Fe3O4纳米粒子的光热效应可以为脂肪酶提供程度可控的微环境水平热量供给,提升酶的催化活力;同时,其磁响应特性有利于生物催化剂的回收和重复利用。
1 材料与方法
1.1 材料
脂肪酶来源于伯克霍尔德菌(Burkholderia cepacia,货号534641),Sigma 公司;曲拉通X-100(Triton X-100),北京索莱宝科技有限公司;2-甲基咪唑(2-MeIM)、六水合硝酸锌、异硫氰酸荧光素(FITC)、棕榈酸对硝基苯酯,上海阿拉丁生化科技股份有限公司;FeSO4·7H2O、Na2HPO3·12H2O、无水乙醇、NaH2PO3·2H2O,福晨(天津)化学试剂有限公司;氮气,天津市军粮城常福气体有限公司;盐酸,国药集团化学试剂有限公司。
CHF-XM500 型氙灯光源,北京泊菲莱科技有限公司;UV-6100 型紫外分光光度计,上海美普达仪器有限公司;EMS-20 型数显恒温磁力搅拌水浴锅,上海乔跃电子有限公司;JJ-1B 型恒速电动搅拌器,巩义市予华仪器有限公司;pHSJ-4A 型pH 计,上海精密科学仪器有限公司;D8 Advance 型傅里叶变换红外光谱仪,Thermo Fisher Scientific 公司。
1.2 Fe3O4 纳米粒子的制备
取浓盐酸与水等体积混合,配制6 mol/L 的盐酸溶液,用所配制的盐酸溶液滴入50 mL 超纯水中,直到pH=2.5~3.5,将1.67 g FeSO4·7H2O 加入上述溶液中溶解。打开机械搅拌装置,水浴锅水温25 ℃,向三口烧瓶中加入混合溶液,三口烧瓶一口盖上玻璃塞,中间连接搅拌桨,另一口连接氮气装置,验证装置气密性后通入氮气10 min。待排出空气后,打开搅拌装置,转速400 r/min,打开玻璃塞,在体系中添加亚硝酸钠0.21 g,立即密封玻璃塞,调节水浴锅温度至40 ℃,随后加入25 mL 25%氨水,机械搅拌2 h。将悬浮液倒入离心管中用钕磁铁分离,回收磁性粒子,倒出废液,超纯水洗涤2 次,无水乙醇洗涤2 次,每次均进行磁场分离,最后保存到无水乙醇中,得Fe3O4纳米粒子分散液,4 ℃保存。
1.3 CALB@ZIF-8 及CALB@Fe3O4@ZIF-8 的制备
1.3.1 CALB@ZIF-8 的制备
取89.2 mg Zn(NO3)2·6H2O 与5 mL 超纯水混合,另取239.1 mg 2-MeIM 与10 mL 超纯水混合,取脂肪酶30 mg 与10 mL 超纯水混合,得到3 mg/mL的酶液。在200 r/min 机械搅拌和水浴锅25 ℃条件下,向100 mL 三口烧瓶中加入1 mL 酶液和9 mL pH为7 的100 mmol/L PB 缓冲液,待溶解后用移液管滴加 Zn(NO3)2溶液;搅拌 30 min 后取出,25 ℃、8 680 r/min 离心5 min;加入25 mL 超纯水分散沉淀,倒入三口烧瓶中,打开机械搅拌,保持上述温度,移液管滴加制备好的10 mL 2-MeIM 溶液,搅拌2 h 后将反应液取出;在10 000 r/min、25 ℃的条件下离心10 min,收集沉淀备用[20]。
1.3.2 CALB@Fe3O4@ZIF-8 的制备
取一定量的Fe3O4纳米粒子分散液,钕磁铁分离去除无水乙醇,用去离子水洗涤2 次,加入1 mL PB缓冲液(pH 7.0,100 mmol/L)后超声40 min 备用。在机械搅拌条件下,向100 mL 三口烧瓶中加入1 mL质量浓度同1.3.1 节中的酶液、离心后的1 mL Fe3O4纳米粒子分散液和8 mL PB 缓冲液(pH 7.0,100 mmol/L),其后实验步骤参照1.3.1 节。
1.4 CALB酶活力测定方法
CALB 酶活力测定参考Gao 等[21]的测定方法:将制备的固定化酶离心后所获得的沉淀溶解,为待测酶液,向PB 缓冲液(pH 7.5,100 mmol/L)中加入0.4%的乳化剂Triton X-100。将0.015 1 g 棕榈酸对硝基苯酯溶于3 mL 无水乙醇中,得到13.33 mmol/L底物。
在5 mL 离心管中加入1.15 mL 上述加入乳化剂的混合溶液和0.1 mL 底物,在37 ℃的条件下预热3 min 后加入0.25 mL 酶液,反应3 min 后迅速在410 nm 波长下以水替代酶液并加入等量底物标零,测定吸光度。
CALB 酶活力定义:在37 ℃条件下1 min 内转化棕榈酸对硝基苯酯生成1µmol 对硝基苯酚所需的酶量为1 U。酶活力换算公式为
式中:Y为酶活力,U;A为吸光度;k为标准曲线的斜率;c为标准曲线的截距;N为酶液的稀释倍数。
1.5 制备条件对酶催化性能的影响
1.5.1 温度对固定化酶催化性能的影响
制备固定化酶CALB@ZIF-8 和CALB@Fe3O4@ZIF-8 时,设置温度为15、20、25、30、35 ℃,在无光条件和380 nm 光照条件下测定吸光度,并通过式(1)计算酶活力。
1.5.2 转速对固定化酶催化性能的影响
在上述实验基础上,分别在200、250、300、350、400 r/min 转速下制备固定化酶 CALB@ZIF-8 和CALB@Fe3O4@ZIF-8,测定酶活力,酶活力测定方法参见1.4 节。
1.5.3 光照条件对固定化酶催化性能的影响
在上述实验基础上,将制备的固定化酶CALB@ZIF-8 和CALB@Fe3O4@ZIF-8 在无光条件、自然光条件以及380、435、475、650 nm 下测定酶活力,酶活力测定方法参见1.4 节。
1.5.4 Fe3O4质量对固定化酶催化性能的影响
在上述实验基础上,分别称取Fe3O4纳米粒子3、4、5、6、7 mg 制备固定化酶CALB@Fe3O4@ZIF-8,并在380 nm 光照条件下测定酶活力,酶活力测定方法参见1.4 节。
1.6 酶促反应动力学测定
棕榈酸对硝基苯酯的浓度分别设置为6、8、10、12、14 mmol/L,实验开始3 min 后读取吸光度,按照1.4 节方法分别测定在以上不同底物浓度下脂肪酶的酶促反应速率,根据吸光度计算对硝基苯酚生成量[21]。以1/c为横坐标、1/v为纵坐标,根据双倒数作图法计算vmax和Km[24]。
式中:v为酶促反应速率,vmax为最大酶促反应速率,单位均为mol/(L·min);Km为米氏常数,mol/L;c为底物浓度,mol/L。
2 结果与分析
2.1 四氧化三铁的透射电镜观察
为考察四氧化三铁纳米粒子的粒径和形貌,对其进行了透射电镜(transmission electron microscope,TEM)分析,结果如图1 所示。

图1 四氧化三铁透射电镜图Fig. 1 TEM image of Fe3O4
由图1 可知,四氧化三铁纳米粒子粒径约为30 nm,但呈现部分团聚现象,这可能会造成包埋的效果不理想,因此在包埋前需要对Fe3O4进行超声等预处理,使其更加分散。
2.2 固定化CALB催化剂的表征
利用透射电镜考察了两种固定化酶催化剂的形貌,结果如图2 所示。由图2(a)和图2(b)可知,CALB@ZIF-8 呈现为球状,CALB@Fe3O4@ZIF-8 也呈现为球状,粒径约为200 nm,且颗粒内部分布着的黑色斑点是更小的Fe3O4纳米颗粒物。由透射电镜图片可知,Fe3O4纳米颗粒被杂化到ZIF-8 中。

图2 固定化酶催化剂的表征结果Fig. 2 Characterization results of immobilized enzyme catalyst
为了验证脂肪酶被固定在ZIF-8 中,对脂肪酶用异硫氰酸荧光素进行了标记,透析后进行固定化操作,并用激光共聚焦显微镜进行了观察,结果如图2(c)所示。在CALB@Fe3O4@ZIF-8 中可以观察到大量绿色荧光,表明脂肪酶被包埋固定在了ZIF-8 中。
对两种固定化酶催化剂进行了傅里叶变换红外光谱表征,结果如图2(d)所示。在610 cm-1处的吸收峰说明了Fe—O 键的形成,在421 cm-1处的振动峰对应着N—Zn 键,在1 310 cm-1、1 420 cm-1处的振动峰对应着咪唑环,在1 655 cm-1处存在酰胺键红外吸收峰,表明脂肪酶被固定,进一步证明了Fe3O4杂化ZIF-8 复合纳米材料的成功制备。
2.3 CALB@Fe3O4@ZIF-8 制备条件优化
温度、转速、光照条件和Fe3O4质量对固定化CALB@Fe3O4@ZIF-8 酶活力的影响如图3 所示。
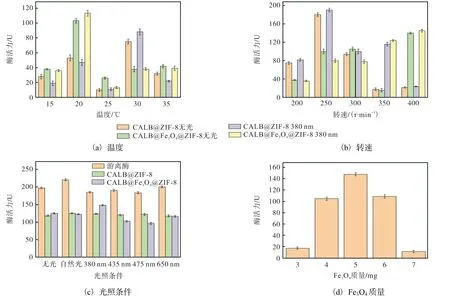
图3 温度、转速、光照条件和Fe3O4 质量对固定化CALB@Fe3O4@ZIF-8 酶活力的影响Fig. 3 Effect of temperature,string speed,light condition and Fe3O4 during immobilization process on the activities of CALB@Fe3O4@ZIF-8
2.3.1 温度
温度作为固定化酶制备的关键条件之一,往往会影响固定化酶的催化活力和稳定性,因此有必要对固定化过程中的温度对固定化酶酶活力的影响进行考察,从而获得最佳的固定化温度。如图3(a)所示,在30 ℃条件下制备的CALB@ZIF-8 酶活力达到最高值,在无光条件下和380 nm 光照条件下的酶活力分别是75 U 和85 U。相比而言,在20 ℃条件下制备的CALB@Fe3O4@ZIF-8 的酶活力达最高值,在无光条件下和380 nm 光照条件下的酶活力分别是102 U 和113 U。这可能是由于Fe3O4的光热效应对酶分子的构象产生影响,使其更适于在较低温度下进行固定化[22]。在光照条件下,Fe3O4纳米粒子可以在局部空间内为酶分子提供纳米粒子的微热效应,进而提升酶的催化活力。因此,选择20 ℃作为制备温度。
2.3.2 转速
在制备固定化酶的过程中,转速也是一个重要影响因素,适当的搅拌可以使体系混合得更均匀,使反应平稳进行。如图3(b)所示,转速条件的变化对其酶活力影响较为显著。固定化酶 CALB@ZIF-8 在250 r/min 制备时酶活力达到最大值191 U,但随着转速增加,酶活力下降,这可能是因为过高的转速破坏了固定化酶的结构。CALB@Fe3O4@ZIF-8 的酶活力随着转速的增大而逐步提高,在400 r/min 时酶活力最大。这个结果表明:功能化Fe3O4纳米粒子与MOF材料的杂化可能有益于固定化酶结构的稳定。因此,选择400 r/min 作为制备转速。
2.3.3 光照条件
光照条件是表现本催化剂的光热效应的关键因素,功能化Fe3O4纳米粒子具有光热效应,可协助实现催化剂产生局部热,光照条件的变化会改变其局部空间,为酶分子提供微热效应。由图3(c)可知:游离酶和 CALB@ZIF-8 受光照影响不显著,但是CALB@Fe3O4@ZIF-8 受光照条件影响较为显著,其在 380 nm 下酶活力达到最高值(149 U),高于CALB@ZIF-8 酶活力最高值(128 U),游离酶酶活力为181 U,最大酶活回收率为82%,比优化前提高了16%。这可能是因为功能化Fe3O4纳米粒子的光热效应带入MOF 材料固定化酶中,为内部酶分子带来了局部热量,大大提高了固定化酶的酶活力[23]。因此,光照条件选择380 nm。
2.3.4 Fe3O4质量
Fe3O4作为功能化纳米粒子具有光热效应,可使金属有机骨架材料的部分原有性能增强,甚至使复合材料集成新的性能,形成具有优异协同性能的复合材料。由图3(d)可知:酶活力随着Fe3O4质量的增加而逐步上升,在5 mg 时达到最高值(149 U),随后逐步下降。因此,制备固定化酶CALB@Fe3O4@ZIF-8 的最优Fe3O4添加质量为5 mg。
2.4 CALB@Fe3O4@ZIF-8 的酶学特征
CALB@Fe3O4@ZIF-8 的重复使用性、储藏稳定性、pH 耐受性以及温度稳定性如图4 所示。
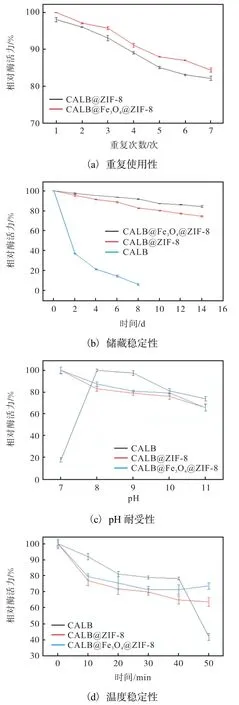
图4 CALB@Fe3O4@ZIF-8 的重复使用性、储藏稳定性、pH耐受性以及温度稳定性Fig. 4 Reusability,storage stability,pH tolerance and temperature stability of CALB@Fe3O4@ZIF-8
2.4.1 重复使用性
固定化酶的重复利用不仅可以为生产节约成本,而且符合绿色生产的理念。本研究固定化酶的重复使用性结果如图4(a)所示,合成的CALB@Fe3O4@ZIF-8 经过7 次重复使用后,其相对酶活力还能保持在84.29%,而CALB@ZIF-8 经过7 次重复使用后,其相对酶活力保持在82.01%。这说明合成的CALB@Fe3O4@ZIF-8 拥有优异的重复使用性。
2.4.2 储藏稳定性
储藏稳定性是衡量固定化酶性能的重要指标,本研究固定化酶的储藏稳定性结果如图4(b)所示,CALB@Fe3O4@ZIF-8 在储存14 d 后,相对酶活力还能保持85%,CALB@ZIF-8 在储存14 d 后,相对酶活力还能保持79%,游离酶在储存2 d 后相对酶活力明显下降,储存8 d 后相对酶活力仅剩8%,表明CALB@ Fe3O4@ZIF-8 具有较好的储藏稳定性。
2.4.3 pH 耐受性
pH 对CALB@Fe3O4@ZIF-8 催化剂酶活力的影响结果如图4(c)所示。CALB@Fe3O4@ZIF-8 的最适催化pH 为7,随着pH 的升高酶活力下降。CALB@ZIF-8 的趋势与CALB@Fe3O4@ZIF-8 大致相同,都有较好的pH 耐受性,当pH 为11 时,还有67%相对酶活力,而游离酶受pH 影响较大,pH 稳定性较差。
2.4.4 温度稳定性
CALB@Fe3O4@ZIF-8 的温度稳定性结果如图4(d)所示,延长高温处理时间,图中CALB@Fe3O4@ZIF-8 在55 ℃条件下处理50 min 后,仍有73%相对酶活力,对比相同处理时间的CALB@ZIF-8 63%相对酶活力,游离酶在处理50 min 后仍有42%相对酶活力,表明此材料具有较好的温度稳定性。
2.5 酶促反应动力学实验
生物催化剂的动力学参数见表 1。CALB@Fe3O4@ZIF-8 在380 nm 下的Km值(3.205 5 mol/L)小于CALB@Fe3O4@ZIF-8 自然光下的Km值(3.711 4 mol/L),也小于CALB@ZIF-8的Km值(5.355 5 mol/L),说明在光照条件下,固定化材料与底物的亲和力增强。这可能是由于光照使得杂化纳米材料中纳米马达产生局部热效应,从而使被包埋固定在其中的脂肪酶在内部的运动增强且减少团聚,降低了传质阻力,提高了亲和力,从而导致Km降低。但是,与游离脂肪酶vmax∶Km值0.003 2 min-1相比,CALB@Fe3O4@ZIF-8在380 nm 下表现出更高的vmax∶Km值(0.006 6 min-1),这说明光照给了固定化材料更高的催化效率。

表1 生物催化剂的动力学参数Tab. 1 Kinectics parameters of biocatalysts
3 结 语
本文利用包埋法构建功能性Fe3O4纳米粒子杂化ZIF-8 固定化酶催化剂,研究了温度、搅拌转速、Fe3O4添加质量对催化剂催化性能的影响,探讨了光照条件对固定化酶酶活力的影响。
(1)制备CALB@ZIF-8 最优条件为:温度30 ℃、转速 250 r/min、光照波长 380 nm。制备 CALB@Fe3O4@ZIF-8 的最优条件为:温度 20 ℃、转速400 r/min、光照波长380 nm、Fe3O4质量为5 mg。
(2)Fe3O4纳米粒子的杂化显著提高了固定化酶CALB@Fe3O4@ZIF-8 的酶活力,且光照对CALB@Fe3O4@ZIF-8 酶活力的影响较为明显,特别是光强及波长对固定化酶酶活力有显著提高的作用。
(3)光照后包埋Fe3O4纳米粒子的固定化酶与底物有更高的亲和力,且提高了最低酶促反应速率。
