NaF-Na3PO4-H2O 体系相图与热力学模型
2024-03-04常静宇
常静宇,周 桓, ,杨 洁,郝 晴,赵 鋆,李 杰
(1. 天津科技大学海洋与环境学院,天津 300457;2. 天津科技大学化工与材料学院,天津 300457)
稀土(RE)具有独特的物化性质,在催化剂、陶瓷、玻璃、合金和冶金过程中有着广泛的应用[1]。稀土元素富含于氟碳铈矿、独居石和磷灰石等矿物中,而阴离子主要有F-、和等。稀土矿的加工通常采用酸浸碱溶、碱焙烧和硫酸焙烧等方法[2-3],经处理后稀土元素转化为RE2O3和RECl3。加工过程产生含有Na+、F-、、OH-、等组分的卤水[4]。该卤水的盐类分离,尤其是氟、磷的分离和产品化需要固液相平衡数据和相关热力学模型的支持。本研究收集Na+//F-,,OH-,CO32--H2O 体系与氟、磷相关的相平衡数据,汇总在表1 中。由表1 知:Na3PO4-H2O、NaF-H2O二元体系的数据[5-6]较完整,NaF-Na3PO4-H2O[7-9]三元体系和 NaF-Na2CO3-Na3PO4-H2O[10-11]四元体系有文献报道,但是相平衡数据不完整,且不同文献数据一致性差,有必要结合电解质溶液热力学模型进行溶解度数据一致性评估,构建可靠的相图。
表1 稀土加工卤水体系Na+//F-,,OH-,-H2O 及其子体系相图文献汇总Tab. 1Summary ofthephasediagrams ofNa+//F-,,OH-,-H2Obrinesystemand its subsystems for rare earth processing
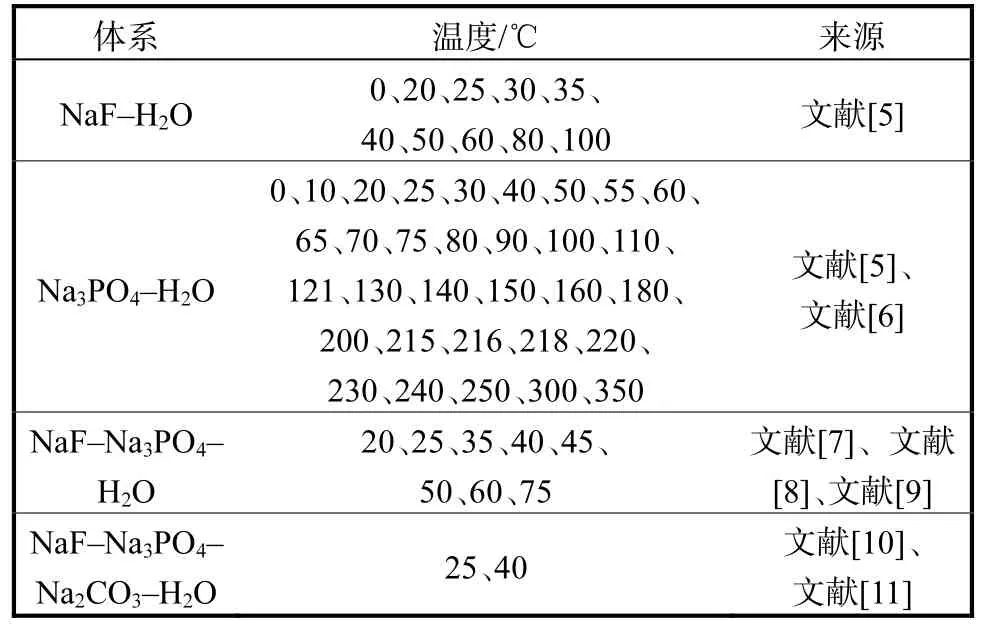
表1 稀土加工卤水体系Na+//F-,,OH-,-H2O 及其子体系相图文献汇总Tab. 1Summary ofthephasediagrams ofNa+//F-,,OH-,-H2Obrinesystemand its subsystems for rare earth processing
?
应用比较广泛的水盐体系的热力学模型有Pitzer类模型[12-13]、Pitzer-Simonson-Clegg 模型[14]、eUNIQUAC 模型[15]、eNRTL 模型[16-17]和OLI-MSE模型[18-19]等,其中eNRTL 模型在过程机理和多温表达方面具有明显的优势[20]。近年来,一些学者[20-25]将其拓展并应用于含有Li+、Na+、K+、Mg2+、Ca2+、Cl-、、的多元多温盐湖卤水体系的热力学研究,获得了氯化物型、硫酸镁亚型两类六元体系盐湖卤水相平衡与相图的完整表达。
改进的电解质体系综合热力学模型及其使用已在前期[23-25]进行了比较详细的研究。本研究以稀土矿加工过程中氟、磷回收工艺的关键体系 NaFNa3PO4-H2O 为研究对象,通过等温溶解平衡法测定其在273.15~348.15 K 的相平衡数据;基于改进的eNRTL 模型构建NaF-Na3PO4-H2O 体系物性与相平衡的热力学模型,通过二元体系物性数据和二元、三元体系相图数据,获得液相特征参数和固相物种的特征参数,从而建立了NaF-Na3PO4-H2O 体系模型,并进行了实验数据评估和完整相图结构的预测。
1 热力学模型
1.1 液相的非理想性与液相特征参数
eNRTL 模型[16]对溶液非理想性的表达考虑了局部构成和长程静电贡献的过剩吉布斯自由能Gex,并由此获得摩尔分数活度系数lnγi方程,即
式中:Gex,PDH为长程静电贡献,通过扩展的Pitzer-Deby-Hückel(PDH)方程[16]进行表达;Gex,lc为局部构成贡献,通过eNRTL 模型中局部组成的离子对之间、离子对与分子之间、分子与分子之间的作用能 Gij和作用力ijτ进行表达[17];γi是物种i基于摩尔分数的活度系数;w、c、a 分别表示水、阳离子和阴离子。
式中:Xi为有效局部摩尔分数,ni和xi分别为组分i的物质的量和摩尔分数,za、zc分别为阴、阳离子的电荷数,R为摩尔气体常数,T为热力学温度。
式(3)中基于离子组成的组分i和j的作用能 Gij与作用力ijτ的关系为
式中:αij为随机常数,通常取值为0.2。
基于离子组分的 Gij、τij可利用基于盐对(I,J)的GIJ、τIJ,通过混合规则 Yi转换得到,即
基于盐对的GIJ和τIJ的关系同样满足方程(5),并转化为方程(8),即
IJτ是盐-水、盐-盐作用参数,其与温度的关系可通过类Gibbs-Hemholtz 方程进行表达:
式中:表达多温条件下二元相互作用的三参数Δ gIJ、ΔhIJ、Δcp,IJ分别表示吉布斯自由能增量、焓增量和等压摩尔热容增量对组分间交互作用力的贡献,它们是反映液相特征的液相参数;Tref是参考热力学温度,298.15 K。τIJ、Δ gIJ和Δcp,IJ无量纲,ΔhIJ单位是K-1。
本研究中获得的NaF-Na3PO4-H2O 体系的液相参数见表2,其中盐对与水之间的相互作用参数、盐对之间的相互作用参数的获得,分别详见本文3.2.1节和3.2.2 节。
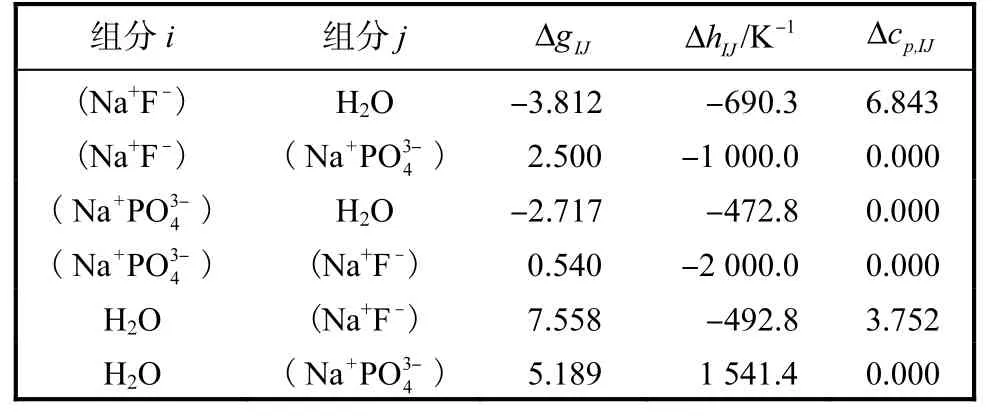
表2 NaF-Na3PO4-H2O 体系的液相参数Tab. 2 Liquid parameters for NaF-Na3PO4-H2O system
1.2 固液相平衡与固相特征参数
固液相平衡的准则是固相物种k 的活度积Asp,k等于溶度积Ksp,k,即
式中:Asp,k和Ksp,k为物种k 的活度积和溶度积常数;γi为根据式(2)计算的组分i 的活度系数;是固相物种k 溶解为液相物种的吉布斯自由能增量,的温度依赖性由式(13)的Gibbs-Hemholtz方程表达。
表3 和表4 分别列出了本研究获得的NaFNa3PO4-H2O 体系的液相和固相物种的热力学参数。其中液相物种数据详见本文3.2.1 节,二元体系固相物种数据详见3.2.1 节,三元体系固相物种数据详见3.2.2 节。
表3 Na+//F-,-H2O 体系液相物种参数Tab. 3 Liquid phase parameters for Na+//F-,-H2O system

表3 Na+//F-,-H2O 体系液相物种参数Tab. 3 Liquid phase parameters for Na+//F-,-H2O system
注:①离子的热力学常数取自NBS 表[26];②本研究中采用的离子和水的cp 为cp(T)=c1+c2 t+c3t 2+c4 t3+c5 t-2,t=-T×10-3;③本研究确定的参数。
?
表4 Na+//F-,-H2O 体系固相物种参数Tab. 4 Solid phase parameters for Na+//F-,-H2O system
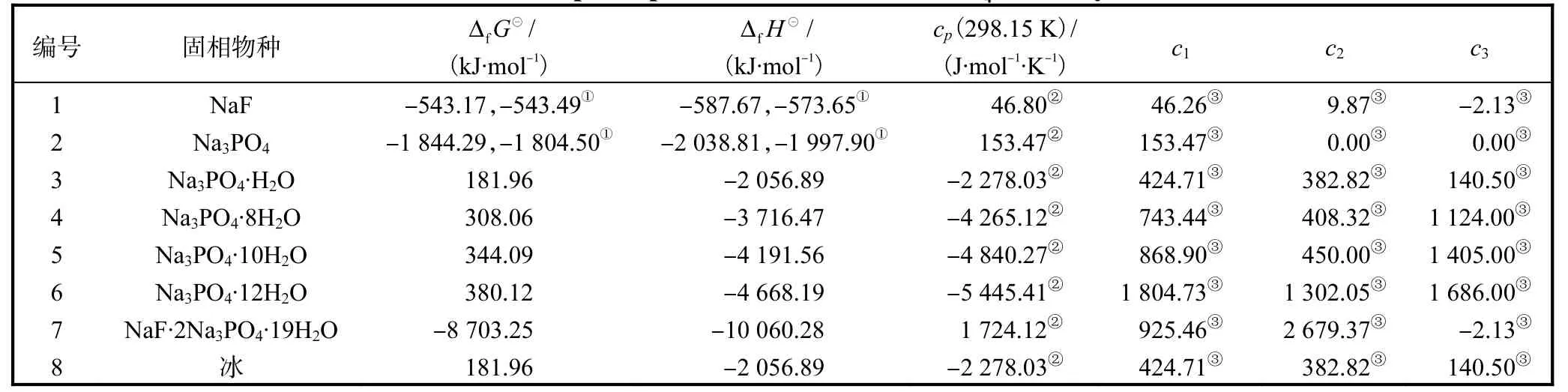
表4 Na+//F-,-H2O 体系固相物种参数Tab. 4 Solid phase parameters for Na+//F-,-H2O system
注:①固相物种的热力学数据取自NBS 表[26];②固相的cp 为c P( T )= c1 +c 2T +c3 T -2×105[24];③最初的数据来自手册,在本研究中根据溶解度数据重新确定。
?
本研究用相对平均偏差表示实验数据与计算数据的不同程度。计算公式为
2 实 验
2.1 实验药品与仪器
NaF、Na3PO4·12H2O,分析纯,上海阿拉丁试剂公司。经检测NaF 和Na3PO4·12H2O 药品纯度可以直接使用不需要进一步提纯。制备固液混合物和进行化学分析时使用电导率低于1×10-4S/m、pH 为6.60的双去离子水。
固液相平衡实验在HNY-302 型带恒温水浴的摇床(天津欧诺有限公司,控温精度±0.5 K)上进行,固液平衡容器为250 mL 耐氟化物腐蚀的聚乙烯塑料瓶。测定中用到的仪器:ICS1100 型离子色谱仪,美国戴安公司;UV2700 型分光光度计、XD-3 型粉末X射线衍射仪,日本岛津公司;AL204 型分析天平、InPro 4800i 型pH 计,瑞士梅特勒-托利多公司。
2.2 实验方法
固液相平衡采用等温溶解平衡法。将 NaF、Na3PO4·12H2O 和水按照预先设计的比例在塑料瓶中混合,制备一系列固液混合物;将塑料瓶置于恒温摇床中,连续摇动至少7 d,直到固液达到相平衡,液相浓度不再变化为止。达到平衡后停止振荡,恒温静置固液相平衡容器,直到液相完全澄清。用移液管取上清液约5 mL,用角匙取湿固体样品约2 g,均用分析天平(精度0.000 1 g)精确称量,用于定量分析;用角匙取湿固体样品并用滤纸吸干,用于固相鉴定。
2.3 分析方法
离子组分浓度通过定量化学分析确定。将精确称量的固相、液相样品分别转移并定容到250 mL 容量瓶中。F-浓度参照GB/T 39305—2020《再生水水质 氟、氯、亚硝酸根、硝酸根、硫酸根的测定 离子色谱法》进行测定;浓度参照GB/T 11893—1989《水质 总磷的测定 钼酸铵分光光度法》进行测定。固体物种鉴定采用湿渣法结合粉末X 射线衍射确定。液相pH 采用在线pH 计测定,液体密度用密度瓶法测定。
3 结果与分析
3.1 实验结果
用NaF 和Na3PO4·12H2O 配制4 个系列的固液混合物,分别在273.15、298.15、323.15、348.15 K 的温度下进行固液相平衡实验,当达到相平衡时,测定相平衡基础数据,包括固相物种、湿固相和液相组成、液体密度和pH。利用文献[27]中的方法评估各个物理量的不确定度(u),分别为:u(T)=0.05 K,u(p)=0.3 kPa,u〔w(Na3PO4)〕=0.5%,u〔w(NaF)〕=0.2%,u(ρ)=0.001 g/cm3,u(pH)=0.01。各个温度下的相平衡基础数据列在表5—表8 中。绘图得到4 个温度的相图,如图1—图4 所示。

图1 273.15 K下NaF-Na3PO4-H2O 三元体系的相图和局部放大图Fig. 1 Phase diagram and local enlargement of NaF-Na3PO4-H2O ternary system at 273.15 K
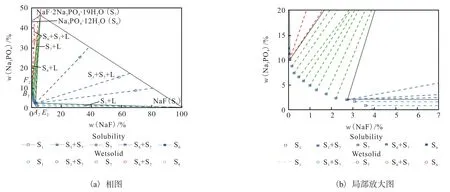
图2 298.15 K下NaF-Na3PO4-H2O 三元体系的相图和局部放大图Fig. 2 Phase diagram and local enlargement of NaF-Na3PO4-H2O ternary system at 298.15 K

图3 NaF-Na3PO4-H2O 三元体系在323.15 K下的相图和局部放大图Fig. 3 Phase diagram and local enlargement of NaF-Na3PO4-H2O ternary system at 323.15 K
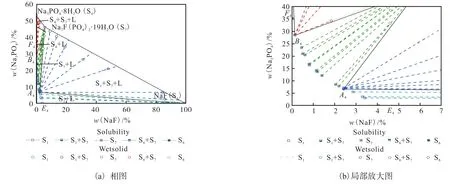
图4 NaF-Na3PO4-H2O 三元体系在348.15 K下的相图和局部放大图Fig. 4 Phase diagram and local enlargement of NaF-Na3PO4-H2O ternary system at 348.15 K
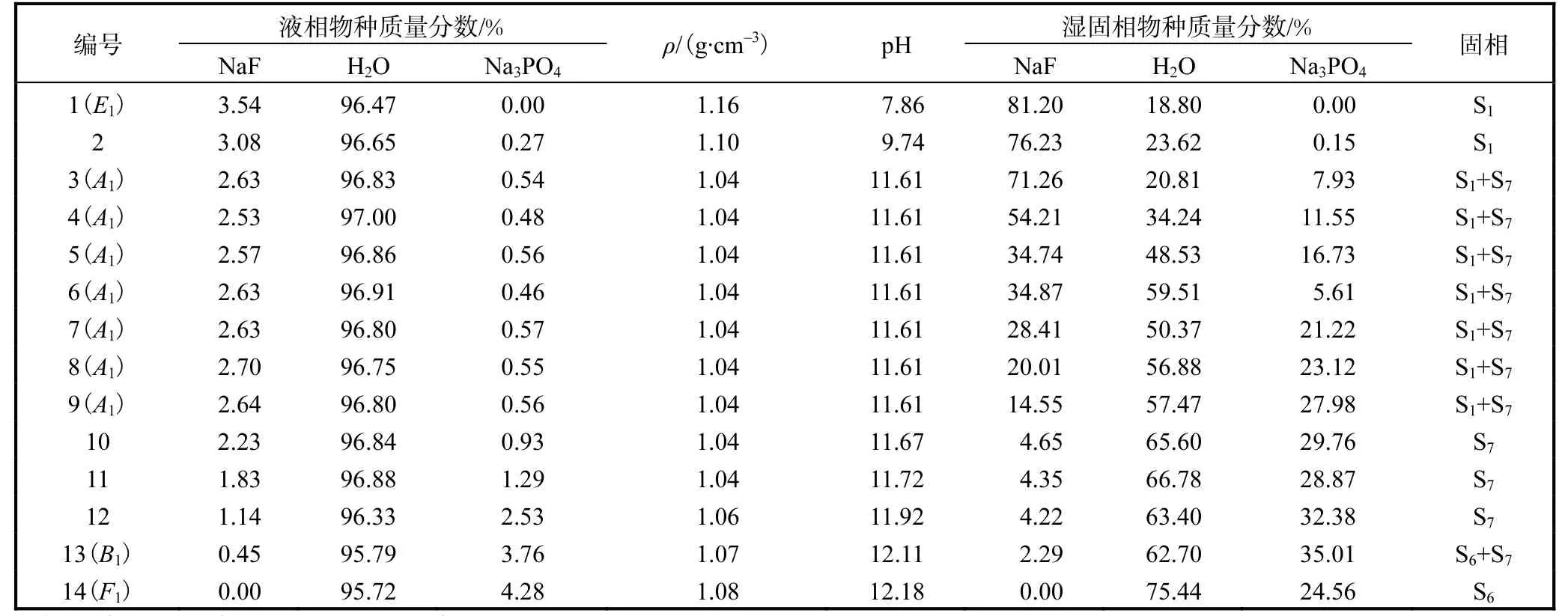
表5 NaF-Na3PO4-H2O 三元体系在273.15 K和101.3 kPa时的固液相平衡数据Tab. 5 Solid-liquid phase equilibrium data of NaF-Na3PO4-H2O ternary system at 273.15 K and 101.3 kPa

表6 NaF-Na3PO4-H2O 三元体系在298.15 K和101.3 kPa时的固液相平衡数据Tab. 6 Solid-liquid phase equilibrium data of NaF-Na3PO4-H2O ternary system at 298.15 K and 101.3 kPa
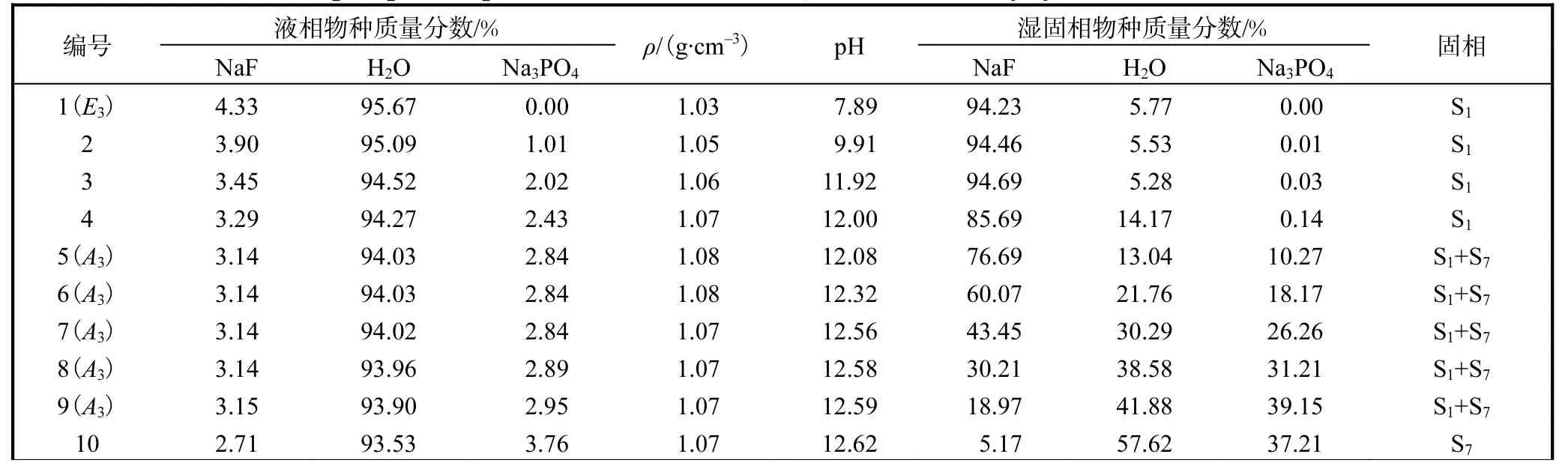
表7 NaF-Na3PO4-H2O 三元体系在323.15 K和101.3 kPa时的固液相平衡数据Tab. 7 Solid-liquid phase equilibrium data of NaF-Na3PO4-H2O ternary system at 323.15 K and 101.3 kPa
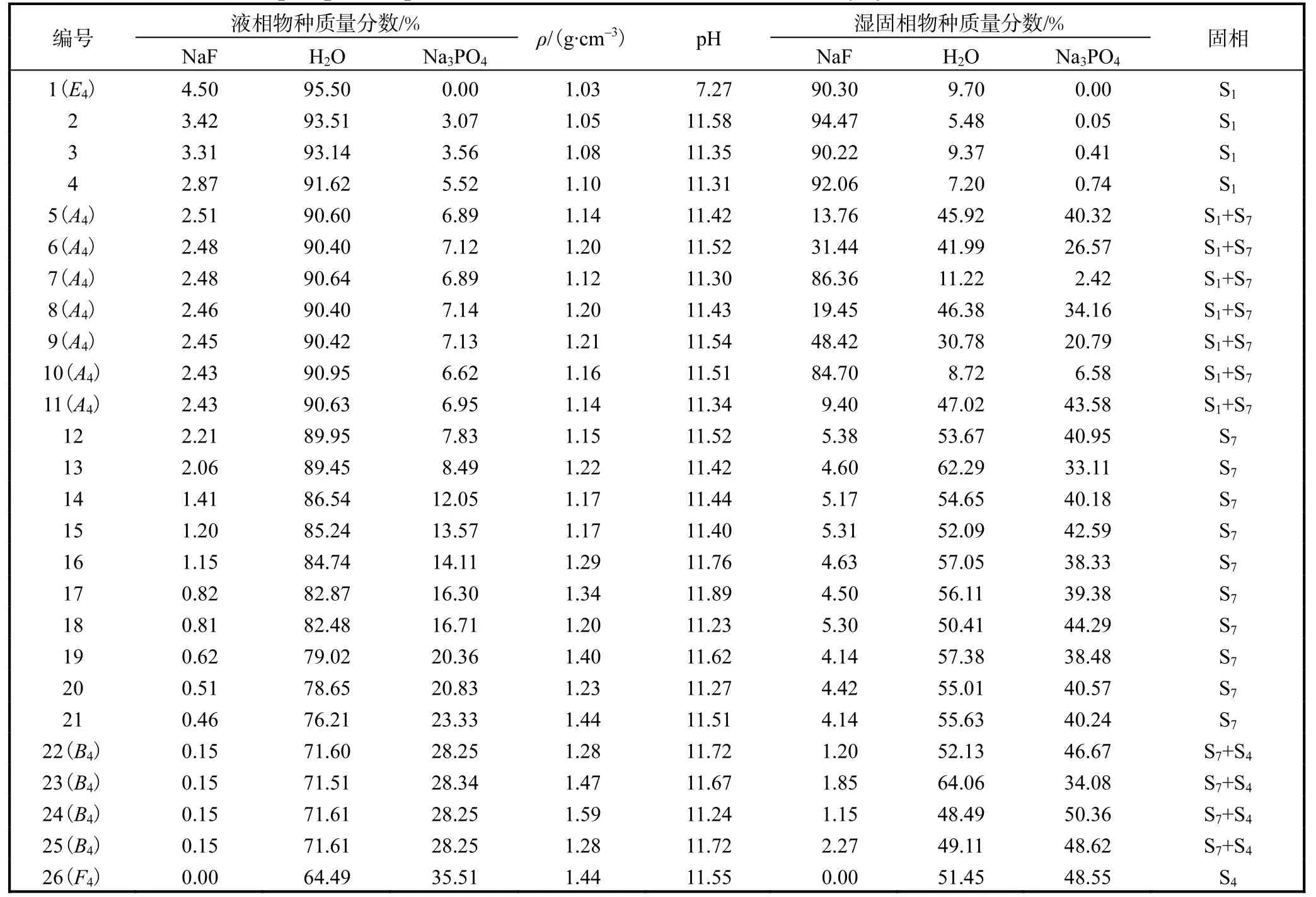
表8 NaF-Na3PO4-H2O 三元体系在348.15 K和101.3 kPa时的固液相平衡数据Tab. 8 Solid-liquid phase equilibrium data of NaF-Na3PO4-H2O ternary system at 348.15 K and 101.3 kPa
在温度较低的273.15 K、298.15 K 和323.15 K,平衡固相为 NaF(S1)、Na3PO4·12H2O(S6)和复盐NaF·2Na3PO4·19H2O(S7)3 种物种。当温度上升到348.15 K 时,水合物 Na3PO4·12H2O(S6)脱水为Na3PO4·8H2O(S4),而复盐 NaF·2Na3PO4·19H2O(S7)没有变化。通过XRD 图谱的固相鉴定,判定液相点A1-3和B1-3、A4和B4是各温度下的共饱和点。因此,相图由E1-4A1-4、A1-4B1-4和B1-4F1-43 条溶解度曲线,E1-4A1-4S1、A1-4S2B1-4、B1-4F1-4S63 个单盐结晶区,以及S1A1-4S7和S2B1-4S6(S2B1-4S4) 2 个复盐结晶区构成,其中高温时B1-4F1-4S6转变为B1-4F1-4S4。
从图1 可以看出,NaF·2Na3PO4·19H2O 占据了一个主要相区。S6和 S7的共饱和点B1非常接近Na3PO4·12H2O 饱和的二元点E1,这意味着NaF 倾向于与Na3PO4结合,形成NaF·2Na3PO4·19H2O。
对比图1—图4 的相图,可以发现:(1)Na3PO4的溶解度很大,并随温度升高而明显增加,导致Na3PO4、Na3PO4·8H2O、Na3PO4·12H2O 盐的相区很小,而NaF 的溶解度随温度变化不大;(2)很难通过实验准确测定Na3PO4水合物在NaF 溶液中的转变温度,Na3PO4·12H2O 在 348.15 K 已脱水转化为Na3PO4·8 H2O,本研究用模型预测得到了这些水合物脱水的温度;(3)NaF·2Na3PO4·19H2O 始终占据总相区的主要部分,但其区域会随着温度的升高而减少,并导致NaF 相区在高温下的扩大。
3.2 模型结果
3.2.1 NaF-H2O、Na3PO4-H2O 体系
NaF-H2O、Na3PO4-H2O 体系液相的基础物种参数汇总在表3 和表4 中,这些热力学常数包括标准生成吉布斯自由能 ΔfG⊖、标准生成焓 ΔfH⊖和等压摩尔热容cp,其中离子的 ΔfG⊖和 ΔfH⊖采用NBS 手册数据[26]。离子热容的温度系数参考了文献[28-29],并在本研究中进一步优化。
液相特征参数,即盐对作用参数的温度系数(ΔgIJ、ΔhIJ和Δcp,IJ)用液相物性数据(如活性系数、渗透系数、饱和蒸气压或等压摩尔热容)得到。对于NaF-H2O 和Na3PO4-H2O 体系,物性数据见表9,液相特征参数ΔgIJ用298.15 K 时的离子平均活度系数和溶液渗透系数拟合,ΔhIJ和Δcp,IJ用多温度的平均活度系数和溶液渗透系数等物性数据拟合。
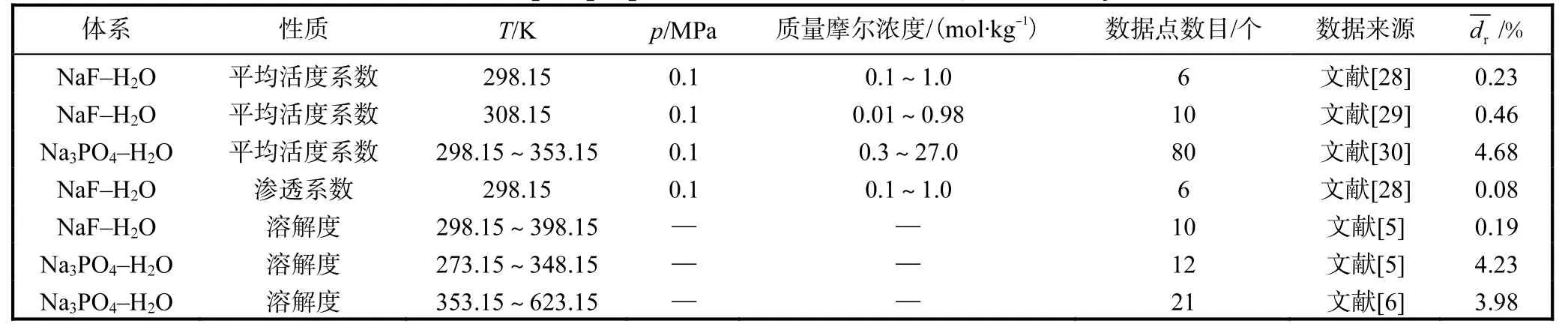
表9 NaF-H2O 和Na3PO4-H2O 体系的液相物性数据Tab. 9 Liquid properties of NaF-H2O and Na3PO4-H2O system
对Robinson[28]和Ivett 等[29]的298.15 K、308.15 K的离子平均活度系数和渗透系数进行拟合的效果如图5 和图6 所示,其平均相对偏差分别为0.23%和0.46%;对文献[30]的温度为298.15~353.15 K、浓度从0 到饱和的平均活度系数进行拟合的效果如图7所示,计算精度满足要求。由此得到的二元体系的液体特征参数(ΔgIJ、ΔhIJ和Δcp,IJ)见表1。
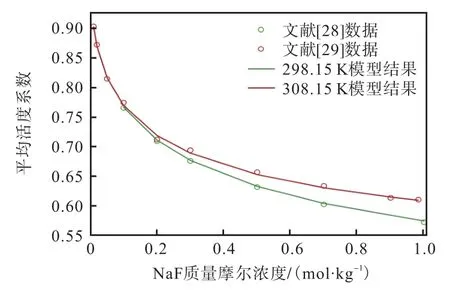
图5 298.15~308.15 K时NaF(aq)的平均离子活性系数的文献数据(点)和模型计算结果(曲线)的比较Fig. 5 Comparison of the literature data (points) and model calculated results (curve) for average ionic activity coefficients of NaF(aq) at 298.15-308.15 K
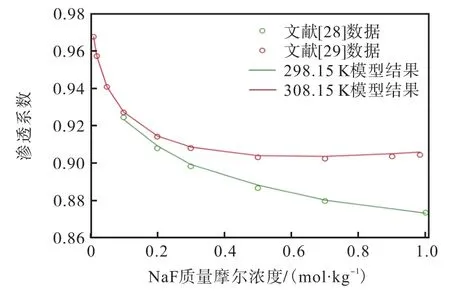
图6 NaF(aq)在298.15~308.15 K的实验数据和模型计算结果之间的渗透系数的比较Fig. 6 Comparison osmotic coefficients between experimental data and model calculated results of NaF(aq) at 298.15-308.15 K
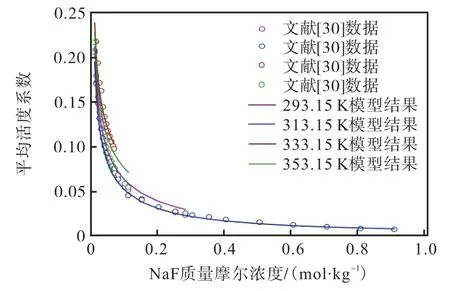
图7 298.15~353.15 K 时Na3PO4(aq)的平均离子活性系数的文献数据(点)和模型计算结果(曲线)的比较Fig. 7 Comparison of the literature data (points) and model calculated results (curve) for average ionic activity coefficients of Na3PO4(aq) at 298.15-353.15 K
在获得二元液相特征参数的基础上,利用式(6)—式(16),对二元体系溶解度数据(表9)进行分段拟合,且将NBS 手册中固相物种热力学数据作为计算初值,从而重新确定了NaF-H2O 体系1 个固相物种以及Na3PO4-H2O 体系5 个固相物种的热力学参数Δf( Tref)、Δf( Tref)和,结果列于表4。NaF 是NaF-H2O 体系的唯一固相,拟合的溶解度曲线与文献[5]的数据非常吻合,如图8 所示,其相对平均偏差仅为0.19%。
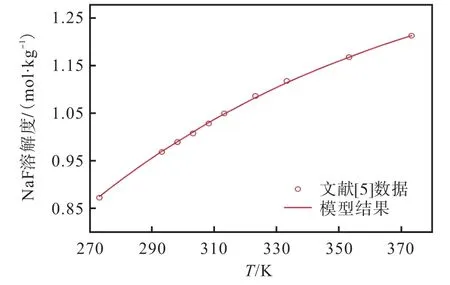
图8 NaF-H2O 二元体系在273.15~373.15 K 温度范围内的溶解度模拟曲线Fig. 8 Solubility simulation curve and local enlarged diagram of NaF-H2O binary system at the temperature range from 273.15 to 373.15 K
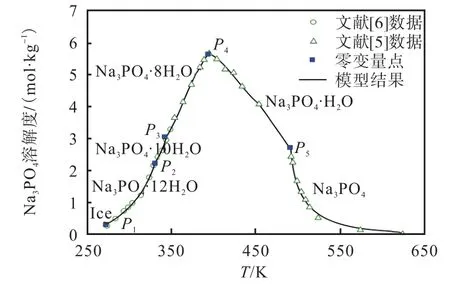
图9 Na3PO4-H2O 二元体系在273.15~623.15 K温度范围内的溶解度模拟曲线Fig. 9 Solubility simulation curve and local enlarged diagram of Na3PO4-H2O binary system at the temperature range from 273.15 to 623.15 K
Na3PO4-H2O 体系相图数据有文献[5]和文献[6]的 2 组溶解度数据,涉及 Na3PO4、Na3PO4·H2O、Na3PO4·8H2O、Na3PO4·10H2O 和Na3PO4·12H2O 5 个固相物种。分别对这5 个固相物种进行拟合,结果如图 9 所示,P1—P5依次为冰、Na3PO4·12H2O、Na3PO4·10H2O、Na3PO4·8H2O、Na3PO4·H2O、Na3PO4之间的共饱和点,5 个盐溶解度的平均相对误差依次为4.93%、2.01%、1.14%、2.57%和5.77%,所得液相和固相参数(见表2、表4)比较好地表达了磷酸钠271.68~623.15 K 全温度区间的溶解度。由此估算了Na3PO4-H2O 体系的5 个零变量点温度,包括最低共熔点和不同水合物的转变点,结果列于表10。
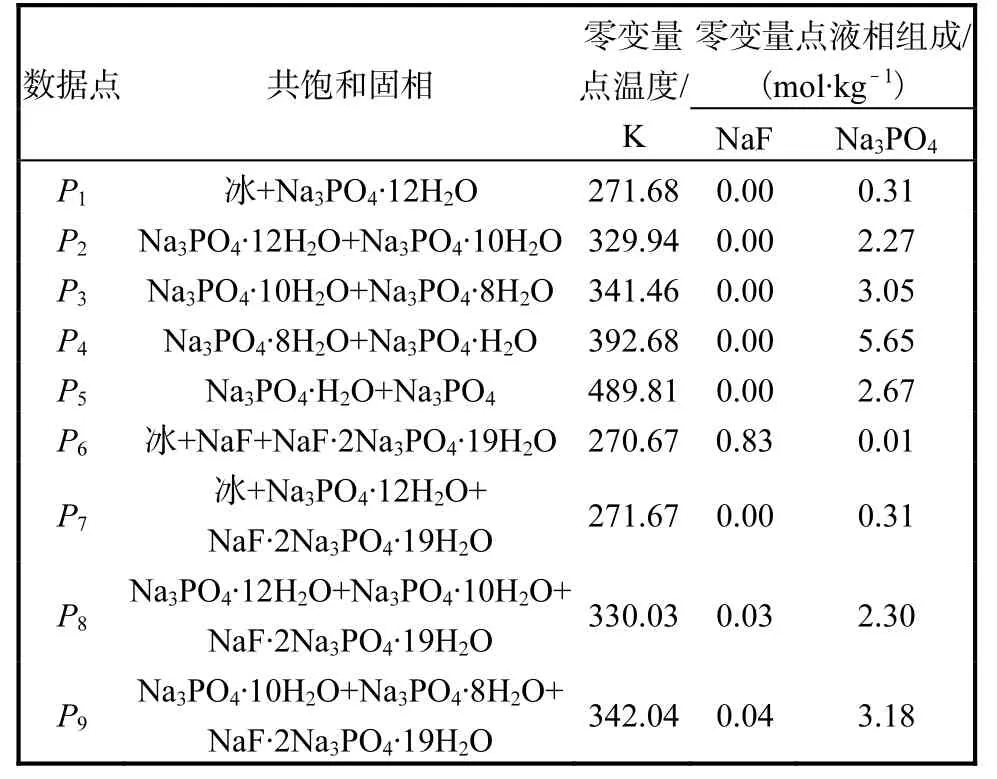
表10 NaF-H2O,Na3PO4-H2O 二元体系和 NaFNa3PO4-H2O 三元体系的零变量点Tab. 10 Invariant points of NaF-H2O,Na3PO4-H2O binary and NaF-Na3PO4-H2O ternary system
3.2.2 NaF-Na3PO4-H2O 体系
通常采用拟合已知二元体系固相在三元体系的溶解度获得三元体系的盐对间相互作用参数IJτ。在NaF-Na3PO4-H2O 体系中,复盐NaF·2Na3PO4·19H2O在实验温度范围内占据了主要的相区,Na3PO4水合物的相区非常小,NaF 或Na3PO4水合物单独饱和的实验点非常少。溶解度数据少会导致液相特征参数的误差大。因此,本研究将三元体系盐对作用参数与复盐的物种参数同时进行拟合,具体如下:
(1)赋初值:复盐NaF·2Na3PO4·19H2O 的热力学数据、和用二元体系固相 NaF(S1)、Na3PO4·8H2O(S4)和 Na3PO4·12H2O(S6)的热力学数据估算,即S1+S4+S6+(S6-S4)/2;液相盐对[Na+Cl-]和[Na+]相互作用参数Δ gIJ和ΔgJI的初值只为0。(2)用298.15 K 三元体系实验测定共饱和点数据,拟合ΔgIJ和ΔgJI。(3)利用三元体系复盐溶解度数据拟合复盐的 ΔfG⊖。(4)以相对误差最小为目标,重复(2)(3)计算,得到ΔgIJ、ΔgJI和复盐的ΔfG⊖,并得到共饱和点的计算值。(5)利用本研究得到的273.15、323.15、348.15 K 所有溶解度数据,盐对相互作用参数的温度系数(ΔhIJ、Δhji、 Δcp,IJ、Δcp,ji)和复盐生成焓ΔfH⊖,同时对(4)确定的ΔgIJ和 ΔfG⊖进一步优化。优化所得盐对作用参数和复盐NaF·2Na3PO4·19H2O 的物种参数分别列入表1 和表3。298.15 K 和348.15 K 的数据拟合效果如图10 所示〔图10(a)的A2、B2、E2、F2和图10(b)的A4、B4、E4、F4分别为表6、表8 中共饱和点和边界点的计算值〕,全部4 个温度的模拟效果如图11 所示。
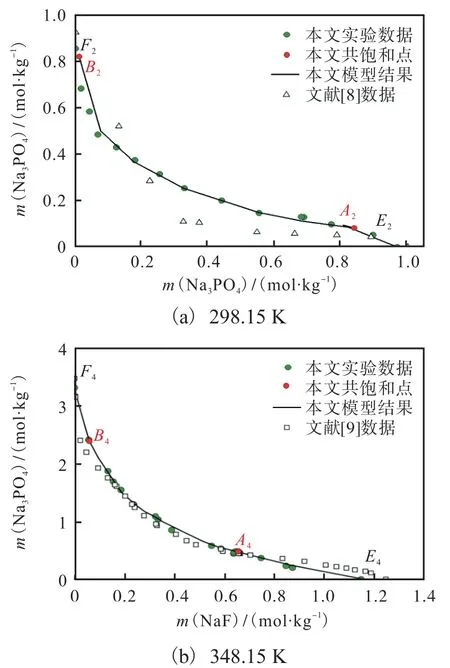
图10 Na+//F-,-H2O 三元体系在 298.15 K 和348.15K的溶解度曲线与文献数据的比较Fig. 10Comparison of solubilitycurvesof Na+//F-,-H2Oternarysystemat298.15K and 348.15K with literaturedata

图11 Na+//F-,-H2O 体系在最低共熔点至348.15 K温度范围内的完整相图Fig. 11 Complete phase diagram of Na+//F-,-H2O system at temperature range from the lowest cointegration point to 348.15 K
研究发现,本文模型很好地表达了 NaFNa3PO4-H2O 体系在温度273.15~348.15K 范围的固液相平衡规律。计算结果与本文实验结果相吻合,在全温度范围内 3 个盐(NaF、Na3PO4·12H2O 和NaF·2Na3PO4·19H2O)溶解度计算值与实验值的平均相对偏差分别为3.84%、3.63%和2.32%,说明本实验测定数据具有热力学一致性。使用文献[8]中298.15 K 的溶解度数据〔图10(a)〕,无法与多温溶解度数据进行热力学一致性表达。文献[9]在348.15 K NaF-Na3PO4-H2O 溶解度数据与本文的趋势大体一致,但在NaF 高浓度区域,文献[9]出现了明显偏差,其在348.15 K 溶解度数据报告为1.256 1 mol/kg,远远偏离了图8 给出的NaF 溶解度随温度变化趋势线,由此判定文献[9]的数据存在误差较大。
3.2.3 NaF-Na3PO4-H2O 体系完整相图预测
鉴于模型和参数,基本表达了NaF-Na3PO4-H2O体系溶解平衡规律,由此:(1)计算等温共饱和点,列入实验数据表中;(2)预测NaF-Na3PO4-H2O 体系有9 个零变量点,结果列入表 10;(3)推演 NaFNa3PO4-H2O 体系从最低共熔点到348.15 K 的完整三维相图,见图11;(4)给出NaF-Na3PO4-H2O 体系多温相图见图12。
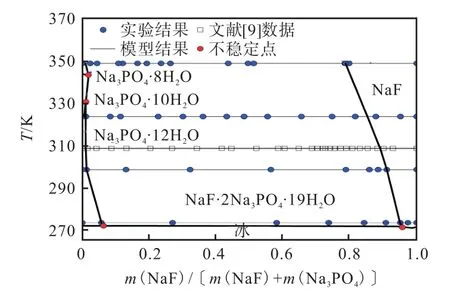
图12 Na+//F-,-H2O 体系多温相图Fig. 12 Polythermal phase diagram of Na+//F-,-H2Osystem
完整相图涉及6 个固相物种的双变量曲面、9 条单变量共饱和线(S1+冰、S1+S7、S7+冰、S6+冰、S6+S5、S5+S4、S6+S7、S5+S7、S4+S7),以及二元、三元体系共9 个零变量点。复盐相区在全部温度下占据主要相区,磷酸钠水合物相区很窄,也就是不容易单独分离,NaF 有较大的单盐相区并随温度升高而扩大,有利于NaF 的单盐分离。
4 结 论
NaF-Na3PO4-H2O 是稀土矿物加工过程涉及的重要体系。为给稀土加工过程卤水的氟、磷资源回收工艺开发提供基础数据和热力学模型,本研究测定了NaF-Na3PO4-H2O 体系在273.15 K、298.15 K、323.15 K 和348.15 K 的相图数据,并以eNRTL 模型为基础建立从最低共熔点到348.15 K 温度范围的综合热力学模型,构建了三元体系的完整结构相图。
实验研究发现NaF-Na3PO4-H2O 三元体系中存在 NaF 、Na3PO4·12H2O 、Na3PO4·8H2O 和复盐NaF·2Na3PO4·19H2O 4 个固相物种。其中Na3PO4易于结合NaF 形成复盐NaF·2Na3PO4·19H2O,复盐在三元体系中占据主要的相区,磷酸盐水合物的相区很小,不容易分离,而NaF 相区随温度升高而增大。
热力学研究确定了2 个二元体系和1 个三元体系的溶液特性参数和7 个固相物种的热力学参数,获得了多温综合热力学模型。该模型合理地表达了NaF-H2O、Na3PO4-H2O 二元体系、NaF-Na3PO4-H2O三元体系的溶解度数据;获得了二元体系的5 个零变量点和三元体系的4 个零变量点等关键数据;预测了NaF-Na3PO4-H2O 体系相图的完整结构;获得了这个三元体系固相物种在实验所及温度范围内固液平衡的完整相区,为更复杂体系的热力学表达以及工业应用提供了参考依据。
