基于Nrf2/ARE信号通路探讨夹脊电针对神经根型颈椎病模型大鼠的作用机制
2024-03-04杨旭霞娄宏君王文韬
杨旭霞,娄宏君,王文韬,高 曦△
1.黑龙江中医药大学,黑龙江 哈尔滨 150040;2.黑龙江中医药大学附属第一医院,黑龙江 哈尔滨 150040;3.山东文登整骨烟台医院,山东 威海 264499
神经根型颈椎病(Cervical spondylosis radiculopathy,CSR)是颈椎病分型中最为常见的一种类型,约占所有颈椎病的60%~70%[1],是常见的神经退行性病变,由颈椎间盘突出刺激或压迫神经根所引起,造成感觉和运动功能障碍,以及一侧或两侧神经根支配区域放射性疼痛[2]。据报道,CSR的发病率随着年龄的增长而增加,50~60岁的发病率大概为0.35%[3],由于人口老龄化速度的加快以及工作方式的改变,CSR的发病年龄逐渐年轻化,严重影响人们的工作和生活[4]。CSR归属于中医“骨痹”“项痹”的范畴,主要病机为风寒湿邪侵袭人体而致经脉气血不通,不通则痛,电针作为一种中医特色疗法,将传统针刺与电刺激相结合,具有理气活血、通痹止痛的作用,临床研究表明,电针对CSR具有良好的治疗效果[5],但其作用机制尚未清楚。因此,本研究通过观察电针颈夹脊穴对CSR所致的神经根炎症中氧化应激因子的影响,探讨夹脊电针治疗CSR的作用机制。
1 实验材料
1.1 实验动物
清洁级SD健康雄性大鼠75只,体质量(300±50)g,由黑龙江中医药大学医学动物实验中心提供[实验动物许可证编号:SYXK(黑)2021-010],实验饲养环境温度(22±2)℃,湿度(60±2)%,12 h循环照明,自由饮食摄水,适应性喂养1周,本研究已通过黑龙江中医药大学伦理委员会审查批准(编号:SLBH-2022022201)。
1.2 试剂与仪器
1.2.1 试剂 丙二醛测定试剂盒、超氧化物歧化酶测定试剂盒和谷胱甘肽过氧化物酶测定试剂盒(南京建成生物工程研究所,货号:A003-1;A001-3;A005-1);大鼠血红素氧合酶(HO-1)酶联免疫分析试剂盒(江苏酶免实业有限公司,货号:MM-0471R1);Nrf2兔多抗、HO-1兔多抗和Keap1兔多抗[北京博奥森生物技术有限公司,货号:bs-1074R;bs-2075R;bs-4900R);GAPDH兔多抗(生工生物工程(上海)股份有限公司,货号:D110016];山羊抗兔二抗(武汉三鹰生物技术有限公司,货号:SA00001-2);BCA蛋白测定试剂盒、ECL化学发光试剂盒和PVDF膜(碧云天生物技术有限公司,货号:P0010S;P0018AFT;FFP24);水合氯醛(天津阿尔法生物科技有限公司,货号:A2865)等。
1.2.2 仪器 华佗牌一次性无菌针灸针(苏州医疗用品厂有限公司,规格0.35 mm×25 mm);电针治疗仪(常州英迪电子医疗器械有限公司,型号:KWD-808I);酶标分析仪(北京普朗新技术有限公司,型号:DNM-9602);电子精密天平[梅特勒﹣托利多仪器(上海)有限公司,型号:PL602S];漩涡混匀仪(群安实验仪器有限公司,型号:VM-300S);金属浴(群安实验仪器有限公司,型号:MDB100C);多用脱色摇床(海门市其林贝尔仪器制造有限公司,型号:ts2000a);数显稳压稳流电泳仪(上海天能科技有限公司,型号:EPS-300);微型垂直槽多板灌胶器(上海天能科技有限公司,型号:VE-60);全自动化学发光图像处理系统(上海天能科技有限公司,型号:Tanon-4600)等。
2 实验方法
2.1 分组与模型制备
将75只SD大鼠随机分为5组:空白对照组、假手术组、模型组、针刺组和实验组,每组15只。用化学诱导法[6]对模型组、针刺组和实验组构建CSR模型,假手术组不进行化学诱导仅进行手术,空白对照组不予任何处理。造模方法:①麻醉与固定:术前禁食12 h,大鼠经腹腔注射麻醉后取俯卧位固定于操作台上,颈前部垫5 mL注射器,以使颈椎后突便于操作。②术前准备:致炎物选择在0.5%的福尔马林溶液中浸泡24 h的定量滤纸片(1 mm×1 mm),去除大鼠颈背部毛发,碘伏消毒(以T1~2正中切口为中心消毒周围4~5 cm),然后铺盖无菌洞巾,显露T1~2正中区域(T2为大鼠颈部第2个高突点)。③手术:以T1~2正中为切口,沿着棘突纵行切开皮肤和皮下组织(逐层切开),切口约2 cm,分离棘突两侧肌肉,暴露棘突和右侧椎板,然后用显微持针钳咬去T1椎板,显露出右侧C8神经根,仔细分离神经根和周围组织(务必不能将神经损伤),然后将用福尔马林溶液浸泡过的定量滤纸片放在暴露的神经根腋下。假手术组仅显露C8神经根,而不放置滤纸片,逐层缝合,关闭切口,缝合完毕后在切口处均匀涂抹阿莫西林粉末,以防术后切口感染。最终术中死亡2只,术后因肠梗阻死亡3只,故每组取12只进行后续检测。
2.2 模型评定
2.2.1 大鼠步态评分 结合Kawakami与Dubuisson法[7-8]对其由疼痛挛缩造成的步态障碍进行评估。从造模前1 d起每日进行评定。其中正常步态、足无畸形计为1分;受损伤足轻触玻璃台面、不持重或轻微持重、走时跛行或足内收蜷缩畸形计为2分;受损足抬起蜷缩、走动时不着台面计为3分。
2.2.2 抓握能力评定 从造模前1 d起每日进行评定[9]。将一根长度为20 cm、直径0.5 cm的一次性筷子平行置于距离地面0.5 m的高度,抓取大鼠,将大鼠双前足置于杆上,令其充分抓握后使其悬吊于杆上,用秒表记录大鼠双前足抓握的时间。另外,将双前足抓握能力相近者计为1分;右前足能抓握但抓握能力明显弱于左前足者计为2分;右前足无法抓握者计为3分。
2.3 干预方法
模型成功后,从第4天开始各组大鼠分别予以以下干预方式:空白对照组不予任何干预;假手术组、模型组予捆绑15 min,1次/d,持续10 d,针刺组俯卧位捆绑大鼠后,针刺部位消毒,使用一次性无菌针灸针针刺大鼠C6、C7双侧颈夹脊穴,穴位定位参照大鼠穴位图谱[10],直刺0.3~0.5 cm,留针15 min,1次/d,持续10 d;电针组俯卧位捆绑大鼠后,以双侧C6、C7为一组,两侧均在针柄处连接电针仪,电流2.5 mA,疏密波,频率50 Hz,予夹脊电针治疗15 min,1次/d,持续10 d。
2.4 取材
治疗结束后,大鼠经腹腔注射麻醉后仰卧位固定于操作台上,先自腹部动脉取血,而后取C8神经根组织于-80 ℃冰箱保存。
2.5 指标检测
2.5.1 试剂盒检测大鼠血清MDA、SOD和GSH-PX的含量或活力 将大鼠血液静置2 h后进行离心,抽取上层血清,用试剂盒检测大鼠血清中MDA、SOD、GSH-PX 的含量或活力,严格参照说明书进行,使用DNM-9602酶标分析仪,于对应波长下读取光密度(OD)值,根据标准曲线计算上述氧化应激因子含量或活力。
2.5.2 Western blot技术检测神经根组织中Nrf2、Keap1和HO-1的蛋白表达 取各组大鼠神经根组织,加入蛋白提取剂(RIPA裂解缓冲液:PMSF蛋白酶抑制剂=100∶1)抽提神经根组织总蛋白,使用玻璃匀浆器于冰上充分研磨匀浆,将匀浆后的样品于4 ℃离心机中10 000 g/min离心10 min,取上清液,用BCA法测定总蛋白浓度,加入含溴酚蓝染料的上样缓冲液和RIPA裂解缓冲液将总蛋白浓度调整至一致,然后于100 ℃金属浴中加热煮沸5 min。采用SD-聚丙烯酰胺凝胶电泳系统分离所测蛋白,而后采用免疫印迹中的湿转法将蛋白转印至PVDE膜上。将转印后的PVDE膜在封闭液(用脱脂奶粉配制而成)中室温摇床封闭2 h,然后加入用TBST稀释后的一抗,于4 ℃冰箱中孵育过夜。第2天TBST洗膜5次,每次8 min。用HRP标记的二抗在室温下孵育1 h,再次洗膜。最后将ECL工作液均匀地滴加在膜上,避光孵育1 min,使用化学发光图像处理系统扫膜,将蛋白质条带图像保存下来,使用ImageJ软件对条带进行分析。
2.6 统计学处理
数据均采用GraphPad Prism9.5.1软件进行统计学分析,计量资料均以均数±标准差的形式表示,多组间比较符合正态分布采用单因素方差分析(One-Way ANOVA),不符合正态分布采用非参数秩和检验(Kruskal Wallis),组间差异比较采用Tukey’s检验,以P<0.05为差异具有统计学意义。
3 结果
3.1 模型评定
造模后,空白对照组与假手术组步态评分与抓握能力评分比较差异无统计学意义;与假手术组比较,模型组、针刺组和电针组步态评分与抓握能力评分均升高,差异具有统计学意义(P<0.01),表明CSR造模成功。干预后,空白对照组与假手术组步态评分与抓握能力评分比较差异无统计学意义;与假手术组比较,模型组大鼠步态评分与抓握能力评分升高,差异具有统计学意义(P<0.01);与模型组比较,针刺组和电针组大鼠的步态评分与抓握能力评分均降低,差异具有统计学意义(P<0.05);与针刺组比较,电针组大鼠步态评分和抓握能力评分优于针刺组,差异具有统计学意义(P<0.05)。见表1~2。

表1 各组大鼠步态评分比较

表2 各组大鼠抓握能力评分比较
3.2 各组大鼠血清MDA含量、SOD与GSH-PX活性比较
与空白对照组比较,假手术组大鼠血清中MDA的含量、SOD和GSH-PX的活性差异不具有统计学意义(P>0.05)。与假手术组比较,模型组大鼠血清中MDA的含量显著升高,SOD和GSH-PX的活性显著降低,差异具有统计学意义(P<0.01)。与模型组比较,针刺组和电针组大鼠血清中MDA的含量明显降低,SOD的活性明显升高,差异具有统计学意义(P<0.05),GSH-PX的活性显著升高,差异具有统计学意义(P<0.01)。与针刺组比较,电针组大鼠血清中MDA的含量明显升高,SOD和GSH-PX的活性明显降低,差异具有统计学意义(P<0.05)。见表3。
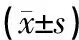
表3 各组大鼠MDA含量、SOD与GSH-PX活性比较
3.3 各组大鼠神经根组织Nrf2、HO-1与Keap1表达比较
与假手术组比较,模型组大鼠神经根组织Nrf2与HO-1蛋白表达水平显著下降,Keap1蛋白表达水平显著上升,差异具有统计学意义(P<0.01)。与模型组比较,针刺组和电针组大鼠神经根组织Nrf2与HO-1蛋白表达水平显著上升,Keap1蛋白表达水平显著下降,差异具有统计学意义(P<0.01)。与针刺组比较,电针组大鼠神经根组织Nrf2蛋白表达水平显著上升,差异具有统计学意义(P<0.01),HO-1蛋白表达水平明显上升,差异具有统计学意义(P<0.05),Keap1蛋白表达水平显著下降,差异具有统计学意义(P<0.01)。见图1、表4。
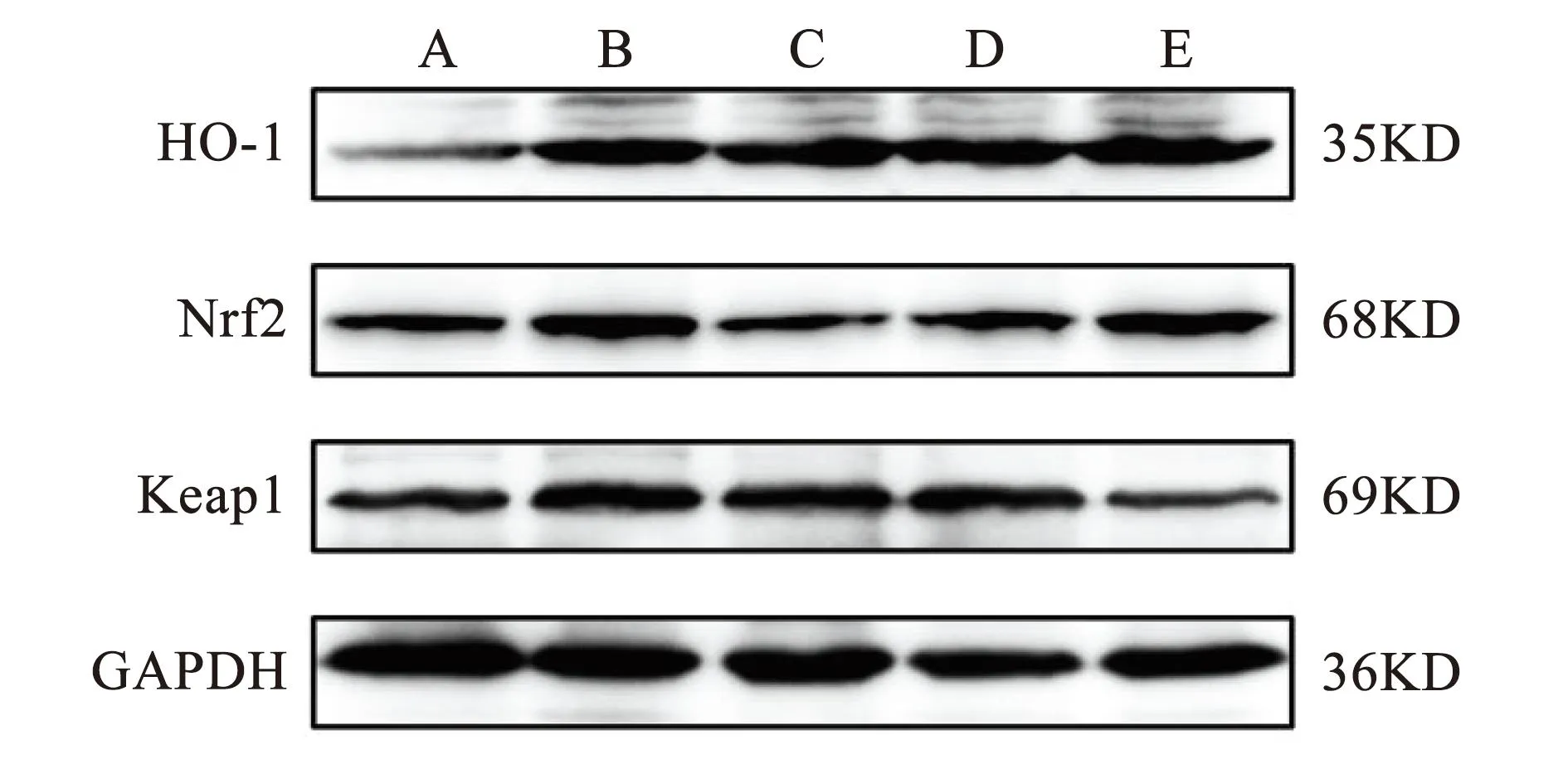
注:A.空白对照组;B.假手术组;C.模型组;D.针刺组;E.电针组。
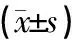
表4 各组大鼠神经根组织Nrf2、HO-1及Keap1蛋白表达
4 讨论
中医学中关于颈椎病的论述散见于“痹证”“痿证”“项强”“肩颈痛”等范畴中,其病机主要与风寒湿邪阻滞经络有关,《素问·至真要大论》述:“诸痉项强皆属于湿。”《灵枢·五邪》篇有云:“邪在肾,则病骨痛,阴痹。阴痹者……肩背颈项痛,时眩。”《杂病源流犀烛》述:“凡颈项强痛,肝肾膀胱病也,三经受风寒湿邪”,其发病部位主要有督脉与膀胱经走行,而颈夹脊穴处这两经之间,可沟通两经之经气,又含局部取穴之义,具有舒经活血、行气止痛的功效,是临床中治疗颈椎病的常用穴位[11]。电针是将神经电生理与经络结合而成的中医特色疗法,针刺得气后,在针上通以微弱的连续波或断续波,从而起到刺激穴位、治愈病症目的,是目前治疗颈椎病较为常用的一种治疗方法[12]。研究已经证实了电针能够起到缓解疼痛、减轻或消除增生物压迫造成的炎症和水肿和改善周围微循环等作用[13]。电针与颈夹脊穴配合应用,可增强夹脊穴通经止痛的功效。
现代医学认为CSR属于椎间盘退行性病变,以颈神经根支配区域出现的根性症状为主要特征,既往研究发现[14],在外周组织发生炎症反应时脊髓环氧化物酶2(COX-2)表达量增加,经夹脊电针治疗后,CSR模型大鼠脊髓组织中COX-2蛋白的表达降低。通常情况下,生物体内存在正常运转的抗氧化体系,当炎症反应发生时,正常的抗氧化体系的平衡被打乱,氧化应激系统被激活[15],一些研究表明,核因子E2相关因子(Nrf2)通过协调炎症细胞的招募和通过抗氧化反应元件(Antioxidant response element,ARE)调节基因表达而参与抗炎过程[16],炎症与氧化应激反应关系密切,Nrf2参与包括氧化应激在内的多种防御机制,在炎症反应、癌症转变等病理发展过程中起重要作用。Nrf2属亮氨酸拉链家族,含有7个同源结构域(Neh1-Neh7)[17],其中Neh2是Nrf2与Kelch样ECH相关蛋白1(Kelch-like ECH-associated protein 1,Keap1)相结合的区域[18],Nrf2识别并结合ARE来启动抗氧化通路。生理状态下,大部分Nrf2与Keap1结合而处于失活状态,在创伤、炎症等刺激下,Nrf2与Keap1解离,先与小MAF蛋白(small MAF,sMAF)组合成异二聚体,再与ARE结合,启动其下游的血红素加氧酶-1(Heme oxygenase 1,HO-1)、Ⅱ相解毒酶、抗氧化酶和抗炎因子等的表达以增强机体细胞的抗氧化能力。HO-1是机体内广泛存在的一种诱导酶,能够分解血红素,消耗机体内的游离氧,减少氧自由基(ROS)的生成和堆积[19]。有研究发现,在发生臂丛神经根性撕脱损伤后,脊髓前角中的Nrf2和HO-1在基因和蛋白水平上的表达随损伤呈现一定的时序性,激活Nrf2/ARE信号通路可阻止或减轻臂丛神经根性撕脱后氧化应激反应对脊髓前角运动神经元的损伤[20]。有关椎间盘退行性变的机制研究显示,红景天苷可以促进Nrf2表达量增加,显著上调TNF-α刺激下的髓核细胞中Nrf2下游的HO-1,可在人体髓核细胞中通过启动Nrf2/ARE信号通路发挥抗氧化作用[21]。自噬是细胞重要的防御机制,与Nrf2/ARE/HO-1信号通路关系密切,p62蛋白是连接自噬与Nrf2/ARE信号通路的桥梁[22],自噬启动可以对神经系统起到保护作用。本研究显示,造模后大鼠出现右前足抬离地面、向胸前蜷缩的表现,步态障碍表现明显,抓握能力受限,经夹脊电针治疗后,步态基本恢复正常,抓握能力得到恢复,说明夹脊电针可以改善CSR的根性症状。经过夹脊电针治疗后,电针组大鼠血清中MDA的含量明显降低,SOD的活性明显升高,GSH-PX的活性显著升高,神经根组织中Nrf2与HO-1表达显著上升,Keap1表达显著下降,说明夹脊电针可以通过上调Nrf2与HO-1的表达和下调Keap1的表达实现对Nrf2/ARE通路的调控,刺激机体抗氧化应激反应发生以减轻CSR所致的根性疼痛。
综上所述,夹脊电针可能通过激活Nrf2/ARE信号通路发挥抗氧化应激作用,减少神经细胞损伤,缓解CSR根性疼痛,进而实现保护神经的作用。这为电针防治CSR提供了理论依据。但单一信号通路并非单独发挥作用,常常与其他通路相互联系、相互作用,在CSR的病理过程中Nrf2/ARE通路是否与其他通路相互串联,其具体机制有待进一步探究。
