红色和近红外发光染料的微量合成及其发光性能的测定
2024-03-04白浩彤苏崇杰冯黎阳庄俊鹏
白浩彤,苏崇杰,冯黎阳,庄俊鹏,*
1 北京化工大学化学学院,北京 100029
2 北京化工大学材料科学与工程学院,北京 100029
在本科大学化学教学实验中仅有少量实验涉及到功能染料的合成,如甲基橙的合成实验等[1]。这是由于在克级常量染料合成实验中,在抽滤、洗涤、萃取和分液的过程中经常会有遗撒,容易污染实验室。因此,在大学化学实验中,需要开发一些微量合成实验,以避免常量染料实验的弊端。同时,在科学研究中,经常采用几十毫克级的微量反应,对于本科生也需要提高微量有机合成实验的操作技能,为将来从事科学研究工作打下良好基础。
各个学校针对化学、应用化学、高分子材料和材料等专业的学生,在大学三年级会开设8–10学时的专业实验,来进一步提高学生的实验技能和理论联系实际的能力。本实验就是针对大学三年级的学生,将一部分发光染料开发工作设计为微量反应并转化为教学实验,主旨就是为了提高大三学生的微量有机合成和产物分离的实验操作水平,锻炼他们对紫外光谱仪和荧光光谱仪的使用,以及提高他们分析结构和性能之间关系的能力。
近几十年来,功能染料取得了长足的进展,染料早已不再只局限于传统布料印染的领域,在材料领域如光3D打印功能材料、生物领域如荧光标记染料、医学领域如光动力学癌症治疗中的染料光敏剂、能源领域如敏化太阳能电池材料等,起到了越来越重要的作用[2–5]。功能染料有些是利用了其光化学性质来应用的,如光聚合和光致变色染料,在光照条件下发生化学变化形成新的结构;而另外一些染料在应用时结构和化学性质并不发生改变,只是利用了染料的光物理性质,如具有各种新型发光性能的染料,如光致发光、化学发光、近红外化学发光染料等备受瞩目[6,7]。这些优异的功能染料的合成及性能测定也为本科大学化学实验教学提供了众多优质的素材。
苝系染料是一类含有四个苯环并在一起的、大共轭体系的苝环母体结构的染料,图1列出了苝环母体结构以及几种苝系染料原料的结构,如3,4,9,10-苝四甲酸二酐(简称苝酐)、1,6,7,12-四氯-3,4,9,10-苝四甲酸二酐(简称四氯苝酐)和1,6,7,12-四氯-N,N'-二(2,6-二异丙基苯基)-3,4,9,10-苝二酰亚胺(简称四氯苝二酰亚胺)。苝酐是合成苝系染料最基本的原料,可以在海湾区和轴向进行衍生化。苝二酰亚胺类染料具有非常优异的热稳定性和光稳定性,是一种应用广泛的功能染料。苝系染料通常以苝酐为原料,经过氯化得到四氯苝酐,再与脂肪族胺或芳胺反应制备四氯苝二酰亚胺来增加苝染料的溶解性,再将四个氯取代得到苝二酰亚胺系列的染料[8]。
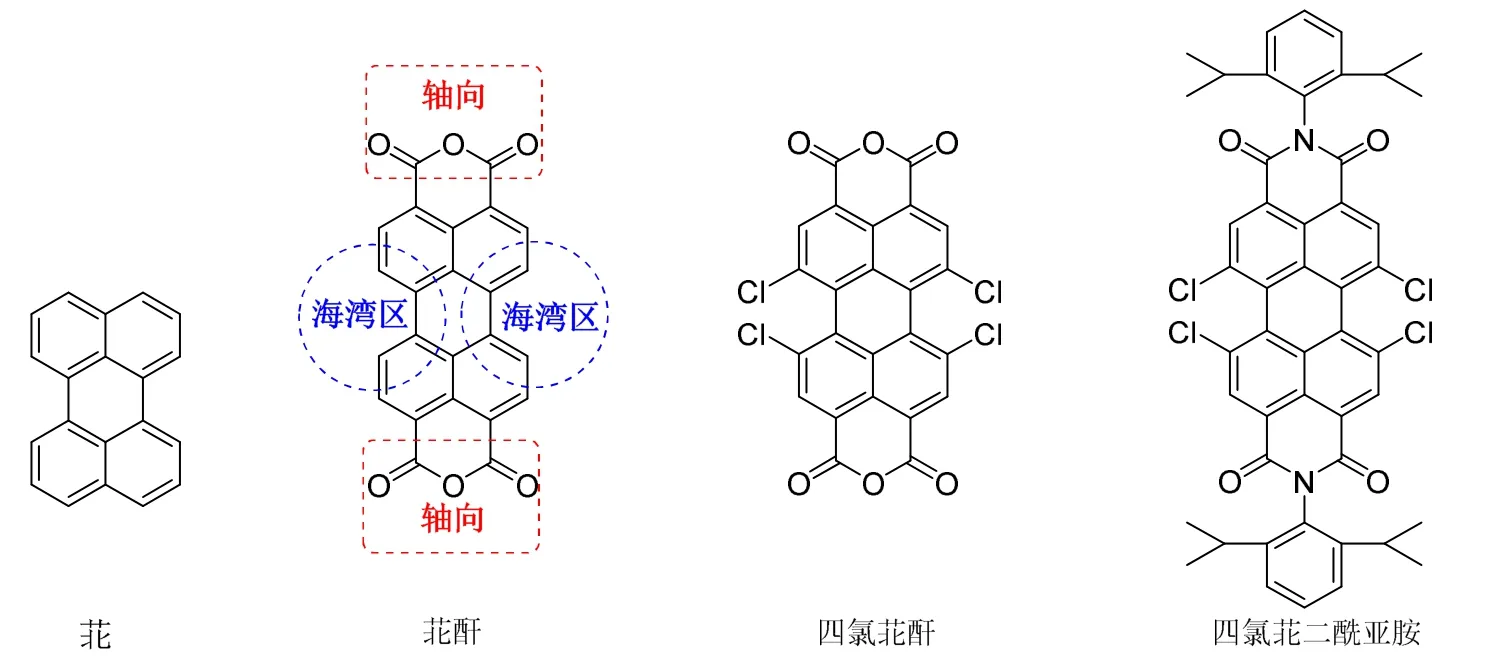
图1 苝、苝酐、四氯苝酐和四氯苝二酰亚胺的结构
蒽酮紫是另一类功能染料,其中16,17-二甲氧基蒽酮紫是一种重要的还原染料,颜色为绿色,具有极强的染色牢度。而16,17-二癸氧基蒽酮紫是一类最经典的近红外发光染料,其合成以苯绕蒽酮为原料通过偶联、氧化得到16,17-二羟基蒽酮紫[9],再与1-溴癸烷反应,得到目标化合物。从20世纪60年代以来,一直在化学发光领域具有重要的应用[10]。
本实验选择苝和蒽酮紫功能染料为研究对象,合成了两种分别具有红光和近红外发光特性的染料。两个实验均采用N-甲基吡咯烷酮(NMP)为溶剂,在120 °C的相同的条件下开展反应[6]。以四氯苝二酰亚胺为原料,在无水碳酸钾的作用下与苯酚反应合成了四苯氧基取代的苝二酰亚胺(1)。以16,17-二羟基蒽酮紫为原料,在无水碳酸钾和18-冠-6-醚作用下与1-溴癸烷反应,制备了16,17-二癸氧基蒽酮紫(2),反应式如图2所示。虽然两种染料结构看上去比较复杂,但反应机理简单,选择性好,收率高,反应速率快,重复性好,该反应适合作为本科教学实验。
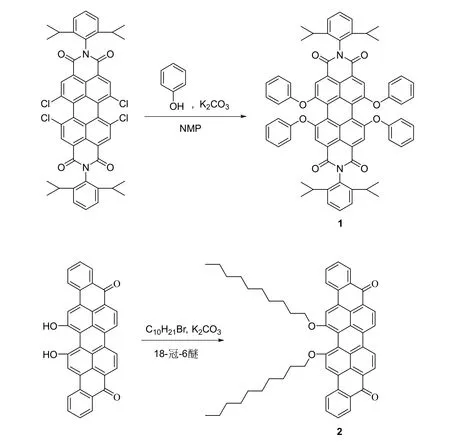
图2 苝染料1和蒽酮紫染料2的合成路线
1 实验部分
1.1 反应原理
两个反应的机理类似,都是亲核取代反应。第一个反应是芳环上的亲核取代反应机理(SNAr),苯氧基负离子作为亲核试剂进攻苝环上与氯原子相连的碳原子,连接到苝环上形成带负电荷的中间体,氯负离子再离去,得到一苯氧基取代的产物,然后,再分别发生三次亲核取代反应,得到四苯氧基取代的产物。而第二个反应中,16,17-二羟基蒽酮紫与碳酸钾反应生成负离子,再进攻1-溴癸烷中与溴相连的碳原子,发生亲核取代反应,得到一取代的产物,再发生一次亲核取代反应,连上两个癸基,得到16,17-二癸氧基蒽酮紫。图3列出了两个反应的机理。
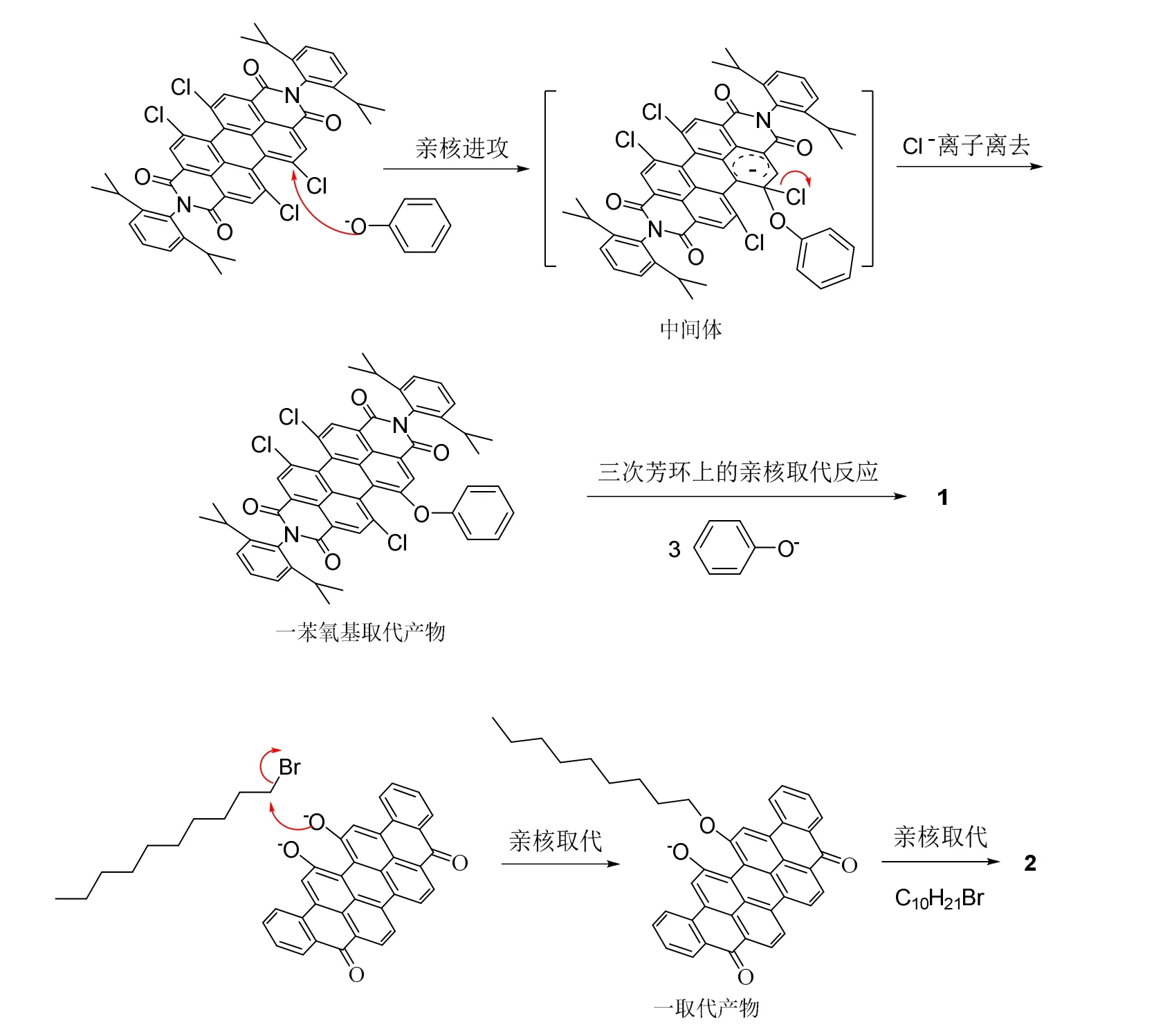
图3 两种染料合成的反应机理
本实验的功能染料涉及到两种发光的现象,分别为光致发光和化学发光现象。染料在溶液中或在固态条件下,当以一定波长的电磁波照射时,可以吸收电磁波的能量,自身达到激发态,然后从激发态向基态跃迁的过程中,将能量以更长波长的电磁波发射出来的现象称为光致发光现象。而化学发光是在溶液中草酸二芳基酯与过氧化氢发生反应,生成1,2-二氧杂环丁烷-3,4-二酮中间体,这个活泼的中间体与化学发光染料碰撞,自身分解为两分子的二氧化碳,而化学发光染料达到激发态,从而发出光线[10,11]。
1.2 试剂或材料
四氯苝二酰亚胺、16,17-二羟基蒽酮紫、化学发光液和氧化液均来自北京文海阳工贸有限责任公司,为工业级试剂。化学发光液和氧化液分别是草酸双(2,4,5-三氯水杨酸戊酯基)酯和过氧化氢的邻苯二甲酸酯的溶液。虽然可以自行配制,但发光染料在商业化的发光液和氧化液中发光效果更明亮,发光时间也更长。苯酚、18-冠-6醚和1-溴癸烷购于毕得试剂公司,为分析纯试剂。无水碳酸钾和其他溶剂均为常规分析纯试剂。
1.3 仪器和表征方法
IKA加热磁力搅拌器,11孔微量平行加热铝块,手持式三用紫外线分析仪,紫外光谱仪(日立UV-3010),荧光光谱仪(日立F-7000)。
1.4 实验步骤/方法
1.4.1 染料1和2的合成
在一个配备小磁子的4 mL玻璃样品瓶中,加入60 mg (0.071 mmol)四氯苝二酰亚胺、53 mg (0.56 mmol)苯酚和78 mg (0.56 mmol)无水碳酸钾。放在多孔平行加热铝块上。在另一个配备小磁子的4 mL玻璃样品瓶中,加入50 mg (0.10 mmol)经过研磨的16,17-二羟基蒽酮紫粉末、57 mg (0.41 mmol)无水碳酸钾、27 mg (0.10 mmol) 18-冠-6醚催化剂以及68 mg (0.31 mmol) 1-溴癸烷。在两个样品瓶中分别加入2 mL的NMP作为反应溶剂,并将两个样品瓶放在11孔平行反应加热铝块上,设定温度120 °C,磁力搅拌反应,装置如图4所示。其间,每隔15 min取一次样,用薄层色谱法跟踪反应进行的程度。用V石油醚:V乙酸乙酯= 4 : 1的展开剂展开。大约经过1.5–2 h原料可以完全转化为产品。

图4 多孔平行反应装置
两种染料的后处理方式完全一致。先将平行反应铝块转移到升降台上自然冷却。用吸管将反应液转移到50 mL鸡心瓶中。再用约10 mL二氯甲烷充分洗涤样品瓶,并将二氯甲烷溶液转移到鸡心瓶中。在鸡心瓶中加入约30 mL去离子水,利用剧烈的磁力搅拌模拟分液漏斗中溶液的振荡,水溶性的杂质溶于水层,而产品在二氯甲烷层。由于染料的颜色很深,用白光在背后照射,可以清楚地看到瓶中的界面,然后用吸管小心地将下层二氯甲烷溶液吸出。再用少量二氯甲烷洗涤水相,再将二氯甲烷溶液吸出,合并二氯甲烷层,完成了分液的操作。然后,将二氯甲烷的溶液用旋转蒸发仪旋干,并提高水浴的温度,尽量将瓶中残余的水分也旋蒸除去,得到染料粗品。
用2 mL二氯甲烷将染料粗品溶解。用打火机将普通的3 mL塑料吸管前端烧软,像拉玻璃毛线管一样,可以拉制毛细塑料吸管,很方便地在制备薄层色谱板上上样。用电吹风吹干样品带,放入大展开缸中进行展开。考虑到染料的溶解度,对于染料1使用V石油醚:V二氯甲烷= 1 : 1的混合溶剂展开,而对于染料2使用V二氯甲烷:V乙酸乙酯= 10: 1的混合溶剂展开。大约20–30 min,样品可以在制备薄层板上展开完毕。如图5所示,制备薄层色谱板分离效果非常好。

图5 染料1和染料2的制备薄层色谱分离
最后,将制备薄层色谱上的染料带刮下来,装入塞有棉花的玻璃漏斗,用二氯甲烷将染料洗脱下来,用旋转蒸发仪旋干后,再用真空泵充分干燥,得到43 mg染料1,产率56%;51 mg染料2,产率65%。
1.4.2 含有染料的聚苯乙烯薄膜的制备
各取10 mg的染料1和染料2加到两个50 mL的小烧杯中,加入20 mL乙酸乙酯,超声将样品溶解。分别称取3 g左右的聚苯乙烯泡沫塑料,加入小烧杯中,泡沫塑料溶于乙酸乙酯溶液,用玻璃棒充分搅拌,可以得到透明的粘稠染料溶液。将溶液倒在一个培养皿或表面皿内,慢慢挥发乙酸乙酯,或用不高于50 °C的加热带烘干,得到染料均匀分散的聚苯乙烯膜。
2 结果与讨论
2.1 合成讨论
染料1的原料四氯苝二酰亚胺在溶剂NMP中具有良好的溶解度,所以反应很容易发生。但是染料2的原料16,17-二羟基蒽酮紫在NMP中的溶解度很差,因此,反应前需要用研钵把原料研成细碎的粉末,提高非均相反应的反应速率。
对于染料的合成,可以方便地用薄层色谱法进行监测。图6是升温到120 °C后,反应0、15、30、45和60 min后样品的薄层色谱展开图,展开剂为V石油醚:V乙酸乙酯= 4 : 1,为了更清楚表示反应的进程,图6中也列出了相应的示意图。

图6 染料1和2的薄层色谱跟踪图和示意图
从图6中可以看出,染料1的板子从上到下显示出五行点,最上面一行是橙黄色的四氯苝二酰亚胺的原料点,当氯被苯氧基依次取代后,分子的极性逐渐增强,展开后在板子上的高度依次降低,颜色也从橙黄向红色转变。板子上第二行到第五行的点分别对应着苯氧基一取代到四取代的产物。结果显示,在升温的过程中反应就已经发生,出现了一取代的产物。随着反应的进行,原料逐渐经过一取代、二取代和三取代的中间产物,最终转化为四苯氧基取代的产物染料1,大约1 h左右,染料1已经成为反应的主产物点。
染料2的板子只有一个蓝色的产物点。由于原料16,17-二羟基蒽䣳紫不溶于展开剂,也无法展开,所以可以发现原点处有明显的绿色斑点,随着反应进行,展不动的绿色斑点越来越淡,说明16,17-二羟基蒽酮紫与1-溴癸烷发生了反应。反应中并没有检测到一取代的中间产物点,推测有两个原因,一个可能是一取代的中间产物在原点展不动,另一种可能是一取代的中间产物具有更好的溶解度,比原料更容易与1-溴癸烷发生反应,所以生成的一取代的中间产物很快转化为二取代的产物染料2。再经过大约0.5–1 h,反应可以进行到底。
由于是微量反应,所以本实验尽量减少操作步骤和所使用的玻璃仪器。在分离操作中,只使用了50 mL的鸡心瓶,通过剧烈搅拌代替萃取,用吸管转移溶液来代替分液,将残余的水分通过旋转蒸发仪带走代替无水硫酸钠干燥,这些操作最大限度地减少产物的损失并避免污染。
对于微量反应,制备薄层色谱板分离是一种高效的分离方法,非常适合本实验。采用一块20 cm ×20 cm的制备板就可以实现微量染料的纯化,提高了学生的实验操作技能。
2.2 两种染料的紫外光谱、光致发光光谱和化学发光光谱的测定
为了进一步地了解两种染料的光谱性质,配制了两种染料1 × 10−3mol·L−1的二氯甲烷溶液,再稀释到1 × 10−5mol·L−1,分别测定了它们的紫外光谱,再以其紫外最大吸波长为激发波长测定了其荧光光谱。另外,分别称取2 mg的染料1和染料2,分别加入两个小玻璃瓶中,在两个瓶中分别加入1 mL商业化的发光液和1 mL商业化的氧化液,搅拌均匀,化学发光染料的浓度约1 mg∙mL−1。1的瓶中迅速发出明亮的红光,而2的瓶在室内自然光下几乎看不到任何变化。将染料化学发光的溶液倒入荧光比色皿中,用荧光光谱仪测定染料的化学发光光谱。由于三种谱图的纵座标值差别很大,所以将荧光光谱和化学发光光谱归一化处理,使其纵坐标值与紫外最大吸收峰的吸光度值一致,以方便比较。
从图7中可以看出,1的紫外最大吸收波长为575 nm (ε= 4.92 × 104L·mol−1·cm−1),主要吸收绿光和黄光,而其荧光光谱中最大荧光发射波长位于605 nm,化学发光光谱中最大发射波长为630 nm。化学发光光谱相比于荧光发射光谱发生25 nm的红移,这是由于化学发光溶液中1的浓度要比荧光光谱测定时1的浓度大很多造成的。2的紫外最大吸收波长为650 nm (ε= 3.82 × 104L·mol−1·cm−1),对红光区的光线具有很好的吸收作用。其荧光发射光谱的最大发射波长为707 nm,已经接近近红外区,肉眼对这一区域的红光已经不敏感。而2的化学发光光谱又红移了27 nm,发光的隐蔽性更好,更不易被肉眼发现。

图7 染料1和2的紫外光谱、归一化的荧光光谱和化学发光光谱
2.3 两种染料的光致发光和化学发光趣味实验
为了直观地让学生感受到光致发光和化学发光的应用,本实验设计了用红色和绿色激光笔作为光源,来验证两种染料的光致发光。将两种染料配成溶液,其浓度可自行调节,浓度越大,对光线吸收作用越强。浓度越小,对光线的透过性越好。将染料的溶液装入荧光比色皿中进行照射。可以直接使用测定紫外光谱时配好的1 × 10−3mol·L−1的二氯甲烷溶液。
绿色激光笔的发射波长在532 nm附近,正好位于1的吸收区域。用绿色激光笔照射1的溶液,发现绿光被1的溶液吸收,比色皿发出了明亮的红光,绿色的入射光被转化成了红光,效果直观有趣。红色激光笔的发射波长在630 nm附近。用红色激光照射1的溶液,红光会穿透过去,说明1不吸收红光。
用绿色激光笔去照射2的溶液,发现绿光可以穿透蓝色的2的溶液,说明2在绿光区几乎没有吸收。但用红光去照射2的溶液,发现红光被2吸收,并通过光致发光现象转化为近红外光。由于近红外光肉眼不可见,不容易直接观察到。图8是1和2的溶液在绿色和红色激光笔照射下的情况。

图8 染料1和染料2的溶液在绿光(左)和红光(右)照射下的情况
用1和2的聚苯乙烯薄膜试验也是相同的效果。图9是1和2的聚苯乙烯膜对红光和绿光透过的示意图。
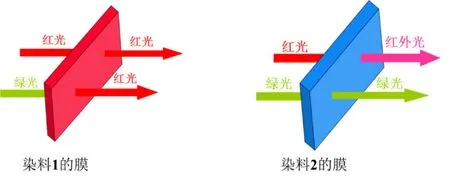
图9 染料1和染料2的聚苯乙烯膜对红光和绿光透过的示意图
最有趣的实验是化学发光实验,1和2是在化学发光领域最经典的红光和近红外化学发光染料。染料1的红色化学发光非常明显,但2的近红外化学发光非常不明显。将2的瓶子放入暗箱中,用肉眼从观察孔中仔细观察,可以发现瓶身呈微弱的暗红色,但如果用近红外检测目镜观察,马上呈现出明亮的近红外化学发光,如图10所示。通过自己亲手合成的染料实现红色和近红外化学发光,可以大大激发学生的兴趣,并让学生深入思考化学发光的应用。

图10 染料1和染料2的化学发光(左)和染料2在暗室中的近红外化学发光(右)
3 结语
本实验采用微量法合成了两种功能染料,其中苝染料具有红色发光性能而蒽酮紫染料具有近红外发光性能。这两种染料同时具有良好的光致发光和化学发光的性能,通过简单的绿色和红色的激光笔就可以直接观察到两种染料的化学发光。而简单的化学发光实验更能激发学生的兴趣和开发近红外化学发光的应用。通过对紫外吸收、光致发光光谱、化学发光光谱的分析,同学们可以从本质上了解两种发光现象的原理。本实验内容充实,锻炼了学生的有机合成技巧,提高了学生理论联系实际的能力,是一项适合化学以及材料相关专业高年级本科生开展的综合化学实验。
4 创新性声明
1) 通过微量平行反应和相同的后处理方法合成了两种发光染料;
2) 这两种染料都同时具有优异的光致发光和化学发光的性能;
3) 通过简单的红绿激光笔以及化学发光溶液展示绚丽的发光之美。
