研究型仪器分析实验:红酒样品中多氯联苯含量的测定
2024-03-04郑海娇许海贾琼
郑海娇,许海,贾琼
吉林大学化学学院,长春 130012
仪器分析是指采用比较复杂或特殊的仪器设备,通过测量物质的某些物理或物理化学性质的参数及其变化来获取物质的化学组成、成分含量及化学结构等信息的一类方法。仪器分析实验为本科化学专业及近化学专业学生必修的一门实验课程[1–3],它具有灵敏度高、专一性强、取样量少、耗时短等优点。在现有的仪器分析实验中,通常注重仪器操作与样品分析的流程,或针对单一种类的仪器安排实验内容,缺少对样品前处理流程的关注和不同种类仪器在同一个实验内容中的配合使用,这些缺陷使得仪器分析实验缺少整体性和综合性。评价高等院校人才培养质量的重要指标是大学生的实践动手能力。因此,开展完整性和综合性较强的仪器分析实验,培养学生动手实践与思维创新的能力,让学生在认识仪器组成的同时熟悉仪器原理与操作,此教学内容的开展十分重要。笔者所在教学团队承担仪器分析理论课与实验课教学的工作,且多年从事样品前处理领域的科研工作,尤其在固相微萃取技术方面取得一系列科研与教学成果[4–8]。希望通过总结多年实践经验,采用参考文献与实际研究相结合的方式,将前沿的科研成果转化成与基础教学相匹配的教学资源,设计出具有合理性的同时适用于本科教学和实际应用的仪器分析实验。
作为一类重要的持久性有机污染物,有机氯污染物所造成的污染和危害已引起人们的重视。首批列入《关于持久性有机污染物的斯德哥摩公约》受控名单的12种持久性有机污染物中,有9种是有机氯农药。参考世界卫生组织国际癌症研究机构2017年公布的致癌物清单,多氯联苯作为有机氯污染物中的一类,属于I类致癌物。在我们的生产生活中,如绝缘油、热载体等多种产品的工业添加剂的成分中均存在多氯联苯。由于多氯联苯的性质稳定,在自然界中很难被分解,导致其在环境中能长时间存在,并且会随食物链进入到人体,引发疾病发生[9,10]。因此,选用多氯联苯作为待测物,在教学上是有实际意义的。目前,多氯联苯已发展出多种检测手段,包括拉曼光谱技术[11]、光电化学检测法[12]、气相色谱-串联质谱技术[13,14]、气相色谱法[15,16]等。其中,气相色谱法具有灵敏度高、进样量小、准确度好、耗时短、适用范围广的特点,被广泛地应用于多氯联苯的检测。作为仪器分析实验中不可或缺的环节,样品前处理可有效减少环境样品中存在的大量干扰性杂质对分析结果造成的影响。固相微萃取技术于20世纪末由加拿大科学家Pawliszyn提出,这项技术通过集成化的萃取流程大大缩短了检测时间,其优势有目共睹,在化学、环境、医学、食品等学科中深受重视并推广应用[17]。
1 实验目的
本实验的主要教学对象是在学习并掌握无机化学、有机化学和仪器分析理论课及相关实验技术的基础上的高等学校化学专业高年级的本科生,通过仪器分析综合实验进一步提高学生综合运用仪器解决实际问题的动手能力和创新能力。实验安排8学时,分为三个部分,固相微萃取技术的理论学习、仪器分析实验的理论知识学习、实验操作及数据处理。主要教学目的为:
(1) 通过实际样品萃取实验操作学习并巩固样品前处理知识,让学生充分了解仪器分析实验的全流程;
(2) 通过仪器分析实验操作学习并巩固色谱理论及光谱理论,使学生掌握通过不同的仪器处理实际问题的方法,培养学生的动手能力;
(3) 通过仪器分析全流程的实验演示及操作,具体问题具体处理,培养学生综合思考的能力。
2 实验部分
2.1 主要试剂
甲基丙烯丁酸酯(≥ 99.7%)、偶氮二异丁腈(≥ 99.7%)、甲基丙烯酸氧丙基三甲氧基硅烷(≥ 99.7%)、乙二醇二甲基丙烯酸酯(≥ 99.7%)、氧化亚铜(≥ 99.5%)、正丙醇(≥ 99.5%)、1,4-丁二醇(≥ 99.5%)、正己烷(≥ 99.5%)、烯丙胺(≥ 99.5%)、β-环糊精(≥ 99.7%)、对甲苯磺酰氯(≥ 99.5%)及甲醇(≥ 99.5%)、丙酮(≥ 99.5%)等常用试剂采购于天津光复化学试剂厂。多氯联苯标准品(PCB28、PCB52、PCB101、PCB118、PCB138、PCB153、PCB180,≥ 99.8%)来自于德国Dr. E公司。实验用超纯水经过Milli-Q (密理博公司,美国)系统净化而成。
2.2 主要仪器
Thermo Nicolet 670型红外光谱仪(赛默飞世尔公司,美国),Q500型同步热分析仪(梅特勒托利多公司,美国),岛津2014型气相色谱仪(岛津公司,日本),气相色谱柱为HP-1MS型号毛细管柱,检测器为电子捕获检测器(ECD),配备量程为10 μL的微量进样器。
2.3 仪器分析条件
气相色谱实验条件:进样体积:1 μL;进样口温度:250 °C;气化室温度:320 °C;毛细管色谱柱柱温:270 °C;程序升温:初始温度设置50 °C,以10 °C·min−1的速率升温到250 °C,保持1 min,随后,以10 °C·min−1的速率升温到250 °C,保持10 min;进样时间:0.75 min;压力:0.17 Mpa,载气和尾气:高纯氮气,1.3 mL·min−1和37 mL·min−1。
红外光谱仪实验条件:采用KBr压片法;干燥的试样量:0.5–2.0 mg;干燥的KBr量:100–200 mg;对照试样结构对4000–400 cm−1区域的每一个峰进行归属讨论。
同步热分析仪实验条件:干燥的试样量:10 mg;温度设置:25–800 °C;升温速率:10 °C·min−1。
3 实验步骤
3.1 标准样品及红酒样品处理
标准样品的配制:分别称取7种多氯联苯标准品,用正己烷稀释至10 mg·L−1并定容于10 mL的棕色容量瓶中,标准品储备液放置于4 °C冰箱中储存备用。
选用本地超市的红酒为样品,取50 mL样品红酒加入氯化钠(2.0 g)、硫酸钠(2.0 g)和正己烷溶剂(5.0 mL),以4500 r·min−1的转速离心20 min后取上清液,经滤膜过滤后上清液保存至4 °C储存备用。空白样品及加标混合液样品的配制方法如上。
3.2 固相微萃取柱装置的制备(教师制备,视频演示)
毛细管内壁的处理:取长度为40 cm的石英毛细管柱用丙酮、氢氧化钠(1.0 mol·L−1)、盐酸(1.0 mol·L−1)、高纯水和丙酮依次冲洗30 min后用氮气吹干毛细管管壁。丙酮与甲基丙烯酸氧丙基三甲氧基硅烷的混合液通入干燥的毛细管内,将毛细管两端的开口用硅胶塞封闭,在恒温的50 °C水浴中反应14 h。用丙酮冲洗冷却至室温后的毛细管柱,用氮吹法去除未反应的试剂。
改性剂的制备:制备过程见图1a。首先,以碱法反应通过β-环糊精与对甲苯磺酰氯(p-TsCl)和烯丙胺溶剂合成6位取代的烯丙基β-环糊精。随后,将烯丙基β-环糊精和氧化亚铜碱性溶液在室温下混合后置于在水浴反应器中连续反应2 h,过滤清洗后的物质经60 °C真空烘箱中干燥24 h,得到烯丙基β-环糊精氧化亚铜改性剂。

图1 (a) 固相微萃取柱的制备;(b) 萃取过程图
称取甲基丙烯丁酸酯(BMA,360 mg)、偶氮二异丁腈(AIBN,4.0 mg)、乙二醇二甲基丙烯酸酯(EDMA,240 mg)、正丙醇(610 mg)、1,4-丁二醇(790 mg)及烯丙基β-环糊精氧化亚铜改性剂(110 mg)作为聚合反应液。将聚合反应液振荡20 min混匀,通入氮气,再将反应液通入处理后的毛细管中,在60 °C恒温水浴中进行16 h的反应,反应结束后将未参与反应的物质用甲醇冲洗除去。将所制备的微萃取柱用两液混合硬化胶(AB胶)固定在5 mL注射器针栓位置,取代金属针头,得到固相微萃取柱装置。图2为固相微萃取柱装置结构。
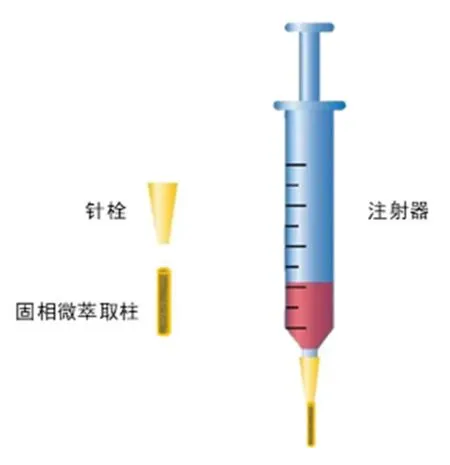
图2 固相微萃取柱装置结构示意图
在实际本科生仪器分析实验中,重点在于让学生熟悉仪器表征方法以及采用标准曲线法对多氯联苯含量的检测。实验所用固相微萃取柱装置的制备过程由实验教师先行完成,将录制完整的合成过程教学演示视频作为先导课程,辅助学生学习和巩固有机合成方面的知识。
3.3 萃取过程及实验条件优化
固相微萃取柱对有机氯污染物的萃取过程主要包括预处理、上样、清洗、洗脱四个步骤,具体步骤见图1b。预处理步骤:吸取0.2 mL甲醇和0.5 mL磷酸缓冲溶液,依次以0.05 mL·min−1的流速冲洗并活化萃取柱;上样:吸取1.0 mL的待测样品溶液以0.1 mL·min−1的流速流过萃取柱;清洗:以与样品溶液同样的流速推入0.2 mL的磷酸缓冲溶液;洗脱:以0.05 mL·min−1的流速推入0.1 mL的洗脱液,并在萃取柱的出口处收集洗脱液,以备后续分析使用。
为了达到更好的萃取性能,我们优化了影响萃取实验的样品流速及解吸液流速,样品及解吸液的流速决定了萃取时间的长短,决定了固相微萃取柱的柱背压高低,决定了萃取效率的优劣。本实验选用浓度为10 ng·mL−1的多氯联苯标准品,采用单因素控制变量法,对其进行优化以达最优的萃取效果。
4 结果与讨论
4.1 固相微萃取柱的表征
为成功合成确定固相微萃取柱,对所合成的改性剂进行红外光谱的表征,采用KBr红外压片法,如图3所示,图3a中1365和845 cm−1处出现的峰分别对应甲苯磺酰化β-环糊精的S=O和C―H伸缩振动峰。在图3b中,1640、1571和1080 cm−1处出现的红外峰分别为中间体烯丙基β-环糊精的C=C、N―H和C―N的振动峰。图3c中,除了图3b中的红外峰,在630 cm−1处新增了一个属于O―Cu(I)的红外吸收峰,以上结果可以表明烯丙基β-环糊精-氧化亚铜的成功合成。
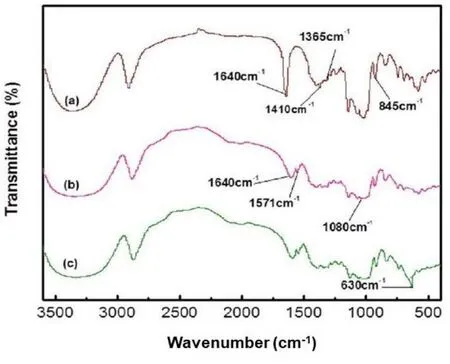
图3 对甲苯磺酰化β-环糊精(a)、烯丙基β-环糊精(b)、烯丙基β-环糊精-氧化亚铜(c)的红外谱图
为了评价萃取柱的热稳定性能,用细针将毛细管萃取柱内的材料推出并收集以备热重分析实验使用,将收集的萃取柱内材料置于样品室,在室温下以10 °C·min−1的速率升温到850 °C,结果如图4所示。在250 °C之前材料热稳定性较好,当温度在400–450 °C之间,材料产生明显的热失重至质量不再损失,表明所制备的萃取柱装置热稳定性良好,符合萃取实验所需。

图4 (甲基丙烯丁酸酯-乙二醇二甲基丙烯酸酯-烯丙基β-环糊精-氧化亚铜)萃取柱的热失重分析图
4.2 样品流速和解吸液流速对萃取效率的影响
本实验选取1.0 mL样品量,在样品流速为0.05–0.2 mL·min−1的范围内,考察不同样品流速对萃取柱富集多氯联苯的富集能力的影响,结果如图5a所示,当样品流速从0.05 mL·min−1开始增大时,气相色谱图中目标分析物的峰面积随流速的增大而增大,峰面积在样品流速为0.1 mL·min−1时达到最大,其后峰面积随流速的增大而减小。之后,采用同样的控制变量法对解吸液流速进行优化(图5b),选取0.1 mL为解吸液体积,在0.02–0.1 mL·min−1流速的范围内考察解吸效率的变化趋势。综合考虑萃取时间及柱背压的影响,最终实验选取0.1和0.05 mL·min−1作为样品与解吸液流速。
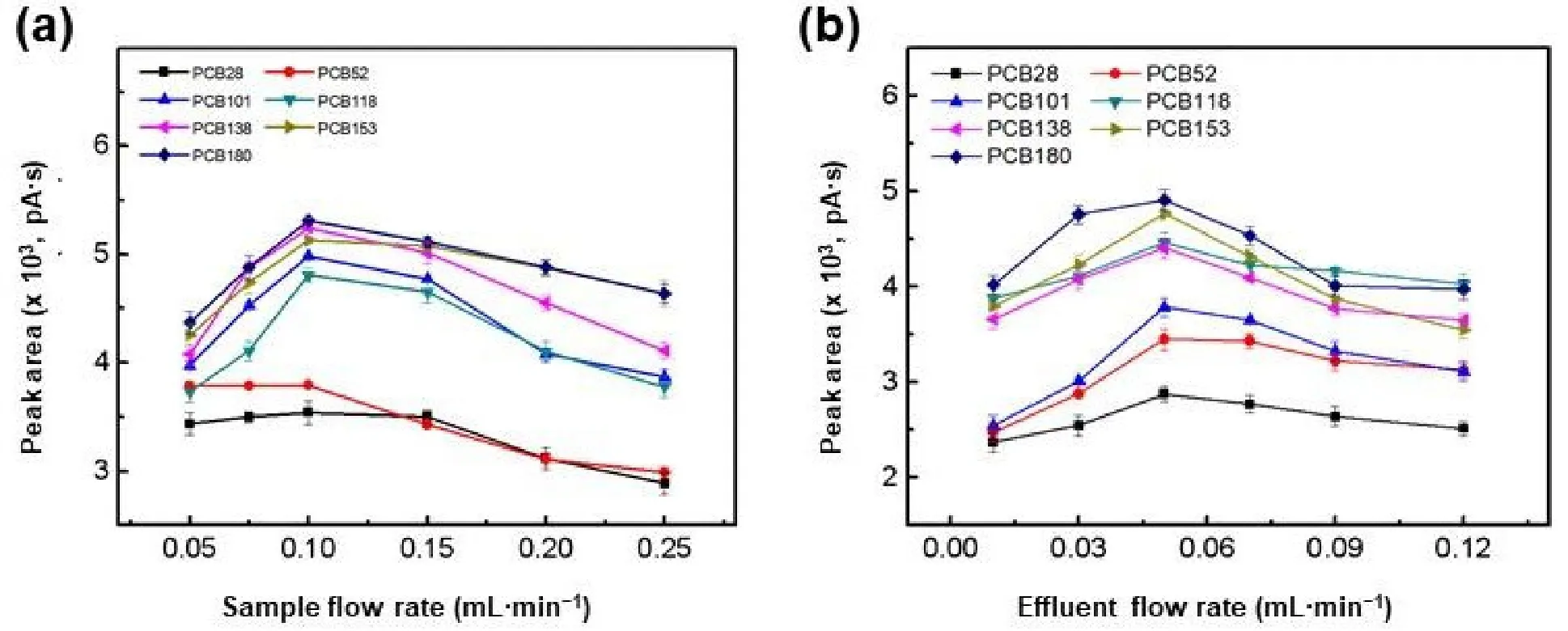
图5 样品流(a)速和解吸液流速(b)对萃取效率的影响
4.3 多氯联苯的标准曲线绘制
在最佳的萃取条件下,用固相微萃取柱结合气相色谱法对多氯联苯标准品进行了分离检测。在7支10 mL的容量瓶中分别加入10 mg·L−1的标准储备液0.000、0.001、0.010、0.050、0.100、0.250、0.500 mL,加入正己烷溶液定容至10 mL,摇匀。将所配制溶液依次经过萃取柱萃取,收集萃取液,用微量进样器吸取1 μL的样品送入气相色谱进样口。经检测,本方法检出的7种多氯联苯均线性关系良好,相关性系数(R)达0.9980以上。图6为典型的气相色谱图。
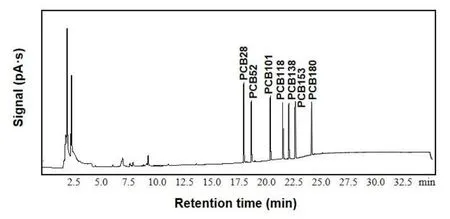
图6 七种多氯联苯的典型色谱图
4.4 红酒样品中多氯联苯含量的测定
红酒样品均购于本地超市,让学生通过加标回收的实验测定实际样品中多氯联苯的回收率,加标回收实验为向样品中加入低、高两种浓度(1.0和10 ng·mL−1)标准的多氯联苯标准品。回收率实验结果见表1所示。
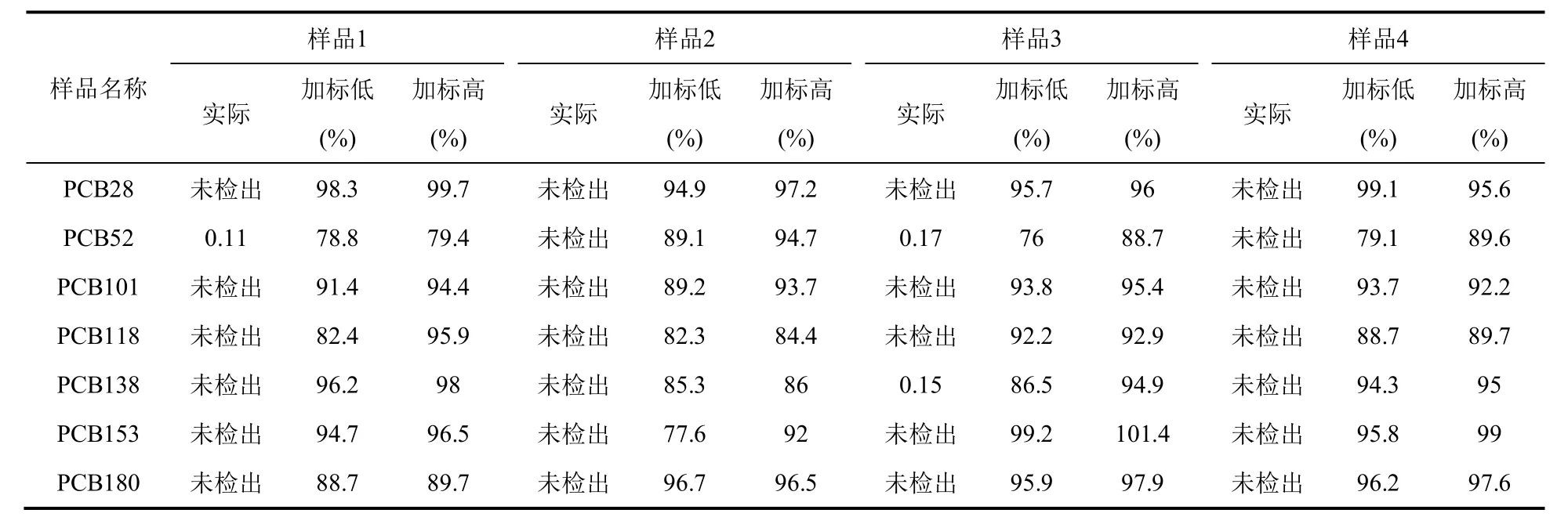
表1 回收率实验
5 教学实践与结论
本实验共需用时5–6 h,采取团队分工配合的方式完成实验内容。实验开始后,每2人为一组,分为以下五个步骤展开:(1) 课前预先观看教师演示视频,掌握固相微萃取柱的制备流程,此步骤全部同学参加;(2) 查阅相关文献,了解固相微萃取柱的红外及热重分析表征流程,了解待测物性质,此步骤全部同学参加;(3) 制定实验方案并与教师讨论,设计对照实验,调整并优化最终实验方案,此步骤全部同学参加;(4) 开展实验:① 第一组同学配制不同加标浓度的样品,使用气相色谱仪对影响萃取效率的不同的因素进行优化并绘制标准曲线,② 第二组同学使用红外光谱仪对固相微萃取柱内固体样品进行表征分析,③ 第三组同学使用同步热分析仪对固相微萃取柱内固体样品进行表征分析,④ 第四组同学使用气相色谱仪对实际样品进行定量分析;(5) 数据分析,并对所得到的实验结果进行小组内探讨,此步骤全部同学参加。
我们的教学团队多年从事仪器分析课程的理论课与实验课教学,与学生共同探讨实验改进方案,结合相关文献成果对实验课程的安排与实验步骤进行优化,使用了红外光谱法和同步热分析法作为表征手段,通过对样品前处理技术的学习和利用气相色谱法对样品进行检测,既改善了原有实验课程的单调性,又提高了实验课程的趣味性。通过对不同仪器的使用,加深了学生对仪器性质及操作的认知;通过固相萃取法结合气相色谱检测的实验操作,让学生了解了仪器分析全流程的操作技术手段。同时,在教学的过程中,教师通过学生对实验各步骤的操作,更加综合地掌握了学生动手实践中较为薄弱的环节,并对教学内容进行相应的改进,在明显提升实验教学质量的同时,也进一步提升了实验教师的教学业务水平。
